Acide cinnamique
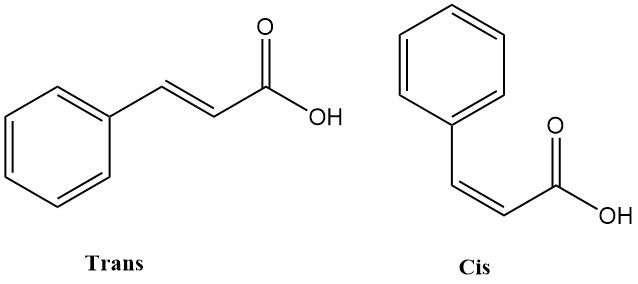
L’acide cinnamique (acide 3-phénylpropénoïque) est un composé organique de formule chimique C6H5CH=CHCOOH trouvé dans la nature et disponible dans le commerce. Il existe sous deux formes isomères : cis et trans. L’isomère trans est plus stable et constitue la forme prédominante trouvée naturellement et commercialement.
En 1780, l’acide cinnamique a été isolé sous forme de cristaux de l’huile de cannelle par Trommsdorf, qui l’a confondu avec l’acide benzoïque. Plus tard, en 1835, Dumas et Péligot l’identifièrent. Bertagnini a synthétisé avec succès l’acide cinnamique à partir du benzaldéhyde et du chlorure d’acétyle en 1856.
Table des matières
1. Propriétés physiques de l’acide cinnamique
Les propriétés physiques de l’acide trans-cinnamique sont les suivantes :
- Numéro CAS : 140-10-3
- Poids moléculaire : 148,16 g/mol
- Aspect physique : Cristaux incolores avec une légère odeur balsamique
- Point de fusion : 133 °C
- Point d’ébullition : 300 °C (101,3 kPa) et 173 °C (13,3 kPa)
- Densité : 1,2475 g/cm³ à 4 °C et 1,0270 g/cm³ à 180 °C
- pKa à 25 °C : 4,46
- Chaleur de combustion : 30,5 kJ/g
- Solubilité : Légèrement soluble dans l’eau, hautement soluble dans les solvants organiques polaires comme éthanol, méthanol, chloroforme et acétone.
L’acide cis-cinnamique [102-94-3] existe sous trois formes cristallines: l’acide cis-allocinnamique (point de fusion 68 °C ) et deux acides cis-isocinnamiques (point de fusion 58 °C et 42 °C).
L’acide cis-isocinnamique à point de fusion inférieur est très instable et se convertit facilement en acide cis-allocinnamique. L’interconversion entre les trois formes est possible en inoculant leurs masses fondues.
2. Réactions chimiques de l’acide cinnamique
L’acide cinnamique présente une réactivité caractéristique à la fois de son groupe carboxyle et de la double liaison oléfinique.
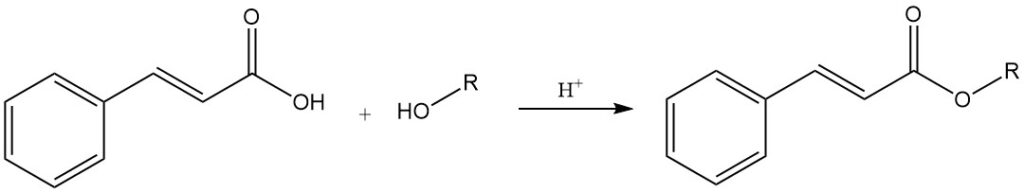
L’acide cinnamique réagit avec les alcools pour former des esters de cinnamate, dont certains possèdent des propriétés aromatiques et parfumantes importantes. Il réagit avec les chlorures d’acides inorganiques (chlorure de thionyle et chlorures de phosphore) pour donner du chlorure de cinnamoyle.
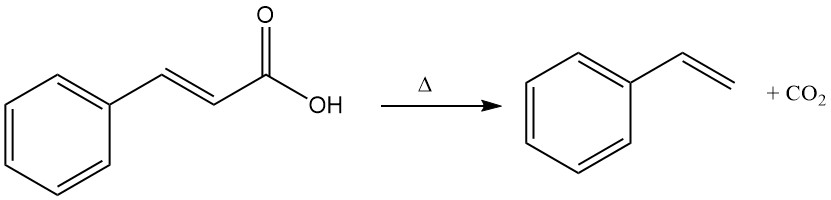
L’acide cinnamique subit une décomposition thermique (décarboxylation) pour former du styrène et du dioxyde de carbone.
Le benzaldéhyde peut être produit en clivant la double liaison avec des agents oxydants ou en chauffant avec un alcali.
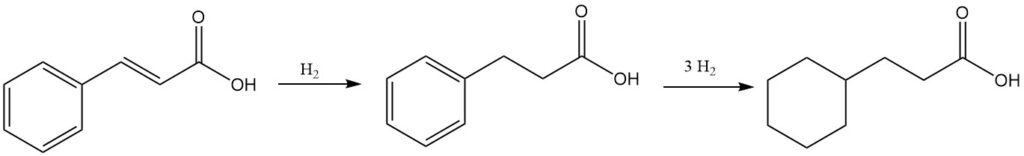
L’acide cinnamique peut être hydrogéné pour donner soit de l’acide 3-phénylpropionique, soit de l’acide 3-cyclohexylpropionique, selon les conditions de réaction.
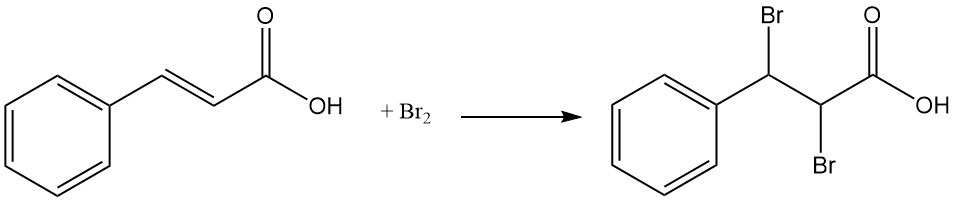
Sous la lumière du soleil, l’acide cinnamique forme des dimères, notamment l’acide truxinique et l’acide α-truxillique.
Les réactions de substitution sur le cycle benzénique de l’acide cinnamique sont rarement utilisées pour produire de nouveaux dérivés.
3. Occurrence dans la nature
L’acide cinnamique, principalement sous sa forme trans, se trouve naturellement sous forme libre et estérifiée (cinnamates) dans diverses matières végétales.
Le formulaire libre se trouve dans :
- Huile de cassia
- Extraire l’huile de Populus balsamifera
- Huiles essentielles de feuilles et d’écorces de Citrus bigaradia
Différents esters de cinnamate se trouvent dans les matières végétales, notamment le cinnamate de méthyle présent dans les huiles des espèces Alpinia et des variétés Ocimum canum, ainsi que les cinnamates de benzyle, de cinnamyle et d’hydrocinnamyle, présents au Pérou, à Tolu et dans les huiles de baume de storax. Les résines de benjoin du Siam et de Sumatra contiennent également des cinnamates.
4. Production d’acide cinnamique
La production commerciale d’acide cinnamique favorise principalement l’isomère trans à travers divers processus établis :
4.1. Production d’acide cinnamique par réaction de Perkin
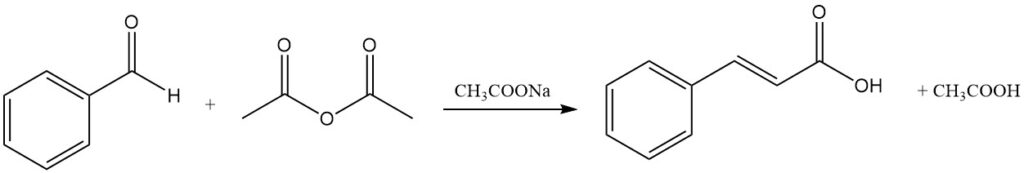
La réaction de Perkin est la méthode commerciale traditionnelle de production d’acide cinnamique par condensation du benzaldéhyde avec de l’anhydride acétique en présence d’un catalyseur, généralement de l’acétate de sodium. D’autres catalyseurs, comme l’acétate de potassium, les amines tertiaires, le phosphate de potassium et le borate de triméthyle, peuvent également être utilisés.
4.2. Production d’acide cinnamique par condensation de Claisen
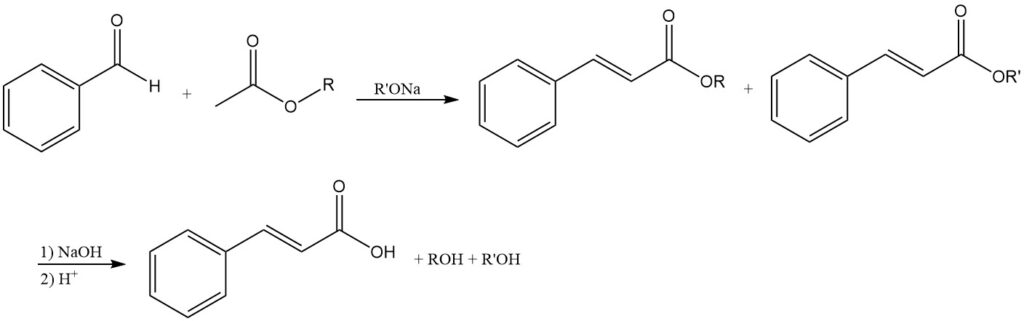
La condensation du benzaldéhyde avec des esters d’acide acétique à l’aide d’alcoolates alcalins produit des esters d’acide cinnamique comme produits initiaux qui, après saponification, donnent de l’acide cinnamique.
4.3. Production d’acide cinnamique à partir de chlorure de benzal
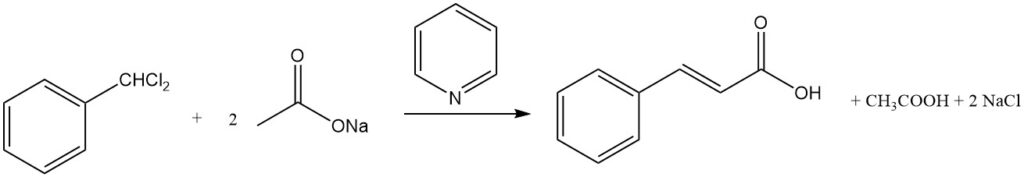
L’acide cinnamique peut être synthétisé avec des rendements élevés par la réaction du chlorure de benzal et de l’acétate alcalin dans un milieu alcalin. La présence d’amines comme la pyridine peut encore augmenter le rendement jusqu’à plus de 80 %.
4.4. Production d’acide cinnamique par oxydation du cinnamaldéhyde
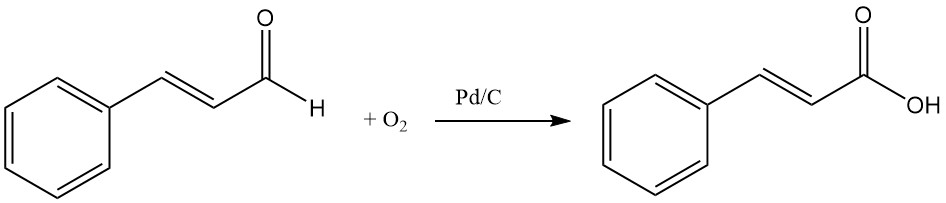
L’acide cinnamique peut être produit par oxydation du cinnamaldéhyde à l’aide d’oxygène et de catalyseurs tels que l’argent ou le palladium sur charbon.
4.5. Préparation de l’acide cinnamique à partir de ses esters
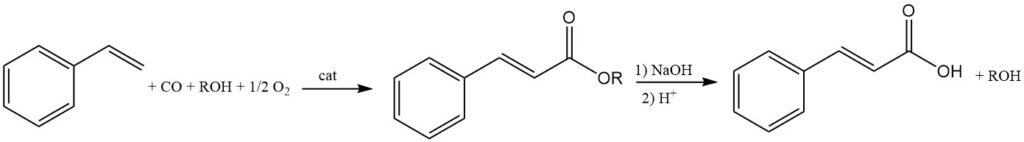
Les esters d’acide cinnamique sont formés par la réaction du styrène, des alcools, du monoxyde de carbone et de l’oxygène à l’aide de catalyseurs au platine ou au palladium. L’acide cinnamique souhaité peut alors être obtenu à partir de l’hydrolyse de ces esters.
5. Utilisations de l’acide cinnamique
L’acide cinnamique est utilisé comme précurseur dans la production d’édulcorants artificiels (aspartame) et d’agents aromatisants dans les aliments et les boissons et a des applications potentielles dans les produits cosmétiques et pharmaceutiques en raison de ses propriétés antimicrobiennes et anti-inflammatoires.
Les esters d’acide cinnamique, dérivés de l’acide cinnamique, sont largement utilisés dans les parfums et les cosmétiques pour leurs arômes agréables.
L’acide cinnamique est utilisé comme intermédiaire dans la production enzymatique de L-phénylalanine, un composant clé des édulcorants peptidiques (aspartame).
Le cinnamate de sodium inhibe efficacement la corrosion et est utilisé dans diverses applications.
L’acide cinnamique agit comme un inhibiteur de corrosion lors de la galvanoplastie du zinc (sans cyanure) et lors de l’élimination du tartre sur les surfaces en zinc et dans les bombes aérosols.
L’acide cinnamique est utilisé comme stabilisant thermique à faible toxicité pour le PVC, comme agent de réticulation pour divers polymères, notamment les polyuréthanes et les copolymères de téréphtalate de diméthyle et d’éthylène glycol, et comme ignifuge pour le polycaprolactame.
Il est également utilisé dans la production d’adhésifs polyuréthane résistants au lavage pour les fibres de polyester et pour améliorer la stabilité au stockage des revêtements de résine alkyde modifiée à l’huile siccative.
6. Toxicologie de l’acide cinnamique
Toxicité aiguë
- Oral (rats) : DL50 = 2,5 g/kg (relativement faible, indiquant une toxicité orale modérée)
- Dermique (lapins) : DL50 > 5 g/kg (relativement élevé, indiquant une faible toxicité cutanée)
Irritation cutanée
- L’acide cinnamique pur provoque une légère irritation de la peau intacte ou abrasée du lapin après une exposition de 24 heures.
Sensibilisation cutanée
- Une solution à 4 % d’acide cinnamique dans de la vaseline n’a pas provoqué de sensibilisation chez les sujets humains.
Référence
- Cinnamic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a07_099
