1-Propanol : propriétés, réactions, production et utilisations
Qu’est-ce que le 1-propanol ?
Le 1-propanol, également appelé alcool n-propylique ou propan-1-ol, est un alcool primaire de formule chimique CH3CH2CH2OH. C’est un liquide clair et incolore à l’odeur alcoolique caractéristique, miscible à l’eau, à l’éthanol et à l’éther.
Le 1-propanol est un isomère structural de l’alcool isopropylique, mais ce dernier a une importance industrielle plus grande en raison de son utilisation répandue comme solvant et désinfectant.
Dans la nature, le 1-propanol se trouve dans les huiles de fusel et est formé comme produit mineur de la fermentation et lors de la détérioration ou de la décomposition de la matière végétale.
Table des matières
1. Propriétés physiques du 1-propanol
Le 1-propanol est un liquide clair et incolore à l’odeur alcoolique caractéristique. Il est parfaitement miscible à l’eau et facilement soluble dans de nombreux solvants organiques, notamment les éthers, les esters, les acides, les cétones et autres alcools.
Les propriétés physiques du n-propanol sont résumées dans le tableau 1.
| Propriété | Valeur |
|---|---|
| Numéro de registre CAS | 71-23-8 |
| Formule chimique | C3H8O |
| Masse molaire, g/mol | 60,09 |
| Point de congélation, °C | −126,2 |
| Point d'ébullition, °C | 97,20 |
| Pression de vapeur, kPa | à 20 °C : 1,987 à 40 °C : 6,986 à 60 °C : 20,292 à 80 °C : 50,756 |
| Équation d'Antoine (2–120 °C, t en °C) | log P(kPa) = 6,97257 − 1499,21 / (204,64 − t) |
| Densité de vapeur (air = 1) | 2,07 |
| Densité à 20 °C, g/cm3 | 0,80375 |
| Équation de Francis (−21 à 180 °C, t en °C) | Densité = 0,8813 + (5,448 × 10-4 t) − 21,536 / (313,09 − t) |
| Indice de réfraction, nD20 | 1,38556 |
| Viscosité à 20 °C, mPa·s | 2,256 |
| Tension superficielle à 20 °C, mN/m | 23,75 |
| Température critique, °C | 263,65 |
| Pression critique, kPa | 5169,60 |
| Densité critique, g/cm3 | 0,275 |
| Capacité thermique (liquide, 25 °C), J/(mol·K) | 141 |
| Chaleur de vaporisation, kJ/mol | à 25 °C : 47,53 à 97,20 °C : 41,78 |
| Chaleur de combustion (liquide, 25 °C), kJ/mol | 2033 |
| Chaleur de formation (vapeur, 25 °C), kJ/mol | −254,7 |
| Point d'éclair (coupelle ouverte Tag), °C | 28,9 |
| Température d'auto-inflammation, °C | 371,1 |
| Limites d'explosivité dans l'air, % vol. | Inférieure : 2,2 Supérieure : 14,0 |
| Conductivité électrique à 25 °C, S | 2 × 10-8 |
2. Réactions chimiques du 1-propanol
La chimie du 1-propanol est typique des alcools primaires de faible masse moléculaire. Il subit diverses réactions caractéristiques de la fonction hydroxyle, notamment l’oxydation, l’estérification, l’amination, la déshydratation et l’éthérification. Dans les systèmes biologiques, le 1-propanol est facilement dégradé et est considéré comme l’un des alcools les plus facilement biodégradables.
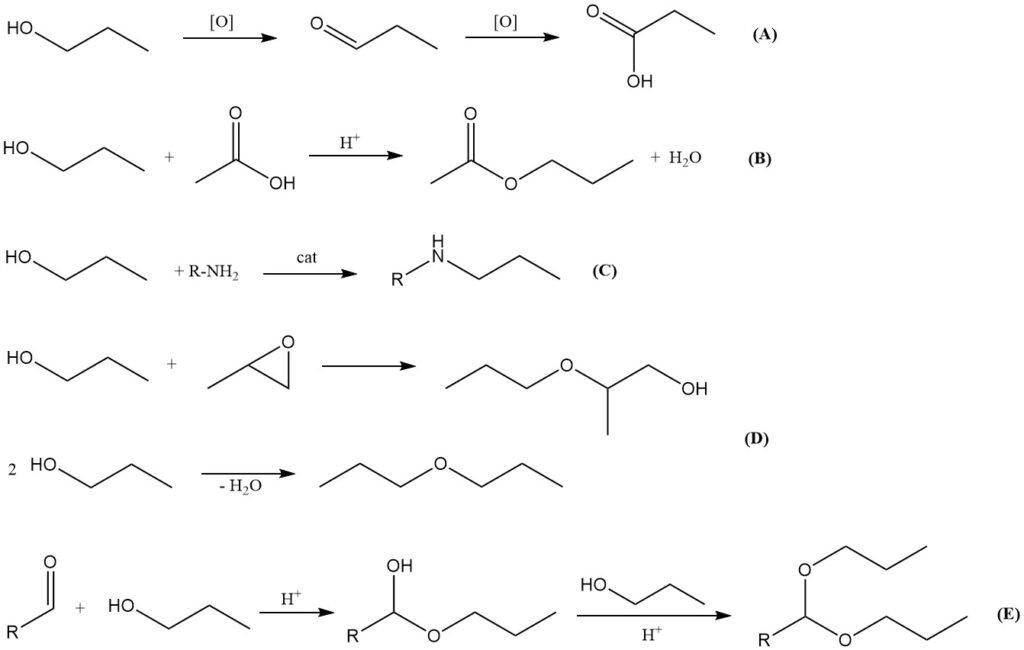
Oxydation (A)
L’oxydation du 1-propanol conduit d’abord à l’aldéhyde correspondant, le propanal, puis à l’acide propionique. Une oxydation partielle peut être obtenue à l’air en présence de catalyseurs métalliques tels que le chromite de cuivre, les oxydes de chrome (VI) ou les sels de pyridinium.
Estérification (B)
Comme d’autres alcools, le 1-propanol réagit avec les acides organiques et inorganiques pour former des esters. La réaction avec l’acide acétique en présence de catalyseurs acides forts (par exemple, l’acide sulfurique, l’acide p-toluènesulfonique, l’acide méthanesulfonique ou les résines échangeuses d’ions) produit de l’acétate de n-propyle, un solvant important utilisé dans les revêtements, les encres et l’industrie des parfums.
La transestérification avec l’acétate de méthyle ou d’éthyle peut également être utilisée pour produire de l’acétate de n-propyle.
Amination (C)
Le 1-propanol peut subir une amination réductrice avec de l’ammoniac ou des amines à température et pression élevées, en présence de catalyseurs à base de métaux de transition tels que le nickel, le cobalt ou le molybdène. Cette réaction produit des dérivés de propylamine, bien que ceux-ci aient une importance industrielle moindre que les dérivés d’isopropylamine correspondants.
Étherification et déshydratation (D)
La réaction du 1-propanol avec des oxydes d’alkylène (par exemple, l’oxyde d’éthylène et l’oxyde de propylène) produit des éthers de glycol, largement utilisés comme solvants. La déshydratation du 1-propanol peut produire de l’éther di-n-propylique à l’aide de catalyseurs acides solides. La déshydratation en propène est également possible, mais n’a pas d’importance industrielle pratique.
Formation d’acétals (E)
Comme d’autres alcools primaires, le 1-propanol réagit avec les aldéhydes pour former des hémiacétals, qui peuvent ensuite être convertis en acétals en présence de catalyseurs acides dans des conditions de déshydratation. Les acétals dérivés du 1-propanol servent d’intermédiaires en synthèse pharmaceutique.
3. Production industrielle du 1-propanol
Le 1-propanol est principalement produit industriellement par hydroformylation (procédé Oxo) de l’éthylène pour former du propanal (propionaldéhyde), suivie d’une hydrogénation catalytique en alcool.
Un procédé d’oxydation du propane en phase vapeur était autrefois utilisé par Celanese à Bishop, au Texas, mais cette voie a été abandonnée en 1973. Depuis lors, la technologie OXO est la méthode prédominante aux États-Unis et en Europe.
En Afrique du Sud, Sasol produit du 1-propanol par synthèse Fischer-Tropsch. Des tentatives de production de 1-propanol par hydratation anti-Markovnikov du propylène ont été étudiées, mais n’ont pas encore abouti à une application commerciale.
3.1. Production de 1-propanol par hydroformylation et hydrogénation
La production commerciale de 1-propanol par hydroformylation (procédé oxo) se déroule en deux étapes. L’éthylène est d’abord converti en propanal par hydroformylation avec du gaz de synthèse (1), puis hydrogéné par catalyse en 1-propanol (2).
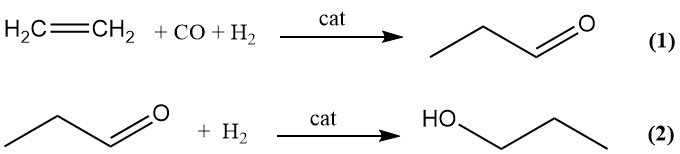
Les sous-produits mineurs de l’étape d’hydroformylation comprennent le propane, le 1-propanol et les fractions lourdes formées par condensation aldolique. Les complexes carbonyles de métaux de transition (cobalt, fer, nickel, rhodium et iridium) peuvent catalyser la réaction oxo, mais seuls le cobalt et le rhodium sont utilisés commercialement.
Aux États-Unis, le 1-propanol est fabriqué par technologie oxo chez Texas Eastman, Union Carbide et Hoechst Celanese. Texas Eastman utilisait initialement des catalyseurs HCo(CO)4 à base de cobalt, avant d’adopter un système au rhodium modifié par la phosphine en 1989. En Europe, la production est assurée par Hoechst AG et BASF AG.
Le catalyseur au rhodium-triphénylphosphine a largement remplacé les catalyseurs au cobalt en raison de ses vitesses de réaction plus élevées, de sa stabilité améliorée, de ses pressions de fonctionnement réduites et de la réduction de la production de sous-produits. Les rhodium-carbonyles conviennent aux installations initialement conçues pour les catalyseurs au cobalt.
Bien que le rhodium nécessite des pressions plus élevées, son activité est supérieure et il produit moins de fractions à haut point d’ébullition. Chez Hoechst AG en Allemagne (Werk Ruhrchemie), les rhodium-carbonyles sont utilisés pour la synthèse du propanal, qui est ensuite hydrogéné en 1-propanol. Les rhodium-carbonyles seraient 100 à 1 000 fois plus réactifs que leurs analogues au cobalt.
L’hydroformylation de l’éthylène avec des catalyseurs au rhodium est réalisée à 90–120 °C, sous 2,17–3,55 MPa, avec des rapports H2:CO de 1:1–3:1, des concentrations en rhodium de 1–10 mM et des concentrations en triphénylphosphine de 0,1–0,4 M. Dans ces conditions, le rendement en propanal atteint 98–99 %, avec une conversion en éthane et en fractions lourdes de 0,5–1,0 %.
L’activité catalytique est inhibée par les sources de rhodium contenant des halogènes, car les complexes halogénés présentent de faibles performances d’hydroformylation. Le précurseur de catalyseur le plus actif est l’hydridocarbonyltris(triphénylphosphine)rhodium, HRhCO\[P(C6H5)3]3, qui génère des espèces actives par dissociation d’un ligand triphénylphosphine.
Un excès de triphénylphosphine inhibe la désactivation du catalyseur causée par la migration du phényle du phosphore vers le rhodium, laquelle conduit à la formation d’agrégats rhodium-phosphure inactifs.
L’hydrogénation du propanal en 1-propanol est un procédé bien établi. Les catalyseurs à base de nickel, tels que le nickel de Raney ou le nickel supporté, et les catalyseurs à base d’oxyde de cuivre-chrome sont couramment utilisés. Les méthodes d’hydrogénation en phase vapeur et en phase liquide sont employées.
L’hydrogénation en phase liquide est réalisée à une pression de 2,17 à 4,24 MPa et à une température de 100 à 170 °C. L’hydrogénation en phase vapeur se fait généralement à une pression inférieure à 790 kPa. Des configurations de réacteur à lit fixe, à lit en suspension ou à lit ruisselant sont utilisées. Des rendements en 1-propanol supérieurs à 95 % sont obtenus.
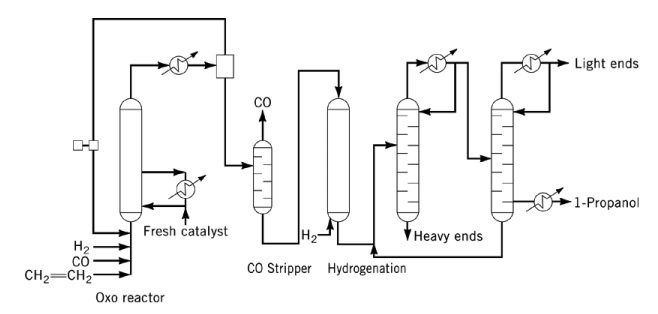
Les sous-produits comprennent les acétals, les éthers, les esters et les diols. Le CO et la triphénylphosphine agissent comme des poisons catalytiques et doivent être éliminés de la charge avant l’hydrogénation.
En exploitation industrielle, la vapeur de propanol est extraite de l’effluent du réacteur oxo à l’aide de l’excès de gaz de synthèse, puis condensée et éliminée du CO avant l’hydrogénation. Le 1-propanol brut obtenu est purifié dans un système de distillation à deux colonnes.
Lorsque des catalyseurs au cobalt-carbonyle ou au rhodium-carbonyle sont utilisés, le soutirage liquide du propanal est nécessaire en raison des pressions plus élevées du réacteur, et des dispositions supplémentaires pour la récupération et la manipulation du catalyseur sont requises.
3.2. Production de 1-propanol par le procédé Sasol Fischer-Tropsch
Sasol produit du 1-propanol comme produit secondaire de la synthèse Fischer-Tropsch. Dans ce procédé, le charbon est gazéifié dans des réacteurs à lit fixe Lurgi pour produire du gaz de synthèse (CO et H2). Le flux gazeux est séparé des composants condensables, purifié et introduit dans l’unité Sasol Synthol.
Dans les réacteurs à lit fluidisé, le gaz est mis en contact avec un catalyseur à base de fer finement divisé, où la réaction de Fischer-Tropsch, hautement exothermique, produit un mélange d’hydrocarbures et de composés oxygénés.
Les condensats des réacteurs se séparent en une fraction hydrocarbonée et une phase aqueuse. La phase aqueuse contient un mélange d’alcools et de cétones. La plupart des alcools sont mélangés à de l’essence à indice d’octane élevé, tandis que certaines fractions alcooliques sont distillées pour récupérer des produits purs.
À partir de ces opérations, le 1-propanol et l’éthanol sont isolés dans un système de séparation multi-unités d’une capacité annuelle globale d’environ 25 000 à 30 000 tonnes.
4. Utilisations du 1-propanol
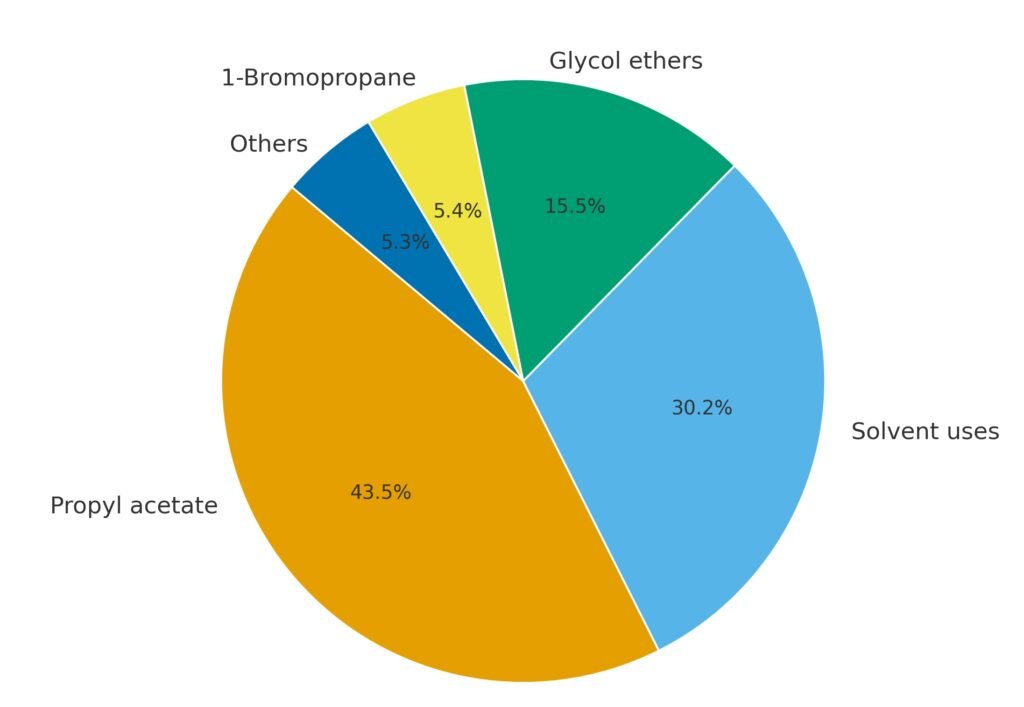
Le 1-propanol est principalement utilisé comme solvant et intermédiaire chimique. Son dérivé le plus important est l’acétate de n-propyle, qui représente la plus grande part de la consommation mondiale.
Le 1-propanol est largement utilisé comme solvant dans les encres d’impression flexographique et hélio, notamment pour l’impression sur films polyoléfines et polyamides. Comparé à l’éthanol et au 2-propanol, il offre des avantages en termes de qualité d’impression et de séchage. Il est également utilisé comme solvant dans les peintures, les revêtements, les cosmétiques, les pesticides et les insecticides.
En Europe, le 1-propanol a gagné en importance comme ingrédient dans les désinfectants pour les mains et les surfaces en raison de sa forte activité biocide contre les bactéries, les champignons et les virus.
Une grande partie du 1-propanol est convertie en acétate de n-propyle, utilisé comme solvant dans les encres, les laques, les dérivés de la cellulose, les cires et les formulations d’insecticides. D’autres esters, comme le propionate de n-propyle, sont utilisés dans les revêtements et sont considérés comme des substituts à l’acétate de n-butyle grâce à leurs caractéristiques olfactives améliorées.
Le 1-propanol est une matière première pour la production d’éthers de glycol, tels que l’éther monopropylique d’éthylène glycol, l’éther monopropylique de diéthylène glycol, l’éther monopropylique de propylène glycol et l’éther monopropylique de dipropylène glycol. Ces solvants allient un pouvoir solvant élevé à une compatibilité avec l’eau et sont utilisés dans les revêtements et les nettoyants.
En Europe, une fraction importante du 1-propanol est convertie en propylamines, intermédiaires dans la fabrication d’herbicides et de produits pharmaceutiques.
Le 1-propanol est un précurseur du 1-bromopropane, un solvant utilisé comme substitut du chlorure de méthylène et des composés appauvrissant la couche d’ozone.
Parmi ses applications mineures, on peut citer l’utilisation comme ingrédient aromatique et parfumant, comme cosolvant dans les formulations de pesticides et comme additif alimentaire.
5. Toxicologie du 1-propanol
Le 1-propanol est classé comme liquide inflammable avec un point d’éclair inférieur à 38 °C. Il est réglementé comme substance dangereuse par l’Administration de la sécurité et de la santé au travail (OSHA) en vertu de la norme 29 CFR 1910.1200.
Les études de toxicité montrent que le 1-propanol n’est que légèrement toxique pour les animaux (tableau 2). Il produit des résultats négatifs au test d’Ames et au test de mutation directe du lymphome de souris, ce qui indique l’absence de potentiel mutagène.
| Mode d'administration / Paramètre | Valeur |
|---|---|
| Dose orale, rats, DL50 | 1,9 g/kg |
| Dose cutanée, lapins, DL50 | 5,4 g/kg |
| Inhalation, rats, CL50 | 24 000 ppm |
| VLE ACGIH VME | 200 ppm |
| Classification des risques (NFPA : Santé, Inflammabilité, Réactivité) | 1, 3, 0 |
| Classification des risques (HMIS : Santé, Inflammabilité, Réactivité) | 2, 3, 0 |
| Remarques : DL50 = dose létale médiane. CL50 = concentration létale médiane. VLE = valeur limite d’exposition (VLE), VME = moyenne pondérée dans le temps. | |
Le Programme national de toxicologie (NTP) et le Centre international de recherche sur le cancer (CIRC) ne classent pas le 1-propanol comme cancérogène. Une exposition aiguë peut provoquer une irritation ou des brûlures oculaires, tandis qu’un contact cutané répété peut entraîner une dermatite. L’inhalation de concentrations excessives de vapeurs peut irriter les yeux et les voies respiratoires, et des concentrations très élevées peuvent avoir des effets narcotiques.
Aux États-Unis, le 1-propanol est répertorié dans la loi américaine sur la réponse environnementale, l’indemnisation et la responsabilité (CERCLA), avec une quantité de déversement déclarable de 45,4 kg par jour.
Il est également inclus dans les normes d’émissions atmosphériques de la section 40 CFR 60.489, qui exigent le contrôle des émissions de composés organiques volatils provenant des équipements de fabrication. Plusieurs États américains appliquent la réglementation sur le droit à l’information au 1-propanol.
Dans les réglementations sur les aliments et les pesticides, le 1-propanol est autorisé comme substance aromatisante et adjuvant en vertu de la norme 21 CFR 172.515 et est exempté des exigences de tolérance lorsqu’il est utilisé comme solvant ou cosolvant dans les formulations de pesticides.
Références
1. Unruh, J.D. and Pearson, D. (2000). n-Propyl Alcohol. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.1618151621141821.a01
2. Klabunde, J., Bischoff, C. and Papa, A.J. (2025). Propanols. In Ullmann’s Encyclopedia of Industrial Chemistry. https://doi.org/10.1002/14356007.a22_173.pub3
