Métodos de producción de aldehídos alifáticos
Los aldehídos se indican mediante la fórmula química general RCHO, donde R puede representar hidrógeno o una amplia gama de grupos alifáticos, aromáticos o heterocíclicos. De acuerdo con la nomenclatura IUPAC, los aldehídos se reconocen por el sufijo «al»; pero muchos aldehídos todavía reciben su nombre común.
El método principal para producir aldehídos es la oxosíntesis, que se logra mediante una oxidación suave (deshidrogenación) de alcoholes primarios y procesos especializados de oxidación de olefinas. En los aceites esenciales de diversas plantas, se encuentran de forma natural trazas de aldehídos. El acetaldehído, un subproducto de la fermentación del alcohol, se forma por la descarboxilación del ácido pirúvico intermediario.
Los aldehídos tienen funciones biológicas importantes, como la participación del 11-cis-retinal en el proceso visual y la participación del piridoxal en la transaminación de aminoácidos.
El aislamiento de aldehídos de fuentes naturales sólo tiene importancia comercial en unos pocos casos, como en la producción de aldehídos aromáticos de cadena más larga.
Tabla de contenido
1. Producción de aldehídos saturados
Si bien se han descubierto numerosos métodos para sintetizar aldehídos, sólo unos pocos se utilizan a escala industrial. Esto suele deberse a la disponibilidad de materias primas adecuadas. Los siguientes procesos son los más importantes para preparar aldehídos alifáticos saturados:
- Hidroformilación de olefinas, comúnmente conocida como oxosíntesis.
- Deshidrogenación u oxidación de alcoholes primarios, empleados principalmente para la producción de formaldehído a partir de metanol.
- Hidratación del acetileno, que conduce a la formación de acetaldehído (también conocido como etanal).
- Oxidación de etileno para producir acetaldehído.
- Oxidación de hidrocarburos saturados, particularmente hidrocarburos C3 y C4, para producir aldehídos inferiores.
También son importantes las síntesis específicas para producir aldehídos utilizados en la industria del perfume.
1.1. Síntesis Oxo
La síntesis oxo se destaca como el método más importante para producir aldehídos que constan de al menos tres átomos de carbono (denominada síntesis oxo). En este proceso particular, las olefinas reaccionan con el gas de síntesis, que es una mezcla de monóxido de carbono (CO) e hidrógeno (H2). Como resultado de esta reacción se forman aldehídos con un átomo de carbono adicional en comparación con la olefina de partida.

La formación de productos puros ocurre sólo cuando se trata de moléculas de olefina simétricas o estéricamente impedidas. Sin embargo, en otros casos se obtiene una mezcla de compuestos de cadena lineal y ramificada. Seleccionando cuidadosamente los catalizadores adecuados y controlando las condiciones de reacción, la relación entre los productos aldehídos normales (n) e iso (ramificados) se puede ajustar en un amplio rango.
1.2. Deshidrogenación/Oxidación de Alcoholes Primarios
Las reacciones de deshidrogenación, oxidación y deshidrogenación oxidativa están representadas por las siguientes ecuaciones:
- RCH2OH → RCHO + H2; ΔH = +84 kJ/mol for R = CH3 (Ecuación 1)
- RCH2OH + 1/2 O2 → RCHO + H2O; ΔH = -159 kJ/mol for R = H (Ecuación 2)
- RCH2OH → RCHO + H2; H2 + 1/2 O2 → H2O; ΔH = -159 kJ/mol for R = H (Ecuación 3)
Deshidrogenación: la reacción de deshidrogenación endotérmica de alcoholes se produce a presión atmosférica y temperaturas que oscilan entre 250 y 400 °C, normalmente utilizando catalizadores de Cu o Ag. Estos catalizadores suelen activarse con elementos como Zr, Co o Cr.
El proceso ofrece la ventaja de la recuperación simultánea de hidrógeno, que puede utilizarse sin purificación adicional. Es una reacción de equilibrio que requiere altas temperaturas y tiempos de residencia cortos para lograr eficiencia económica.
El proceso encuentra uso comercial en la preparación de acetaldehído a partir de etanol. La deshidrogenación en fase gaseosa con un catalizador de cobre activado por cerio se lleva a cabo a presión atmosférica y a 270-300°C, convirtiendo del 25 al 50 % del etanol por rendimiento, con una selectividad del 90 al 95 % para el acetaldehído, junto con la formación de subproductos como como acetato de etilo, etileno, crotonaldehído y alcoholes superiores.
Oxidación: El proceso de oxidación descrito por la Ecuación (2) se lleva a cabo utilizando un exceso de aire u oxígeno y un catalizador que contiene 18-19% en peso de Fe2O3 y 81-82% en peso de MoO3 a temperaturas que oscilan entre 350 y 450°C. Este método se emplea en la producción de formaldehído.
Deshidrogenación oxidativa: la ecuación (3) combina la deshidrogenación endotérmica del alcohol con la combustión exotérmica del hidrógeno formado, lo que da como resultado una reacción exotérmica general.
En el proceso industrial ambas reacciones ocurren simultáneamente cuando se utilizan cantidades subestequiométricas de oxígeno o aire. Es crucial considerar los rangos de explosión de las mezclas de alcohol y aire durante la oxidación y la deshidrogenación oxidativa.
La deshidrogenación oxidativa es el proceso más importante para producir aldehídos a partir de alcoholes. Se prefieren los catalizadores de plata, pero también se utilizan catalizadores de cobre. En la producción de formaldehído a partir de metanol, los cristales de plata (tamaño de grano de 0,2 a 3 mm), las redes de plata o la plata sobre Al2O3 alcanzan una conversión del 75 al 99 % a temperaturas de 500 a 720 °C y tiempos de residencia inferiores a 0,01 s.
En 2006, alrededor del 7% de la producción de acetaldehído de Europa occidental procedía de etanol. La plata y el cobre fueron los principales catalizadores utilizados, con conversiones de etanol de 30-50% por rendimiento y selectividad de acetaldehído de 85-95%. La temperatura de reacción osciló entre 300 y 600°C dependiendo de la cantidad de aire. Los subproductos incluyeron acetato de etilo, ácido fórmico, ácido acético y dióxido de carbono.
Aldehídos de fragancia: También se prefieren los procesos de deshidrogenación y oxidación para sintetizar aldehídos de fragancia. Un proceso especializado permite la deshidrogenación catalítica de alcoholes C5-C14 en presencia de hidrógeno y aire, utilizando catalizadores de cobre o plata, posiblemente combinados con Zn, Cr o Cr2O3.
Otros sistemas catalíticos descritos en la literatura incluyen Cu/MgO, Ag/Na2O sobre soportes, mezclas de MnO, NiO sobre MgO o CuCl con un ligando que contiene nitrógeno como 2,20-bipiridilo.
1.3. Oxidación de Hidrocarburos
Celanese ha desarrollado un proceso para la oxidación de alcanos C3 y C4, pero este método produce una mezcla de reacción compleja que requiere costosos pasos de extracción y destilación.
En este proceso, se hacen reaccionar propano y mezclas de propano-butano en fase gaseosa a temperaturas que oscilan entre 425 y 460°C y presiones de 0,7 a 0,8 MPa. La tasa de conversión es aproximadamente del 20%, con una deficiencia de oxígeno presente durante la reacción. La reacción se produce mediante un mecanismo radical.
La mezcla de reacción obtenida de este proceso consiste principalmente en acetaldehído (≈ 20%), formaldehído (≈ 15%), metanol (≈ 19%) y ácidos orgánicos (≈11%).
Sin embargo, a pesar de estos componentes, el proceso se considera tecnológicamente obsoleto. Además, la oxidación de metano o etano con este método no tiene ninguna importancia práctica.
1.4. Oxidación de olefinas
El método industrial principal y crucial para producir acetaldehído es la oxidación parcial de etileno en fase acuosa, realizada en presencia de cloruros de paladio y cobre. Este proceso se conoce como proceso Wacker-Hoechst.
Otro proceso de oxidación utilizado para preparar aldehídos a partir de olefinas es la síntesis de acroleína, que implica la conversión de propeno.
1.5. Procesos varios
El proceso que implica la adición de agua al acetileno para producir acetaldehído ha perdido su importancia en comparación con procesos alternativos basados en etileno o etanol. En Europa Occidental, las últimas plantas que utilizaron este proceso se cerraron en 1980.
La menor importancia del proceso basado en acetileno se atribuye a la fácil disponibilidad y al menor costo del etileno, así como a la selectividad superior de su conversión. Además, el uso de sulfato de mercurio nocivo para el medio ambiente como catalizador ha contribuido a que el proceso quede prácticamente obsoleto.
2. Producción de aldehídos insaturados
Los aldehídos α,β-insaturados inferiores, como la acroleína, el crotonaldehído o el 2-etil-2-hexenal, se obtienen principalmente mediante procesos sintéticos. Sin embargo, ciertos aceites esenciales pueden servir como materia prima para homólogos superiores, como el citral o el citronelal.
Existen dos procesos industriales principales para fabricar aldehídos α,β-insaturados:
1. Oxidación de olefinas: Este proceso se utiliza para preparar acroleína.
2. Deshidratación de aldoles obtenidos por condensación aldólica de aldehídos saturados: este método se emplea para producir crotonaldehído y 2-etil-2-hexenal.
Además de estos procesos, existen síntesis específicas que se utilizan para preparar aldehídos para la industria del perfume, como por ejemplo:
1. Deshidrogenación de alcoholes insaturados: este proceso se utiliza en la preparación de citral a partir de geraniol.
2. Reducción de ácidos insaturados: este método se utiliza para producir undecilenaldehído a partir de ácido undecilénico.
2.1. Oxidación de olefinas
La oxidación directa de olefinas, en concreto la oxidación de propeno, tiene una gran importancia industrial para la producción de acroleína. Esta reacción de oxidación se produce a temperaturas que oscilan entre 300 y 480 °C y emplea catalizadores de óxido de Bi-Mo modificados de diversas formas. La materia prima utilizada es una mezcla gaseosa que contiene propeno, aire y vapor de agua en una relación molar de aproximadamente 1:10:2.
Durante este proceso, se pueden lograr tasas de conversión de hasta el 98%, con rendimientos de acroleína que oscilan entre el 78% y el 92%. Sin embargo, junto con la acroleína, se forman algunos subproductos, como acetaldehído, ácido acético y ácido acrílico.
La acroleína disponible comercialmente suele tener un nivel de pureza del 95 % al 97 %. Para evitar reacciones no deseadas y mantener la estabilidad durante todos los pasos del procesamiento, normalmente se agrega un estabilizador. La hidroquinona se utiliza comúnmente como estabilizador en estos procesos.
2.2. Deshidratación de aldolos
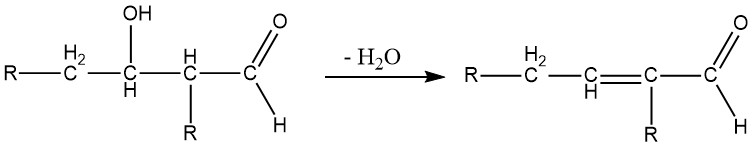
Los β-hidroxialdehídos (aldoles) son compuestos intermedios que se forman en la reacción aldólica y son muy inestables. Se descomponen fácilmente, perdiendo agua, para formar aldehídos α,β-insaturados.
Dependiendo de las condiciones de reacción, la reacción aldólica puede conducir directamente a la formación de compuestos insaturados. Este proceso se usa comúnmente para sintetizar crotonaldehído a partir de acetaldehído, 2-metil-2-pentenal a partir de propionaldehído y 2-etil-2-hexenal a partir de butanal.
La condensación aldólica de acetaldehído con cantidades catalíticas de hidróxido de sodio diluido se realiza normalmente a 20-25°C. La reacción se apaga con ácido acético para detener reacciones adicionales. En la siguiente etapa de destilación, se elimina el agua del acetaldol, lo que da como resultado crotonaldehído como producto principal. La selectividad hacia el crotonaldehído puede alcanzar valores de hasta el 95%.

La reacción aldólica puede involucrar dos moléculas de aldehído idénticas o dos especies de aldehído diferentes. En este último caso se obtiene frecuentemente una mezcla de productos. Sin embargo, seleccionando cuidadosamente los reactivos y las condiciones de reacción, es posible obtener el compuesto deseado como producto principal.
Por ejemplo, la acroleína se preparaba previamente mediante la reacción de formaldehído con acetaldehído.

De manera similar, se pueden obtener 2-metilenalcanales superiores (2-alquilacroleínas) haciendo reaccionar formaldehído con aldehídos de cadena más larga.
2.3. Procesos varios
Para la preparación de determinados aldehídos aromáticos insaturados se someten los alcoholes correspondientes a una deshidrogenación selectiva con ayuda de catalizadores de cobre, cobre-zinc o metales nobles. Estos procesos se llevan a cabo preferiblemente a presión reducida y se usan comúnmente en la producción de citral, citronelal e hidroxicitronelal.
Otro método industrial de interés para sintetizar aldehídos insaturados es la transposición de Claissen de éteres alilvinílicos. Los éteres alil vinílicos se forman como productos intermedios en este proceso según el siguiente esquema de reacción:

Los 2-alquenales también se pueden obtener haciendo reaccionar haluros de alquilo insaturados con las sales de sodio de nitrohidrocarburos secundarios. Por ejemplo, el citral se puede obtener con un rendimiento del 80 % a partir de 1-halo-3,7-dimetilocta-2,6-dieno.
Un enfoque adicional implica el tratamiento de acetales con éteres vinílicos en presencia de trifluoruro de boro. Esto da como resultado la formación de los correspondientes β-alcoxiacetales. El tratamiento posterior con ácidos conduce a la conversión de β-alcoxiacetales en aldehídos α,β-insaturados.
3. Producción de hidroxialdehídos
3.1. Condensación aldólica
La condensación aldólica, descrita por primera vez en 1872 por A. Wurtz, puede describirse en el caso de reacciones catalizadas por bases mediante el siguiente mecanismo:
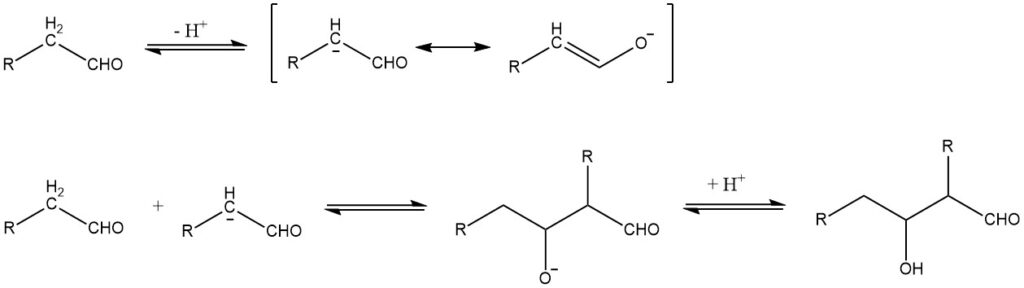
La condensación aldólica es una reacción reversible y puede ser catalizada no sólo por bases sino también por ácidos. Esto sólo es posible para aldehídos con al menos un átomo de hidrógeno α. Los aldols obtenidos de aldehídos con más de un átomo de hidrógeno α suelen ser inestables y pierden agua para formar aldehídos α,β-insaturados:
Cuando dos aldehídos diferentes con átomos de α-hidrógeno se someten a una adición aldólica, las cuatro especies aldólicas posibles generalmente se forman en cantidades variables.
Para fines industriales, las reacciones en las que sólo un reactivo posee átomos de hidrógeno α son más importantes. En tales casos, el segundo reactivo suele ser formaldehído. Las reacciones para preparar mono o polimetilolalcanales a partir de formaldehído y alcanales son comunes en los procesos industriales.
Estas reacciones exotérmicas normalmente se llevan a cabo en fase líquida y con frecuencia se emplean catalizadores como soluciones acuosas de hidróxido de sodio o carbonatos alcalinos.
También se han descrito varios otros sistemas catalíticos, incluidas zeolitas que contienen zinc o magnesio, hidróxidos alcalinos combinados con catalizadores de transferencia de fases, aminas terciarias y resinas básicas de intercambio iónico.
Los subproductos típicos de la condensación aldólica, además de los aldoles diméricos, aldoxanos y aldehídos α,β-insaturados mencionados anteriormente, incluyen acetales cíclicos, ésteres de Tishchenko, etc. Las reacciones con formaldehído pueden provocar complicaciones adicionales, como una reducción del aldol por una Podría producirse una reacción de Cannizzaro cruzada.
G. Wittig descubrió una versión modificada de la clásica reacción aldólica que implica el tratamiento de compuestos carbonílicos con iminas metaladas. En este caso se forman predominantemente aldehídos α,β-insaturados, y este método ha demostrado su utilidad, especialmente en el campo de los productos naturales.
3.2. Procesos varios
La adición de agua a aldehídos α,β-insaturados da como resultado la formación de β-hidroxialdehídos. Esta reacción es de importancia industrial y se utiliza para la síntesis de 1,3-propanodiol.
Por ejemplo, el 3-hidroxipropanal también se puede obtener mediante la hidroformilación de óxido de etileno, mientras que el 4-hidroxibutanal se obtiene mediante la hidroformilación de alcohol alílico. Se ha revisado exhaustivamente la hidroformilación de alcoholes insaturados para producir hidroxialdehídos.
Además, cuando se hidroliza el 2,3-dihidro-1,4-pirano, se produce 5-hidroxipentanal, que existe en equilibrio con su forma hemiacetal cíclica. Por ejemplo, el 2-fenil-2,3-dihidropirano, producido a partir de acroleína y estireno mediante una síntesis de Diels-Alder, se puede escindir usando ácido sulfúrico diluido para producir 5-fenil-5-hidroxipentanal.
4. Producción de dialdehídos
En la literatura de patentes están documentadas numerosas síntesis de dialdehídos, pero sólo un número limitado de ellas tienen importancia comercial, en gran parte debido a su falta de selectividad. Los procesos clave utilizados para la producción de dialdehídos alifáticos y cicloalifáticos saturados son los siguientes:
- Oxidación del etilenglicol
- Oxidación del acetaldehído
- Hidroformilación de dienos
- Apertura del anillo oxidativo de los cicloalquenos
- Adición de metil vinil éter a acroleína (lo que da como resultado glutardialdehído)
4.1. Hidroformilación de dienos
La hidroformilación de dienos conduce a diversos productos, influenciados tanto por la estructura del dieno como por el catalizador empleado. Cuando se trata de dienos conjugados como el 1,3-butadieno utilizando catalizadores de cobalto o rodio no modificados, se producen monoaldehídos o monoalcoholes saturados.
Inicialmente, la única adición de CO/H2 genera el monoaldehído insaturado. Posteriormente, la hidroformilación del aldehído insaturado compite con la hidrogenación y la isomerización del doble enlace.
Por otro lado, los dienos no conjugados típicamente se isomerizan a aldehídos α,β-insaturados termodinámicamente más estables después de la única adición de CO/H2. Por consiguiente, los dienos no conjugados con enlaces dobles ampliamente separados (> C6), preferiblemente terminales, son particularmente útiles para la síntesis de dialdehídos mediante hidroformilación.
4.2. Apertura del anillo oxidativo de cicloalquenos
Los cicloalquenos, cuando se exponen a catalizadores como el ácido tungstico, sufren una reacción con peróxido de hidrógeno, lo que lleva a la formación de los epóxidos correspondientes y da como resultado α,ω-dialdehídos lineales.
Cuando dos aldehídos diferentes con átomos de α-hidrógeno se someten a una adición aldólica, las cuatro especies aldólicas posibles generalmente se forman en cantidades variables.
Para fines industriales, las reacciones en las que sólo un reactivo posee átomos de hidrógeno α son más importantes. En tales casos, el segundo reactivo suele ser formaldehído. Las reacciones para preparar mono o polimetilolalcanales a partir de formaldehído y alcanales son comunes en los procesos industriales.
Estas reacciones exotérmicas normalmente se llevan a cabo en fase líquida y con frecuencia se emplean catalizadores como soluciones acuosas de hidróxido de sodio o carbonatos alcalinos.
También se han descrito varios otros sistemas catalíticos, incluidas zeolitas que contienen zinc o magnesio, hidróxidos alcalinos combinados con catalizadores de transferencia de fases, aminas terciarias y resinas básicas de intercambio iónico.
Los subproductos típicos de la condensación aldólica, además de los aldoles diméricos, aldoxanos y aldehídos α,β-insaturados mencionados anteriormente, incluyen acetales cíclicos, ésteres de Tishchenko, etc. Las reacciones con formaldehído pueden provocar complicaciones adicionales, como una reducción del aldol por una Podría producirse una reacción de Cannizzaro cruzada.
G. Wittig descubrió una versión modificada de la clásica reacción aldólica que implica el tratamiento de compuestos carbonílicos con iminas metaladas. En este caso se forman predominantemente aldehídos α,β-insaturados, y este método ha demostrado su utilidad, especialmente en el campo de los productos naturales.
3.2. Procesos varios
La adición de agua a aldehídos α,β-insaturados da como resultado la formación de β-hidroxialdehídos. Esta reacción es de importancia industrial y se utiliza para la síntesis de 1,3-propanodiol.
Por ejemplo, el 3-hidroxipropanal también se puede obtener mediante la hidroformilación de óxido de etileno, mientras que el 4-hidroxibutanal se obtiene mediante la hidroformilación de alcohol alílico. Se ha revisado exhaustivamente la hidroformilación de alcoholes insaturados para producir hidroxialdehídos.
Además, cuando se hidroliza el 2,3-dihidro-1,4-pirano, se produce 5-hidroxipentanal, que existe en equilibrio con su forma hemiacetal cíclica. Por ejemplo, el 2-fenil-2,3-dihidropirano, producido a partir de acroleína y estireno mediante una síntesis de Diels-Alder, se puede escindir usando ácido sulfúrico diluido para producir 5-fenil-5-hidroxipentanal.
4. Producción de dialdehídos
En la literatura de patentes están documentadas numerosas síntesis de dialdehídos, pero sólo un número limitado de ellas tienen importancia comercial, en gran parte debido a su falta de selectividad. Los procesos clave utilizados para la producción de dialdehídos alifáticos y cicloalifáticos saturados son los siguientes:
- Oxidación del etilenglicol
- Oxidación del acetaldehído
- Hidroformilación de dienos
- Apertura del anillo oxidativo de los cicloalquenos
- Adición de metil vinil éter a acroleína (lo que da como resultado glutardialdehído)
4.1. Hidroformilación de dienos
La hidroformilación de dienos conduce a diversos productos, influenciados tanto por la estructura del dieno como por el catalizador empleado. Cuando se trata de dienos conjugados como el 1,3-butadieno utilizando catalizadores de cobalto o rodio no modificados, se producen monoaldehídos o monoalcoholes saturados.
Inicialmente, la única adición de CO/H2 genera el monoaldehído insaturado. Posteriormente, la hidroformilación del aldehído insaturado compite con la hidrogenación y la isomerización del doble enlace.
Por otro lado, los dienos no conjugados típicamente se isomerizan a aldehídos α,β-insaturados termodinámicamente más estables después de la única adición de CO/H2. Por consiguiente, los dienos no conjugados con enlaces dobles ampliamente separados (> C6), preferiblemente terminales, son particularmente útiles para la síntesis de dialdehídos mediante hidroformilación.
4.2. Apertura del anillo oxidativo de cicloalquenos
Los cicloalquenos, cuando se exponen a catalizadores como el ácido tungstico, sufren una reacción con peróxido de hidrógeno, lo que lleva a la formación de los epóxidos correspondientes y da como resultado α,ω-dialdehídos lineales.

En determinados casos, la adición de compuestos de boro facilita la reacción.
4.3. Procesos varios
De manera similar al proceso de formación de monoaldehídos mediante deshidrogenación, la deshidrogenación de dioles da como resultado la producción de dialdehídos.
También existen otras vías, incluida la ozonización de cicloalquenos y la dimerización de aldehídos insaturados. Además, la hidroformilación de acetales insaturados conduce a los correspondientes dialdehídos.
5. Producción de Acetales
El método principal empleado para la preparación de acetales es la reacción de un aldehído con un alcohol. Normalmente, se forma un hemiacetal inestable como producto intermedio debido a la naturaleza de equilibrio de la reacción.
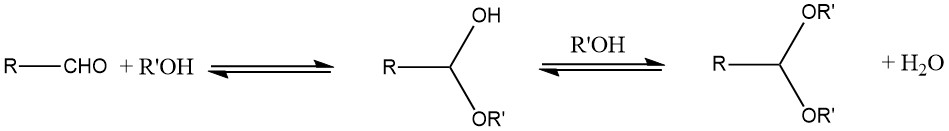
Para mejorar el rendimiento, el agua producida durante la reacción debe eliminarse mediante destilación azeotrópica o agentes adsorbentes de agua, como tamices moleculares. En general, los acetales cíclicos tienden a ofrecer mejores rendimientos que los acetales de cadena abierta.
El ácido sulfúrico anhidro o el ácido p-toluenosulfónico sirven como catalizadores comunes, aunque también se pueden usar otras opciones como ácidos inorgánicos, ácido oxálico o adípico, resinas de intercambio iónico o tamices moleculares.
Durante la acetalización de aldehídos alifáticos saturados que contienen un átomo de α-hidrógeno, puede producirse la formación de éteres de 1-alquenilo si la temperatura de reacción es demasiado alta.
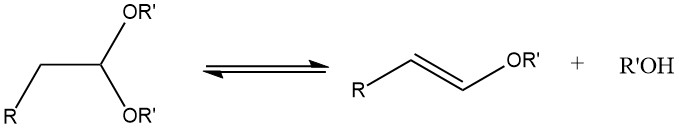
Se pueden sintetizar acetales con buenos rendimientos a partir de la mayoría de los aldehídos tratándolos con ortoformiatos, principalmente ésteres metílicos y etílicos, utilizando ácidos fuertes como catalizadores, según el proceso desarrollado por L. Claisen.
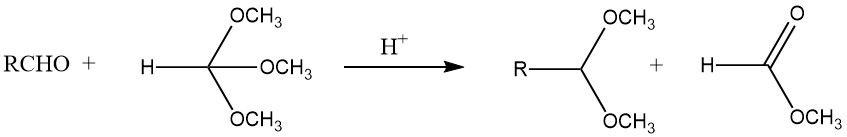
Además, los acetales se pueden obtener mediante la reacción de acetileno con alcoholes, la adición de alcohol a éteres vinílicos y el tratamiento de dihaluros geminales con alcóxidos. Los aldehídos y los oxiranos producen 1,3-dioxolanos, mientras que los pirocatecoles y el diclorometano forman 1,3-benzodioxoles.
La reacción catalizada por ácido de olefinas con formaldehído da como resultado la formación de 1,3-dioxanos (reacción de Prins), que se lleva a cabo a 55-75°C con un exceso de formaldehído.
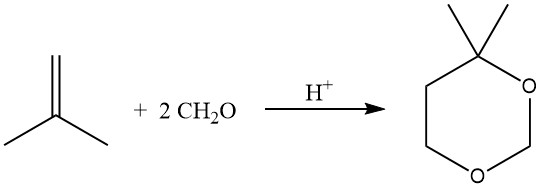
En condiciones de hidroformilación, la reacción de olefinas con alcoholes, a menudo utilizando catalizadores de transferencia de fases, también puede producir acetales.
El acetaldehído dimetil acetal se obtiene a 200 °C a partir de metanol y gas de síntesis en presencia de catalizador, con aproximadamente un 60 % de conversión de metanol y una selectividad de 80 a 85 %. Los principales subproductos incluyen acetaldehído y acetato de etilo.
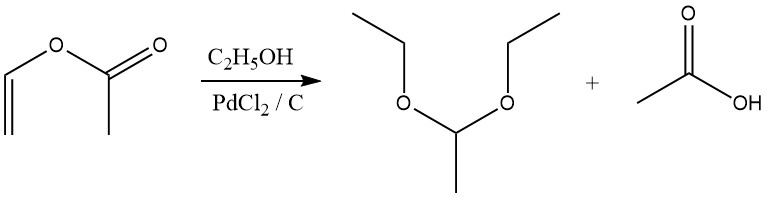
Los acetales también se forman mediante la reacción de ésteres vinílicos con alcoholes en presencia de un catalizador de cloruro de paladio.
Referencias
- Aldehydes, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_321.pub3
- Production of aliphatic aldehydes. – https://patents.google.com/patent/US2623905A/en
