Etilbenceno: propiedades, producción, usos y toxicología
¿Qué es el etilbenceno?
El etilbenceno, también conocido como feniletano, es un hidrocarburo alquilaromático de un solo anillo con la fórmula C8H10. Es un líquido incoloro, altamente inflamable, con un olor aromático característico.
Se utiliza principalmente (>99%) como intermediario en la producción de monómero de estireno, uno de los productos químicos básicos de mayor volumen a nivel mundial.
La producción a escala comercial de etilbenceno comenzó en la década de 1930 por Dow Chemical (EE. UU.) y BASF (Alemania). La industria del etilbenceno/estireno siguió siendo relativamente poco importante hasta la Segunda Guerra Mundial.
El aumento de la demanda de caucho sintético de estireno-butadieno (SBR) durante los años de guerra aceleró los rápidos avances tecnológicos y la expansión significativa de la capacidad. Este esfuerzo en tiempos de guerra condujo a la construcción de numerosas fábricas a gran escala, y la producción de estireno evolucionó rápidamente hasta convertirse en una industria importante.
En 1999, la capacidad de producción anual mundial de etilbenceno había alcanzado casi 25 millones de toneladas. Cabe destacar que en el decenio de 1990 se produjo el mayor crecimiento de la capacidad en los países del Lejano Oriente (excluido Japón), donde las industrias petroquímicas fundamentales experimentaron un desarrollo y una expansión sustanciales.
Tabla de contenido
1. Propiedades físicas del etilbenceno
En condiciones normales, el etilbenceno es un líquido incoloro con olor aromático. Es insoluble en agua, pero soluble en todas las proporciones en etanol y éter etílico. El etilbenceno es irritante para la piel y los ojos y es moderadamente tóxico por ingestión, inhalación y adsorción cutánea.
En la siguiente tabla se enumeran algunas propiedades físicas del etilbenceno.
| Propiedad | Valor |
|---|---|
| Número CAS | [100-41-4] |
| Fórmula química | C6H5CH2CH3 |
| Masa molecular | 106,168 g/mol |
| Densidad |
|
| Punto de fusión | -94,949 °C |
| Punto de ebullición (101,3 kPa) | 136,2 °C |
| Índice de refracción |
|
| Densidad de vapor | 3,66 |
| Presión crítica | 3609 kPa (36,09 bar) |
| Temperatura crítica | 344,02 °C |
| Punto de inflamación (vaso cerrado) | 15 °C |
| Temperatura de autoignición | 460 °C |
| Límite de inflamabilidad |
|
| Calor latente |
|
| Poder calorífico |
|
| Viscosidad cinemática |
|
| Tensión superficial | 28,48 mN/m |
| Capacidad calorífica específica |
|
| Factor acéntrico | 0,3026 |
| Compresibilidad crítica | 0,263 |
2. Reacciones químicas del etilbenceno
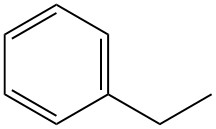
La reacción comercial más importante del etilbenceno es su deshidrogenación a estireno. Esta reacción se produce a altas temperaturas (600–660 °C) y normalmente utiliza un catalizador de óxido de hierro promovido por potasio con vapor como diluyente.
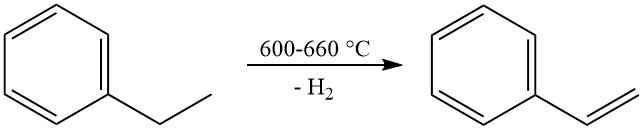
La producción industrial alcanza selectividades de estireno que van del 90 al 97% en moles con conversiones por paso del 60 al 70%. La reacción secundaria principal es la desalquilación del etilbenceno a benceno y tolueno.
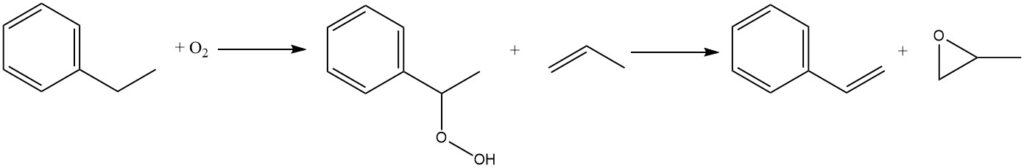
Otra reacción que está adquiriendo importancia comercial es la oxidación del etilbenceno al aire para formar hidroperóxido de etilbenceno. Es un proceso no catalizado que ocurre en la fase líquida. Sin embargo, debido a la inestabilidad inherente de los hidroperóxidos, la exposición a altas temperaturas debe minimizarse para reducir la tasa de descomposición.
El hidroperóxido se trata posteriormente con propileno para coproducir estireno y óxido de propileno. En 1999, aproximadamente el 15% de la producción mundial de etilbenceno se destinó a la coproducción de monómero de estireno y óxido de propileno a través de esta ruta.
De manera similar al tolueno, el etilbenceno puede desalquilarse para convertirse en benceno mediante procesos catalíticos o térmicos. Además, el etilbenceno sufre otras reacciones características de los compuestos alquilaromáticos, como la alquilación, la acilación, la nitración y la sulfonación.
3. Producción industrial de etilbenceno
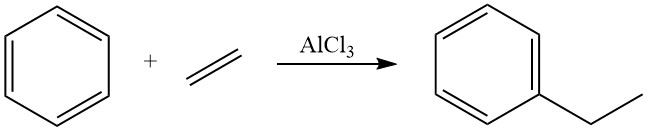
Históricamente, durante varias décadas, el método dominante para la producción de etilbenceno fue la alquilación de Friedel-Crafts de benceno con etileno utilizando ácidos de Lewis disueltos, principalmente cloruro de aluminio, como catalizadores en la fase líquida. Este método sigue utilizándose para aproximadamente el 40% de la producción mundial de etilbenceno.
Si bien el método del cloruro de aluminio puede ser económicamente competitivo, este proceso genera corrientes de desechos cuya eliminación es cada vez más costosa debido a las regulaciones ambientales. Además, el cloruro de aluminio es altamente corrosivo, lo que genera importantes necesidades de mantenimiento para los equipos y las tuberías.
Desde principios de la década de 1980, los catalizadores de zeolita heterogéneos se han convertido en la tecnología preferida para las nuevas plantas de producción de etilbenceno. La tecnología de zeolita inicial operaba en la fase de vapor, lo que proporcionaba una mejor eficiencia del proceso en comparación con el cloruro de aluminio en fase líquida.
Más recientemente, se han desarrollado procesos de zeolita en fase líquida, que ofrecen una flexibilidad adicional. Esta tecnología genera menos desechos peligrosos en comparación con la ruta del cloruro de aluminio.
Las crecientes preocupaciones ambientales y los avances en la tecnología de zeolita han incentivado a muchos productores que utilizan unidades de cloruro de aluminio a modernizar sus plantas con tecnología de zeolita. Entre 1997 y 1999, aproximadamente 106 toneladas de capacidad se convirtieron de procesos de cloruro de aluminio a procesos de zeolita.
En el año 2000, se estaban realizando más conversiones en la fase de ingeniería y la construcción de nuevas plantas que utilizan tecnología de cloruro de aluminio prácticamente ha cesado en la última década.
Unas pocas plantas producen una cantidad menor de etilbenceno mediante superfraccionamiento de corrientes aromáticas C8 mixtas.
3.1. Producción de etilbenceno mediante catálisis de cloruro de aluminio y otros ácidos de Lewis
Durante varias décadas, los procesos de cloruro de aluminio en fase líquida dominaron la producción de etilbenceno. Varias empresas, incluidas Dow, BASF, Shell y Monsanto, desarrollaron variaciones de esta tecnología. Hoy en día, aproximadamente el 40% de la producción mundial de etilbenceno todavía utiliza AlCl3.
La alquilación de benceno con etileno es altamente exotérmica y libera una cantidad significativa de calor (ΔH = -114 kJ/mol). El uso de cloruro de aluminio como catalizador en esta reacción promueve una reacción rápida con rendimientos casi estequiométricos de etilbenceno.
También se pueden emplear otros ácidos de Lewis como AlBr3, FeCl3, ZrCl4 y BF3. Los procesos que utilizan AlCl3 a menudo incorporan promotores como cloruro de etilo o cloruro de hidrógeno. Estos promotores reducen la cantidad de AlCl3 necesaria para la reacción.
El proceso convencional de AlCl3 (Figura 1) utiliza tres fases en el reactor: líquido aromático (benceno), gas etileno y una fase compleja de catalizador de aceite rojo. La reacción ocurre cerca del equilibrio termodinámico, lo que requiere un solo reactor tanto para la alquilación como para la transalquilación.
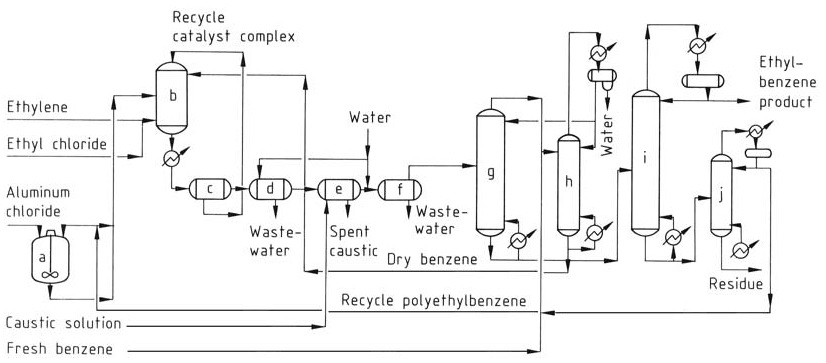
a) Tanque de mezcla de catalizador; b) Reactor de alquilación; c) Tanque de sedimentación; d) Separador de ácido; e) Separador de cáustico; f) Separador de agua; g) Columna de recuperación de benceno; h) Columna deshidratadora de benceno; i) Columna de recuperación de etilbenceno; j) Columna de polietilbenceno
La mezcla compleja de catalizador, benceno seco y polialquilbencenos reciclados se introducen continuamente en el reactor. Se inyectan etileno y un promotor de catalizador (por ejemplo, cloruro de etilo) en la mezcla de reacción.
Las temperaturas de funcionamiento se limitan a 130 °C para evitar la desactivación del catalizador y la formación de subproductos, y se mantiene una presión suficiente para mantener los reactivos en la fase líquida.
El proceso mejorado de Monsanto (Figura 2) ofrece ventajas sobre los procesos convencionales de AlCl3 y se ha implementado en muchas plantas más antiguas.
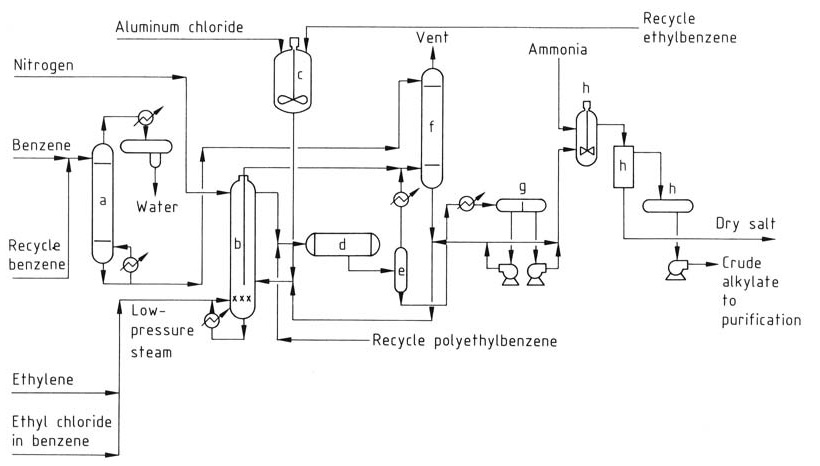
a) Columna de secado de benceno; b) Reactor de alquilación; c) Tanque de preparación del catalizador; d) Transalquilador; e) Tambor de evaporación instantánea; f) Sistema de depuración de gases de ventilación; g) Decantador; h) Sistema de neutralización
Este proceso funciona a temperaturas más altas (160–180 °C) y utiliza una fase líquida homogénea. La temperatura más alta permite la recuperación del calor residual en forma de vapor. Sin embargo, se requiere un reactor de transalquilación independiente debido a la menor concentración de catalizador.
Al optimizar la temperatura y la adición de etileno, el proceso reduce significativamente la cantidad de catalizador de AlCl3 necesario, lo que minimiza los problemas de eliminación de desechos y, dado que funciona en una única fase líquida homogénea, elimina la fase compleja del catalizador presente en los métodos tradicionales.
Tanto los procesos convencionales como los de Monsanto emplean pasos de purificación similares que implican múltiples columnas de destilación para separar las fracciones de benceno, etilbenceno y polialquilbenceno no convertidos. El residuo orgánico (aceite fundente) se utiliza normalmente como combustible.
El proceso Alkar, desarrollado por UOP, utilizó trifluoruro de boro como catalizador de ácido de Lewis. Si bien ofrece ventajas como un producto de etilbenceno de alta pureza y la posibilidad de utilizar etileno diluido como materia prima, el proceso no es favorable debido a los altos costos de mantenimiento y la sensibilidad del catalizador incluso a pequeñas cantidades de agua.
3.2. Producción de etilbenceno mediante alquilación en fase de vapor sobre zeolitas
La tecnología de fase de vapor de Mobil-Badger, que aprovecha el catalizador de zeolita sintética ZSM-5 de Mobil, surgió en la década de 1970. Esta tecnología se ha ofrecido en varias configuraciones.
El diseño de primera generación, comercializado en 1980, realizaba la alquilación y la transalquilación en un solo reactor, de manera similar a los procesos de cloruro de aluminio. La última tecnología de tercera generación separa estos procesos, lo que ofrece ventajas en rendimiento, pureza y costo de capital.
El proceso de zeolita en fase de vapor es particularmente adecuado para corrientes de etileno diluidas, como las derivadas de las unidades de craqueo catalítico de fluidos en las refinerías.
Hasta la introducción de las tecnologías de zeolita en fase líquida en la década de 1990, este proceso dominaba las nuevas instalaciones de plantas debido a su capacidad para evitar las corrientes de desechos acuosos generados por la tecnología de cloruro de aluminio.
Mobil-Badger ha obtenido licencias para 31 unidades desde 1980 y la tecnología sigue siendo relevante para materias primas de etileno diluido.
El catalizador de lecho fijo ZSM-5 promueve la misma reacción de alquilación que otros procesos. Sin embargo, la adsorción de etileno en los sitios ácidos de Brønsted de la zeolita activa la molécula de etileno, lo que facilita su unión con el benceno. Este mecanismo genera un subproducto diferente en comparación con los procesos de Friedel-Crafts.
El acero al carbono es el material de construcción principal debido a la ausencia de componentes altamente corrosivos. El diseño de tercera generación se muestra en la Figura 3.
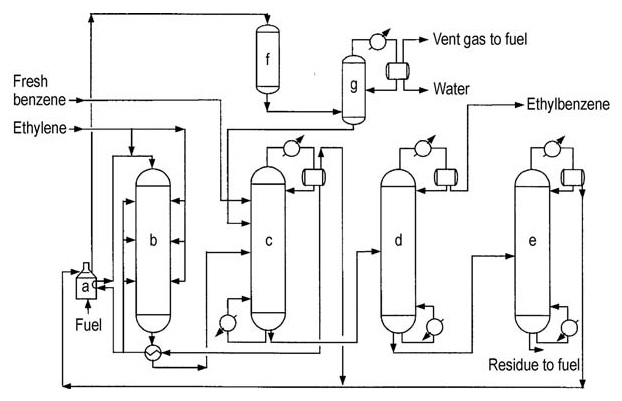
a) Calentador de alimentación del reactor; b) Reactor de alquilación; c) Columna de recuperación de benceno; d) Columna de recuperación de etilbenceno; e) Columna de recuperación de polietilenobenceno; f) Reactor secundario; g) Estabilizador
El reactor de alquilación opera a 350–450 °C y 1–3 MPa, lo que permite recuperar la mayor parte del calor del proceso en forma de vapor. El reactor utiliza una configuración de lechos múltiples con un calentador encendido y equipo de recuperación de calor.
El exceso de benceno se mantiene en relación con el etileno. El catalizador se desactiva gradualmente debido a la formación de coque, lo que requiere una regeneración periódica in situ (aproximadamente cada 18–24 meses), que demora alrededor de 36 horas.
En comparación con las zeolitas en fase líquida y los catalizadores de ácido de Lewis, esta tecnología muestra una mayor tolerancia al agua, el azufre y otros venenos potenciales.
El efluente vaporizado del reactor se somete a purificación. El benceno se recupera mediante destilación en la primera columna y se recicla. La segunda columna separa el etilbenceno de la corriente inferior, que luego se dirige a una columna final para la separación de las fracciones reciclables de alquilbenceno y polialquilbenceno del residuo pesado no reciclable.
Este residuo de baja viscosidad, compuesto principalmente de difenilmetano y difeniletano, se utiliza como combustible. Los alquilbencenos superiores y polialquilbencenos reciclables separados se introducen en el transalquilador en fase de vapor, donde reaccionan con el exceso de benceno sobre un catalizador de zeolita.
El transalquilador funciona a menor presión pero a mayor temperatura en comparación con el alquilador, lo que promueve la desalquilación de los alquilbencenos superiores mientras se transalquila dietilbenceno a etilbenceno. Esta capacidad de desalquilación minimiza la producción total de residuos.
Los procesos anteriores de primera y segunda generación diferían principalmente en la ubicación de la corriente de polietilbenceno reciclado, lo que condujo a un menor rendimiento en comparación con el diseño de tercera generación.
3.3. Producción de etilbenceno mediante alquilación en fase líquida sobre zeolitas
La tecnología de zeolita en fase líquida para la producción de etilbenceno surgió a principios de la década de 1990. La primera planta comercial, que operaba en Oita, Japón, utilizaba catalizadores ultraestables de zeolita Y o zeolita beta, autorizados por ABB Lummus Global y Unocal (posteriormente adquirida por ABB).
Otro proceso, EBMax de Mobil-Badger, empleaba el catalizador Mobil MCM-22. En 1999, doce plantas estaban operativas en todo el mundo.
En comparación con las tecnologías anteriores que utilizaban etileno de grado polimérico, los procesos de zeolita en fase líquida requieren menos inversión y ofrecen un producto de etilbenceno de mayor calidad.
La tecnología en fase de vapor ahora está autorizada principalmente por Mobil-Badger para aplicaciones que involucran materias primas de etileno diluido.
Los procesos en fase líquida requieren zeolitas de poro más ancho, en comparación con ZSM-5 utilizada en procesos en fase de vapor, para superar las limitaciones de difusión. La regeneración del catalizador fuera del sitio generalmente se recomienda debido a los tiempos de ciclo del catalizador más prolongados, lo que reduce las necesidades de equipo en el sitio y los costos de inversión.
Ambos licenciantes principales (ABB Lummus y Mobil-Badger) ofrecen diagramas de flujo de procesos similares (Figuras 4 y 5).
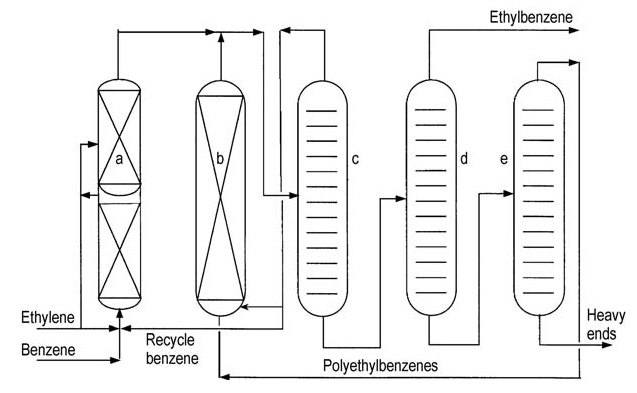
a) Reactor de alquilación; b) Reactor de transalquilación; c) Columna de benceno; d) Columna de etilbenceno; e) Columna de polietilbenceno
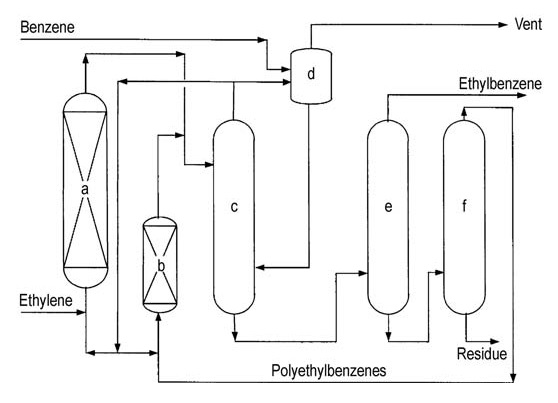
a) Reactor de alquilación; b) Reactor de transalquilación; c) Columna de benceno; d) Columna de gas de ventilación; e) Columna de etilbenceno; f) Columna de polietilbenceno
El etileno se introduce en un reactor de lecho fijo de varias etapas que contiene un exceso de benceno. Las temperaturas del reactor se mantienen por debajo de la temperatura crítica del benceno (289 °C). Se necesitan presiones altas de alrededor de 4 MPa para mantener los gases ligeros en solución.
El exceso de benceno se separa del efluente del reactor y se recicla de nuevo a la etapa de alquilación.
Una serie de columnas de destilación purifican el etilbenceno crudo. La destilación del benceno elimina el exceso de benceno para reciclarlo. La destilación del etilbenceno separa el producto deseado y la destilación del polietilbenceno recupera los alquilbencenos superiores y los polietilbencenos del residuo.
Los alquilbencenos superiores y los polietilbencenos recuperados se introducen en un reactor de transalquilación para su posterior conversión. Las principales impurezas del etilbenceno final pueden incluir compuestos no aromáticos, tolueno y alquilbencenos superiores, que se originan en los procesos de alimentación o de producción.
3.4. Producción de etilbenceno mediante un proceso de fase mixta basado en zeolitas
CDTech, una colaboración entre ABB Lummus Global y Chemical Research and Licensing, ofreció un proceso de producción de etilbenceno basado en zeolitas en fase mixta. La primera planta comercial comenzó a funcionar en 1994 y, en 1999, ya había tres plantas de este tipo en funcionamiento.
La característica innovadora de este proceso es el reactor de alquilación, que incorpora un catalizador de zeolita en una columna de destilación reactiva.
Tanto el etileno (gas) como el benceno (líquido) se introducen en la columna de destilación reactiva. Esta capacidad permite que el proceso utilice corrientes de etileno diluidas producidas durante la destilación del craqueador a vapor. Este proceso también se puede adaptar para la materia prima de etileno de grado polimérico.
El flujo del proceso se muestra en la Figura 6.
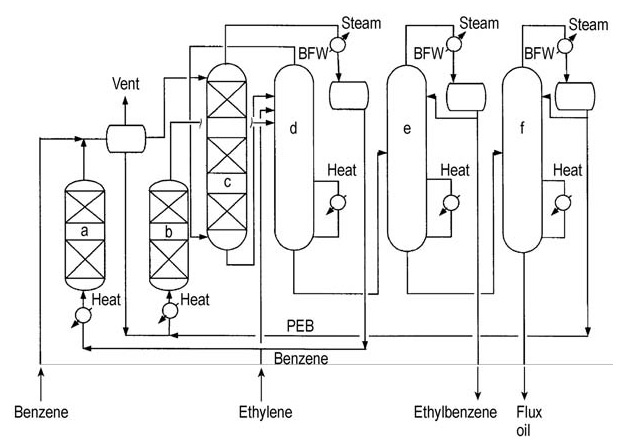
a) Reactor de acabado; b) Transalquilador; c) Alquilador; d) Depurador de benceno; e) Columna de etilbenceno; f) Columna de polietilbenceno. BFW = agua de alimentación de caldera, PEB = polietilbenceno
La alquilación y la extracción de benceno se producen simultáneamente en la misma columna de destilación reactiva. El etileno no convertido y el exceso de benceno se extraen como productos de cabeza y se dirigen a un reactor de acabado para su posterior procesamiento.
El producto de etilbenceno se separa de la corriente inferior en la columna de producto de cabeza. El residuo restante se procesa aún más para recuperar polietilbencenos transalquilables.
Los polietilbencenos aislados se envían a un reactor de transalquilación en fase líquida separado junto con el exceso de benceno. El producto de esta etapa de transalquilación se devuelve al tren de fraccionamiento para su posterior purificación.
3.5. Separación de etilbenceno de corrientes C8 mixtas
Menos del 1% de la producción mundial de etilbenceno se origina a partir de la separación de corrientes aromáticas C8 mixtas, que normalmente ocurre junto con la producción de xileno a partir del reformado. Si bien existen procesos de adsorción como el EBEX de UOP, la destilación sigue siendo el método principal para la recuperación de etilbenceno de esta fuente.
La dificultad de separar el etilbenceno de estas corrientes hace necesario un proceso conocido como superfraccionamiento. Iniciado por Cosden Oil & Chemical Company en 1957, implica una serie de tres columnas de destilación, cada una con más de 100 etapas.
En la década de 1960 se construyeron varias unidades de superfraccionamiento en Estados Unidos, Europa y Japón. Sin embargo, el aumento de los costos de la energía y los altos costos de construcción han hecho que este método sea económicamente poco competitivo. Como resultado, el superfraccionamiento se ha abandonado en gran medida en favor de métodos más eficientes.
4. Usos del etilbenceno
Casi todo el etilbenceno producido comercialmente se utiliza internamente en refinerías o plantas químicas para la producción de monómero de estireno, que es un componente fundamental para la producción de poliestireno. En algunos casos, el etilbenceno se coproduce con óxido de propileno.
Menos del 1% del etilbenceno se emplea como disolvente de pinturas o como intermediario para la síntesis de dietilbenceno, acetofenona y etilantraquinona.
5. Toxicología del etilbenceno
El etilbenceno se absorbe fácilmente tras la inhalación, la exposición oral y dérmica. Sufre un metabolismo primario a través de la oxidación de la cadena lateral, con metabolitos menores de la hidroxilación del anillo aromático. Menos del 5% se excreta sin cambios en la orina como 2- y 4-etilfenol.
Los principales metabolitos identificados son:
- 1-feniletanol (metabolito urinario principal en ratas)
- Ácido mandélico (metabolito urinario principal en humanos)
- Ácido fenilglioxílico (metabolito urinario principal en humanos)
- Ácido benzoico
- Ácido fenilacético (metabolito menor)
Los estudios experimentales indican una baja toxicidad aguda en animales. Los valores de LD50 oral en ratas varían de 3,5 a 4,7 g/kg de peso corporal. Se ha informado un valor de LD50 dérmico de aproximadamente 15 g/kg de peso corporal.
La exposición por inhalación en ratas provocó irritación del tracto respiratorio a partir de 1000 ppm. Concentraciones más altas causaron inestabilidad, marcha tambaleante y, en última instancia, pérdida de conocimiento y muerte a 5000 ppm. Los voluntarios humanos expuestos a 25 ppm durante 7,5 horas informaron una leve irritación de las membranas mucosas, que se volvió más pronunciada a 100 ppm.
El contacto dérmico repetido con etilbenceno sin diluir puede provocar eritema, edema y necrosis superficial. Se prevén efectos similares en humanos debido a la pérdida de grasa de la piel con exposiciones repetidas.
Los estudios que examinaron la exposición a dosis repetidas revelaron que los efectos adversos significativos en animales solo ocurrieron con dosis relativamente altas de etilbenceno.
No se observaron efectos en ratas a 100 ppm ni en ratones a 500 ppm durante un estudio de inhalación de tres meses; sin embargo, se observó un aumento del peso de los pulmones, los riñones y el hígado a partir de 250 ppm en ratas y 750 ppm en ratones. No se observaron cambios histopatológicos.
Estudios de inhalación de dos años no mostraron efectos en ratas y ratones a 75 ppm. Se observaron cambios leves a 250 ppm, con un aumento de tumores hepáticos y pulmonares en ratones y tumores renales en ratas macho a 750 ppm (considerados específicos de ratas y no relevantes para humanos).
En cuanto a la toxicidad reproductiva del etilbenceno, se han reportado resultados contradictorios en varios estudios. Algunos estudios sugieren una posible fetotoxicidad a niveles altos de exposición en ratones y ratas preñadas, pero no se observaron efectos claros en conejos a 1000 ppm con una exposición diaria de 7 horas.
El resultado general de diferentes estudios sugiere que el etilbenceno no es un peligro mutagénico. Los datos in vitro limitados disponibles para la mayoría de los metabolitos también sugieren que no hay un potencial genotóxico claro.
Un estudio de inhalación de dos años mostró un aumento de la incidencia de tumores en ratas macho (riñón), ratones macho (pulmón) y ratones hembra (hígado) al nivel de exposición más alto (750 ppm). No se observaron tumores relacionados con la exposición en un estudio oral con ratas y ratones expuestos a mezclas de xileno que contenían un 17 % de etilbenceno.
El etilbenceno no es genotóxico in vivo, lo que sugiere un modo de acción no genotóxico para los tumores observados en el estudio de inhalación de dosis altas. El aumento de la formación de tumores puede estar relacionado con la proliferación celular inducida por el etilbenceno en el riñón (ratas) y en los pulmones/hígado (ratones).
Se necesita más investigación para determinar su relevancia para los seres humanos y establecer un límite de exposición ocupacional seguro.
El IARC clasifica al etilbenceno como «posiblemente cancerígeno para los seres humanos» (Grupo 2B) debido a la evidencia suficiente en animales y la evidencia inadecuada en seres humanos.
La Comisión MAK alemana clasifica al etilbenceno como un carcinógeno de categoría 3A debido a los datos de carcinogenicidad. Están esperando más datos mecanísticos antes de establecer un límite de exposición ocupacional.
La ACGIH clasifica el etilbenceno como un carcinógeno A3 («carcinógeno animal confirmado con relevancia desconocida para los humanos») y recomienda un TLV-TWA de 100 ppm y un TLV-STEL de 125 ppm. También define un índice de exposición biológica (BEI) para el ácido mandélico en orina de 1,5 g/g de creatinina.
En la UE, el etilbenceno está clasificado como «altamente inflamable» (F) y «dañino por inhalación» (Xn).
Referencia
- Etilbenceno; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a10_035.pub2
