Dióxido de Cloro: Propiedades, Producción y Usos
El dióxido de cloro es un compuesto químico inorgánico con la fórmula ClO2. Se presenta como un gas de color verde amarillento a temperatura ambiente, un líquido de color marrón rojizo entre 11 °C y −59 °C y como cristales de color naranja brillante por debajo de −59 °C. Se maneja habitualmente como una solución acuosa y se produce en el sitio para aplicaciones industriales.
El dióxido de cloro se utiliza principalmente en el blanqueo de la pasta de madera química. Históricamente, el cloro elemental era el agente blanqueador dominante. Sin embargo, debido a las importantes preocupaciones ambientales asociadas a su uso, el dióxido de cloro se ha convertido en la alternativa preferida desde finales de la década de 1980.
Tabla de contenido
1. Propiedades del dióxido de cloro
El dióxido de cloro (ClO2) es un compuesto de cloro-oxígeno con un átomo de cloro que tiene una valencia de cuatro. Posee un peso molecular de 67,45 g/mol, un punto de fusión de -59 °C y un punto de ebullición de 11 °C.
Esta propiedad convierte al dióxido de cloro en un gas a temperatura ambiente. Este gas tiene un olor distintivo, similar al cloro pero con un carácter acre. Se detecta fácilmente en bajas concentraciones. Sin embargo, la inhalación en concentraciones moderadas puede ser peligrosa y provocar daños respiratorios.
Debido a preocupaciones económicas y de seguridad, el dióxido de cloro disponible comercialmente no existe en forma gaseosa, líquida o sólida pura. Para pequeñas cantidades, se encuentran disponibles formas estabilizadas.
El dióxido de cloro se disuelve fácilmente en agua y muestra un color que va del amarillo pálido al amarillo verdoso oscuro según la concentración (tanto en fase gaseosa como en solución). Es altamente soluble en agua pura, alcanzando aproximadamente 60 g/L. La solubilidad es inversamente proporcional a la temperatura; disminuye a medida que aumenta la temperatura. El proceso de disolución no implica hidrólisis ni dimerización.
El dióxido de cloro tiene un máximo de absorción a 360 nm. Si bien no es particularmente distintivo, este pico se puede usar para medir la concentración de dióxido de cloro en soluciones gaseosas, acuosas e incluso orgánicas.
La molécula de dióxido de cloro es inherentemente inestable desde una perspectiva termodinámica. Las limitaciones cinéticas permiten la manipulación en fase gaseosa, pero existen limitaciones estrictas. La presión de vapor no debe exceder los 10–12 kPa para evitar una rápida descomposición con riesgos potencialmente explosivos.
El dióxido de cloro es relativamente estable cuando se absorbe en soluciones acuosas (debido al calor de la solución), especialmente en condiciones frías y oscuras. Sin embargo, la presión de vapor sobre tales soluciones requiere limitaciones de concentración (alrededor del 1% en peso) para evitar una acumulación peligrosa de presión de vapor. Además, puede producirse la formación de ClO2·8 H2O cristalino.
El dióxido de cloro también se puede disolver en otros disolventes.
Los dos enlaces cloro-oxígeno poseen un carácter de doble enlace con un ángulo de enlace de 117,5°. Con 19 electrones de valencia, incluido un electrón desapareado, el dióxido de cloro tiene un comportamiento similar al de un radical, lo que permite diversas vías de reacción.
Al igual que todos los óxidos de cloro, presenta un alto riesgo de explosión en caso de choque térmico o físico. Debe evitarse estrictamente la compresión de la fase gaseosa.
El dióxido de cloro actúa como un fuerte agente oxidante, provocando la ignición espontánea y a veces explosiva de la materia orgánica. En soluciones acuosas, oxida los hidrocarburos a cetonas y alcoholes.
2. Producción industrial de dióxido de cloro
El dióxido de cloro (ClO2) se produce a partir de clorito de sodio (NaClO2) o clorato de sodio (NaClO3). Ambos materiales de partida son relativamente estables, a pesar de su potencial oxidante.
Los métodos de producción implican la reducción de clorato o la oxidación de clorito. Sin embargo, la reducción de clorato sigue siendo el método dominante debido a su rentabilidad, especialmente para aplicaciones a gran escala que superan los 2000 kg/día de ClO2. Las operaciones de menor escala pueden utilizar clorito o clorato.
La principal reacción para la reducción de clorato es:
ClO3– + agente reductor + ácido → ClO2 + subproductos
Este proceso ocurre dentro de un medio electrolítico fuerte que contiene un ácido potente (ácido sulfúrico o ácido clorhídrico) y un agente reductor (normalmente metanol). El agente reductor reduce selectivamente la valencia del átomo de cloro en una unidad. Mantener un exceso estequiométrico de ácido y agente reductor optimiza la economía ya que el clorato es la materia prima más cara.
La rentabilidad es un factor crucial que impulsa la selección del proceso. Sin embargo, la accesibilidad y la seguridad del suministro de ClO2 son igualmente importantes. Los procesos eficaces de producción de dióxido de cloro minimizan el impacto ambiental y cumplen con las normas de seguridad.
Hoy en día, existen dos disposiciones de proceso principales para la reducción de clorato:
- Los procesos de vacío ofrecen un enfoque más complejo pero producen una economía de producción general superior para operaciones a gran escala. Estos procesos retienen las materias primas en el reactor mientras cristalizan y separan las ventas subproductos.
- Los procesos atmosféricos utilizan una serie de reactores para lograr una reacción completa. El efluente ácido gastado de estos sistemas contiene subproductos, clorato residual y cantidades significativas de ácido.
El proceso de producción no es tan sencillo como parece; Pueden existir varias reacciones competitivas y paralelas, que a menudo implican entre 10 y 20 pasos individuales.
El control cuidadoso de las concentraciones y la pureza de los reactivos es esencial para lograr rendimientos y eficiencias del generador óptimos. Se pueden realizar ajustes en el proceso para cumplir con la capacidad de producción específica y los requisitos mínimos de formación de subproductos sin una inversión significativa.
2.1. Producción de dióxido de cloro a partir de clorato utilizando metanol como agente reductor
La reacción entre clorato de sodio, metanol y ácido sulfúrico representa la principal ruta industrial para la producción de dióxido de cloro:
9 NaClO3 + 2 CH3OH + 6 H2SO4 → 9 ClO2 + 3 Na3H(SO4)2 + 0,5 CO2 + 1,5 HCOOH + 7 H2O
Esta ecuación parece sencilla, pero implica numerosos pasos de reacción en competencia. Sin embargo, este proceso sigue siendo el método más rentable y confiable y representa aproximadamente el 75 % de la producción mundial de ClO2. Ofrece varias ventajas:
- Eficiencia económica: El proceso tiene bajos costos operativos.
- Fiabilidad: Se puede lograr una producción consistente y confiable.
- Formación mínima de cloro: la formación de cloro elemental es mínima, normalmente por debajo de 0,1 g/l en 10 g/ l de ClO2 solución.
- Compatibilidad de subproductos: El ácido fórmico generado (HCOOH) no inhibe los procesos de blanqueo posteriores.
Los procesos más importantes que emplean esta metodología son SVP-LITE (Eka Chemicals) y el relacionado R8 (ERCO Worldwide).
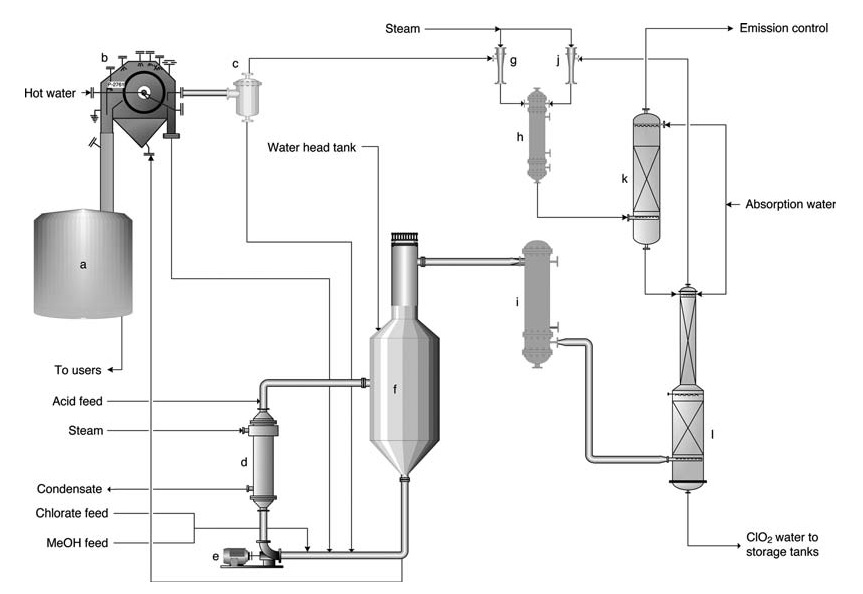
a) Tanque de disolución de masa de sal; b) Filtro de masa de sal; c) Tanque receptor de filtrado; d) Calderín; e) Bomba de circulación del generador; f) Generador SVP; g) Eyector para filtro de vacío; h) Condensador de vapor eyector; i) Inyector principal para vacío de proceso; j) Enfriador de gases; k) Depurador de ventilación; l) Torre de absorción
El proceso SVP-LITE (Figura 1) utiliza un sistema de circulación dentro de la vasija del reactor principal mantenido al vacío. Los reactivos (clorato, metanol y ácido sulfúrico) se introducen en el reactor, donde reaccionan para formar ClO2 y precipitan las sales subproductos.
El calor se proporciona a través de un hervidor y del calor de dilución del ácido sulfúrico. El dióxido de cloro sale del reactor junto con el agua evaporada y posteriormente se absorbe en agua dentro de una torre de absorción.
La solución de ClO2 resultante se bombea para almacenarla. El gas de cola del amortiguador se somete a una mayor depuración para minimizar las emisiones. Una porción de la solución del reactor se desvía a un filtro para eliminar la sal del subproducto antes de recircularla nuevamente al reactor.
Para simplificar el funcionamiento, la sal sólida normalmente se redisuelve y se dirige al sistema químico del molino.
Las tasas de producción generalmente oscilan entre 5 y 60 toneladas por día. El producto final contiene entre 9 y 10 g/l de ClO2 y prácticamente no contiene cloro elemental (el contenido de Cl2 suele ser inferior a 0,1 g/l, pero se garantiza que será inferior a 0,2 g/l).
La sal subproducto sin procesar del generador suele ser una sal de sulfato ácida conocida como sesquisulfato de sodio (Na3H(SO4)2). Sin embargo, el proceso se puede modificar para producir sulfato de sodio neutro (Na2SO4).
Esta conversión se logra transformando el sesquisulfato de sodio dentro de una unidad de planta dedicada (lo que lleva a los nombres de proceso SVP-SCW y R10, respectivamente).
La corriente de sesquisulfato del sistema del reactor se dirige a un tanque de mezcla/metátesis, donde sufre una conversión parcial en sulfato de sodio, que luego se separa mediante recristalización y filtración. Luego, la solución ácida se devuelve al reactor de ClO2.
Convertir la sal ácida a una forma neutra ofrece importantes ventajas, como un menor consumo de ácido y un menor volumen de masa de sal.
2.2. Producción de dióxido de cloro a partir de clorato utilizando peróxido de hidrógeno como agente reductor
El peróxido de hidrógeno (H2O2) también se puede utilizar como agente reductor en productos a base de clorato. Producción de ClO2. Este proceso genera oxígeno (O2) como subproducto, que se libera a la atmósfera:
NaClO3 + 0,5 H2O2 + 0,5 H2SO4 → ClO2 + 0,5 Na2SO4 + 0,5 O2 + H2O
A pesar de su aparente simplicidad, la reacción real es más compleja. La sal subproducto en condiciones de vacío puede ser sulfato de sodio o sesquisulfato de sodio dependiendo de la acidez del reactor. Aunque operar con mayor acidez ofrece la producción de sesquisulfato de sodio, esto tiene el costo de un mayor consumo de ácido y generación de masa de sal.
Las ventajas del peróxido de hidrógeno son las siguientes:
- Mayor capacidad: la cinética de reacción más rápida del peróxido de hidrógeno permite una mayor capacidad de producción dentro de las plantas de ClO2 existentes con un capital mínimo. inversión.
- Agente reductor más seguro: el peróxido de hidrógeno ofrece una alternativa más segura en comparación con otros agentes reductores como el metanol, el dióxido de azufre o el cloruro.
- Potencial para una masa de sal neutra: las modificaciones del proceso pueden producir una masa de sal neutra, lo que reduce el impacto ambiental.
- Dióxido de cloro más puro: el uso de peróxido de hidrógeno puede contribuir a obtener un producto ClO2 más puro.
Al igual que los procesos de vacío basados en metanol (Figura 1), los procesos de vacío utilizan los nombres comerciales SVP-HP o R11 (este último emplea un catalizador).
El proceso más común en condiciones atmosféricas es el proceso HP-A de Eka Chemicals (Figura 2), aplicable también a los procesos Solvay, Mathieson y R2. Este proceso normalmente se implementa como una actualización para instalaciones más antiguas debido a su diseño similar.
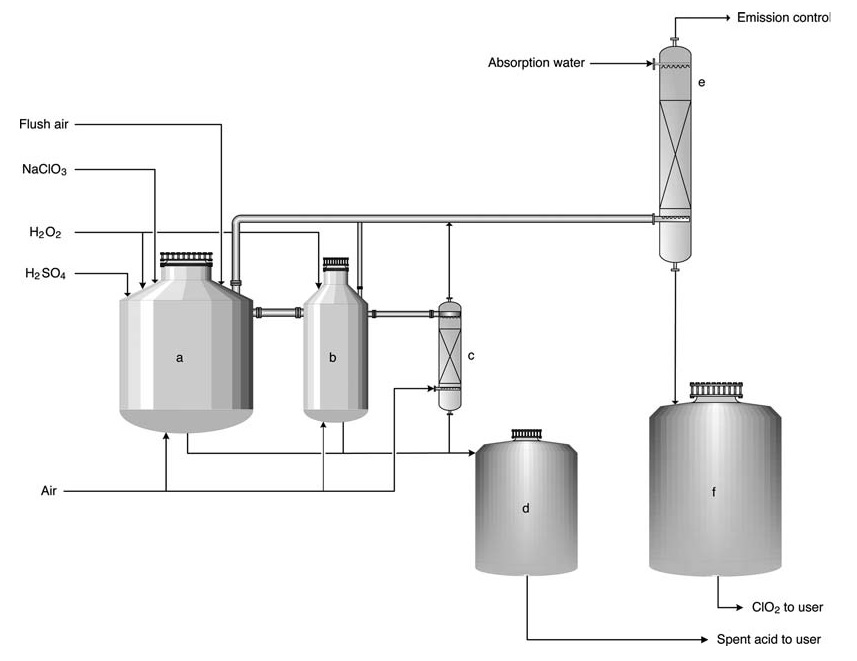
a) Reactor primario; b) reactor secundario; c) Decapante; d) Tanque de ácido gastado; e) Torre de absorción; f) Tanque de almacenamiento de solución ClO2
En el proceso HP-A, los reactivos se alimentan a una serie (normalmente 2 o 3) de reactores abiertos. El proceso es esencialmente adiabático y depende del calor de dilución del ácido sulfúrico para mantener la temperatura de reacción (normalmente 58 °C) y una ligera presión subambiente. La mayor parte de la conversión de clorato en dióxido de cloro ocurre en el primer reactor.
La sal subproducto permanece en solución, mientras se introducen grandes volúmenes de aire para desorber el ClO2 y mantener las concentraciones de gas por debajo del límite de explosión (10-12 % en volumen). Luego, el gas se dirige a una torre de absorción para la producción de agua con ClO2.
El ácido gastado se puede utilizar para la acidificación del molino o para reposición dentro del sistema de caldera de recuperación. El producto contiene 8 g/L de dióxido de cloro y prácticamente no contiene cloro elemental (concentración de Cl2 < 0,2 g/L).
Para aplicaciones de menor escala, como el tratamiento de agua o la producción de biocidas, el proceso SVP-Pure de Eka Chemicals (Figura 3) ofrece una solución sencilla y de baja inversión. Este proceso utiliza una solución premezclada de clorato y peróxido de hidrógeno junto con ácido sulfúrico.
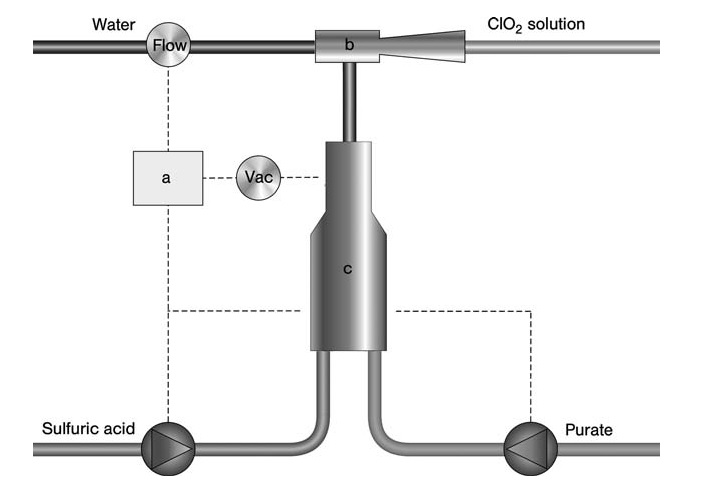
a) Controlador; b) Eductor; c) reactor
Todos los reactivos se alimentan simultáneamente a un reactor subatmosférico utilizando un eductor impulsado por una corriente de agua. Esta corriente de agua absorbe el ClO2 generado y los subproductos para formar el producto final (dióxido de cloro en agua).
Todo el sistema es compacto y está controlado por un microprocesador, lo que permite la producción bajo demanda con aplicación directa del producto. El contenido de ClO2 en este proceso suele oscilar entre 1 y 1,5 g/l, con variantes que alcanzan hasta 7 g/l para aplicaciones de blanqueo.
2.3. Producción de dióxido de cloro a partir de clorato utilizando dióxido de azufre como agente reductor
El dióxido de azufre (SO2) se puede emplear como agente reductor en procesos basados en clorato. Esta integración ofreció ventajas económicas y operativas, lo que contribuyó a la popularidad del proceso Mathieson en la década de 1950.
El proceso Mathieson, junto con los procesos Solvay y R2, desempeñaron un papel importante en la producción de dióxido de cloro para aplicaciones de blanqueo de pulpa. Sin embargo, su importancia ha disminuido en los últimos tiempos.
El proceso de Mathieson sigue una reacción ligeramente exotérmica, como lo representa la ecuación:
2 NaClO3 + H2SO4 + SO2 → 2 ClO2 + 2 NaHSO4
Si bien una reacción competitiva puede provocar la formación de cloro, se puede suprimir y la mayor parte del cloro generado reacciona aún más. Sin embargo, la cinética de la reacción es relativamente lenta, lo que da como resultado una conversión incompleta del clorato.
Agregar entre 1 y 10% en peso de cloruro de sodio en relación con el clorato es una práctica común para mejorar la velocidad de reacción. Sin embargo, esta adición también aumenta la formación de cloro como subproducto, lo que puede ser indeseable en ciertas aplicaciones.
El diseño del proceso Mathieson se parece mucho al proceso HP-A (Figura 2). La diferencia clave radica en la ausencia de entradas de peróxido de hidrógeno. En cambio, se introduce dióxido de azufre a través del aire del rociador.
2.4. Producción de dióxido de cloro a partir de clorito de sodio
El clorito de sodio (NaClO2) también se puede utilizar como materia prima para la generación de dióxido de cloro, principalmente para aplicaciones a pequeña escala. Sin embargo, algunas instalaciones de tratamiento de agua potable pueden utilizar este método para producción a mayor escala (hasta varias toneladas por día). Hay dos métodos principales:
- Por activación con un ácido
En este proceso, el clorito reacciona con un ácido (ácido clorhídrico, HCl), como se muestra en la siguiente ecuación:
5 NaClO2 + 4 HCl → 4 ClO2 + 5 NaCl + H2O
El ácido sulfúrico puede ser un sustituto, pero conduce a tasas de producción más bajas debido a la ausencia de catálisis de cloruro. Aunque es más caro, con un coste de producción un 25 % mayor, este método ofrece un producto ClO2 libre de cloro.
- Por activación con cloro
Este método utiliza cloro elemental en fase gaseosa o disuelto en agua (donde se hidroliza a ácido hipocloroso y ácido clorhídrico). La reacción general se ilustra en la ecuación:
2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
El proceso activado por cloro gaseoso ha sido el estándar de la industria durante mucho tiempo. Este sistema de dos alimentaciones aprovecha la rápida reacción entre el cloro molecular y los iones de clorito.
El método Rio Linda utiliza alimentaciones separadas de solución de clorito de sodio y cloro gaseoso, lo que les permite reaccionar antes de ser arrastrados a la aplicación por una corriente de agua a través de un eductor que crea la baja presión necesaria.
2.5. Producción de dióxido de cloro mediante procesos electroquímicos
El dióxido de cloro se puede producir mediante métodos electroquímicos a partir de clorito de sodio, generalmente acompañado de producción de hidróxido de sodio. La electroquímica permite un control preciso sobre la producción de ClO2; sin embargo, los electrodos y las membranas son susceptibles a las impurezas, por lo que se necesita agua desionizada para un funcionamiento óptimo.
La oxidación del clorito a dióxido de cloro ocurre en el ánodo y los iones de sodio migran a través de una membrana hacia el lado del cátodo, donde la electrólisis del agua produce gas hidrógeno e iones de hidróxido.
La electrólisis también se puede utilizar para generar el ácido necesario para la activación del clorito en el proceso de clorito de sodio.
El dióxido de cloro producido se separa de la solución de clorito mediante extracción con aire antes de su uso.
La electroquímica también se puede emplear para minimizar la producción de masa de sal en procesos a gran escala basados en clorato. Este método reduce el consumo de ácido sulfúrico mediante el uso de protones generados electroquímicamente y la eliminación de iones de sodio mediante la coproducción de soda cáustica.
Aunque son beneficiosos para el medio ambiente, estos procesos electroquímicos requieren una gran inversión de capital y un importante consumo de energía eléctrica.
2.6. Productos de dióxido de cloro estabilizados
Varios proveedores comerciales ofrecen productos de dióxido de cloro estabilizado. Todos estos productos son soluciones tamponadas que contienen iones de clorito (o clorato) que requieren activación para liberar dióxido de cloro.
Estos productos vienen en dos formas:
- Las soluciones acuosas son soluciones tamponadas con clorito o clorato, que requieren la adición de ácido para la liberación de dióxido de cloro.
- Sólidos contienen clorito o clorato incorporado en matrices sólidas (geles o absorbentes) donde está unido el dióxido de cloro. La activación se logra calentando o lavando el dióxido de cloro.
Los productos de dióxido de cloro estabilizado se utilizan en diversas aplicaciones a pequeña escala (menos de 5 kg/día), como control de olores, tratamiento del aire, aplicaciones biocidas, desinfección, y purificación de agua.
3. Usos del dióxido de cloro
El dióxido de cloro se utiliza en varios sectores, siendo el blanqueo de pulpa la aplicación dominante. Sin embargo, su viabilidad económica a menudo pasa desapercibida debido a la naturaleza de las estadísticas de marketing y prensa especializada.
Debido a su naturaleza inestable, el ClO2 no se puede almacenar y debe generarse en el punto de uso. A pesar de esta limitación, sigue siendo el óxido de cloro o el ácido cloro-oxígeno de mayor valor comercial.
3.1. Usos en el Blanqueo de Pulpa
Más del 90% de la producción mundial de pulpa Kraft (madera dura y blanda) utiliza dióxido de cloro en secuencias de blanqueo sin cloro elemental (ECF). Esto se debe a que el ClO2 oxida la lignina de forma selectiva, lo que mejora el rendimiento de la pulpa y mantiene las propiedades mecánicas.
Si bien el potencial blanqueador del dióxido de cloro se conoce desde hace más de 150 años, su adopción generalizada se produjo recién en la década de 1980. Los procesos de producción a gran escala seguros y fiables que surgieron en la década de 1940 contribuyeron a los procesos continuos modernos que se utilizan en la actualidad.
El principal impulsor para la adopción de ClO2 en el blanqueo de pulpa fue mitigar el impacto ambiental de los compuestos orgánicos clorados formados durante el blanqueo con cloro elemental. Desde finales de la década de 1980, el ClO2 ha reemplazado en gran medida al cloro elemental.
A diferencia del cloro elemental (un clorador universal fuerte), el dióxido de cloro no introduce átomos de cloro en los anillos aromáticos durante el blanqueo. Esto elimina la formación de compuestos orgánicos tóxicos altamente clorados como dioxinas y fenoles policlorados.
Aunque algunos haluros orgánicos adsorbibles (AOX) todavía se generan incluso con ClO2 puro, son más fácilmente biodegradables, lo que resulta en una menor Impacto ambiental de los efluentes de las plantas de celulosa.
Tanto el blanqueo ECF como el blanqueamiento sin cloro total (TCF), cuando se realizan con las mejores prácticas, se consideran ambientalmente aceptables. El blanqueo moderno implica una combinación de productos químicos y procesos para lograr rentabilidad, alta calidad de pulpa y bajo impacto ambiental.
Las fábricas de alto rendimiento pueden lograr el blanqueo con entre 8 y 16 kg de dióxido de cloro por tonelada de pulpa.
3.2. Otras aplicaciones
Más allá del blanqueo de pulpa, el dióxido de cloro se utiliza en otros sectores, a menudo a menor escala.
- Blanqueo de fibras textiles: Al igual que el blanqueo de pulpa, el dióxido de cloro permite blanquear fibras naturales (lana, algodón) con propiedades específicas.
- Tratamiento de agua: El dióxido de cloro se utiliza en miles de plantas de tratamiento de agua potable debido a su eficacia y selectividad en comparación con alternativas como el cloro elemental, hipoclorito, ozono y luz ultravioleta. Ofrece un control superior de bacterias, control de olores y control de sabor y no genera trihalometanos como el cloro y el hipoclorito.
- Industria alimentaria: ClO2 encuentra aplicación en el control microbiano en la industria alimentaria.
- El dióxido de cloro se utiliza en la desinfección de aguas residuales y en el control de lodos en máquinas de papel.
- El dióxido de cloro se utiliza en los campos petrolíferos para eliminar biopelículas y neutralizar el sulfuro de hidrógeno y el sulfuro ferroso, que pueden causar contrapresión en los pozos. Además, se utiliza en el control de olores en la industria petrolera.
- Una aplicación emergente del ClO2 es la reducción de gases nitrosos procedentes de procesos de incineración (calderas de carbón, incineradores de residuos y calderas de recuperación). Esta aplicación ofrece altas eficiencias de eliminación (más del 90%) de NOx y mercurio con buena economía.
4. Toxicología del dióxido de cloro

El dióxido de cloro plantea riesgos específicos para la salud humana y posibles explosiones. Esta sección describe las consideraciones de seguridad clave para el manejo de ClO2.
Efectos y límites de exposición
- La liberación de dióxido de cloro gaseoso o líquido es fácilmente detectable debido a su olor acre, similar al del cloro.
- Bajas concentraciones irritan el sistema respiratorio y los ojos.
- Concentraciones más altas pueden provocar tos intensa, edema pulmonar (acumulación de líquido en los pulmones) e incluso la muerte.
- No existen datos en humanos sobre la carcinogenicidad o genotoxicidad del dióxido de cloro.
- Los límites de exposición laboral son:
- Promedio ponderado de tiempo (TWA) de 8 horas: 0,1 ppm
- Límite de exposición a corto plazo (STEL): 0,3 ppm
Prácticas de manipulación segura
- Realice la manipulación y el almacenamiento en áreas bien ventiladas.
- Mantenga temperaturas de almacenamiento frescas y utilice cantidades mínimas de solución.
- Implementar prácticas de gestión de seguridad de procesos.
- Proporcionar capacitación y equipo de seguridad adecuado (protección respiratoria, gafas contra salpicaduras de productos químicos, guantes y botas).
- Equipe las plantas de ClO2 y los puntos de aplicación con alarmas de detección de fugas de gas configuradas en 0,1 ppm (límite TWA).
Peligros de explosión
- El dióxido de cloro gaseoso es explosivo en concentraciones superiores al 10 % en el aire (presión parcial de 10 kPa).
- La descomposición en cloro y oxígeno es exotérmica y aumenta el volumen del gas, lo que provoca un aumento de la presión y una posible onda de choque.
- La descomposición puede iniciarse por impurezas de óxido metálico, superficies calientes, dilución rápida de ácido, golpes de presión, calor o luz solar.
Referencias
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2
- Halogens; Descriptive Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128046975000178
- The Chemistry of Chlorine Dioxide. – https://onlinelibrary.wiley.com/doi/10.1002/9780470166161.ch3
