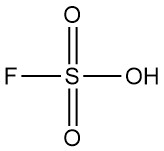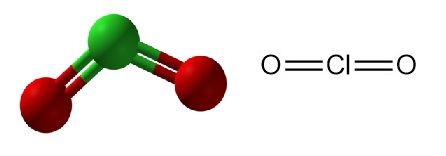
Il biossido di cloro è un composto chimico inorganico con formula ClO2. Esiste come gas giallo-verde a temperatura ambiente, come liquido rosso-marrone tra 11 °C e -59 °C e come cristalli arancioni brillanti al di sotto di -59 °C. Di solito viene gestito come una soluzione acquosa e viene prodotto in loco per applicazioni industriali.
Il biossido di cloro viene utilizzato principalmente nello sbiancamento della polpa di legno chimica. Storicamente, il cloro elementare era l’agente sbiancante dominante. Tuttavia, a causa di significative preoccupazioni ambientali associate al suo utilizzo, il biossido di cloro è diventato l’alternativa preferita dalla fine degli anni ’80.
Sommario
1. Proprietà del biossido di cloro
Il biossido di cloro (ClO2) è un composto cloro-ossigeno con un atomo di cloro che ha una valenza di quattro. Possiede un peso molecolare di 67,45 g/mol, un punto di fusione di -59 °C e un punto di ebollizione di 11 °C.
Questa proprietà rende il biossido di cloro un gas a temperatura ambiente. Questo gas ha un odore distinto, simile al cloro ma con un carattere pungente. È facilmente rilevabile a basse concentrazioni. Tuttavia, l’inalazione a concentrazioni moderate può essere pericolosa, causando danni respiratori.
Per motivi di sicurezza ed economici, il biossido di cloro disponibile in commercio non esiste in forma pura di gas, liquido o solido. Per piccole quantità, sono disponibili forme stabilizzate.
Il biossido di cloro si dissolve facilmente in acqua, esibendo un colore che va dal giallo pallido al giallo verdastro scuro a seconda della concentrazione (sia in fase gassosa che in soluzione). È altamente solubile in acqua pura, raggiungendo circa 60 g/L. La solubilità è inversamente proporzionale alla temperatura; diminuisce all’aumentare della temperatura. Il processo di dissoluzione non comporta idrolisi o dimerizzazione.
Il biossido di cloro ha un massimo di assorbimento a 360 nm. Sebbene non particolarmente distinto, questo picco può essere utilizzato per misurare la concentrazione di biossido di cloro in soluzioni gassose, acquose e persino organiche.
La molecola di biossido di cloro è intrinsecamente instabile da una prospettiva termodinamica. Le limitazioni cinetiche consentono la manipolazione in fase gassosa, ma esistono limitazioni rigorose. La pressione di vapore non deve superare 10–12 kPa per evitare una rapida decomposizione con potenziali rischi esplosivi.
Il biossido di cloro è relativamente stabile quando assorbito in soluzioni acquose (a causa del calore della soluzione), specialmente in condizioni fredde e buie. Tuttavia, la pressione di vapore su tali soluzioni richiede limitazioni di concentrazione (circa 1% in peso) per evitare un pericoloso accumulo di pressione di vapore. Inoltre, può verificarsi la formazione di ClO2·8 H2O cristallino. Il biossido di cloro può anche essere disciolto in vari altri solventi.
I due legami cloro-ossigeno possiedono un carattere di doppio legame con un angolo di legame di 117,5°. Con 19 elettroni di valenza, incluso un elettrone spaiato, il biossido di cloro ha un comportamento simile a quello dei radicali, consentendo diversi percorsi di reazione.
Similmente a tutti gli ossidi di cloro, presenta un elevato rischio di esplosione in caso di shock termico o fisico. La compressione della fase gassosa deve essere rigorosamente evitata.
Il biossido di cloro agisce come un forte agente ossidante, causando l’accensione spontanea e talvolta esplosiva di materia organica. In soluzioni acquose, ossida gli idrocarburi in chetoni e alcoli.
2. Produzione industriale di biossido di cloro
Il biossido di cloro viene prodotto dal clorito di sodio (NaClO2) o dal clorato di sodio (NaClO3). Entrambi questi materiali di partenza sono relativamente stabili, nonostante il loro potenziale ossidante.
I metodi di produzione comportano la riduzione del clorato o l’ossidazione del clorito. Tuttavia, la riduzione del clorato rimane il metodo dominante per la sua convenienza, soprattutto per applicazioni su larga scala che superano i 2.000 kg/giorno di ClO2. Le operazioni su scala più piccola possono utilizzare sia il clorito che il clorato.
La reazione principale per la riduzione del clorato è:
ClO3– + agente riducente + acido → ClO2 + sottoprodotti
Questo processo avviene all’interno di un mezzo elettrolitico forte contenente un acido potente (acido solforico o cloridrico) e un agente riducente (tipicamente metanolo). L’agente riducente riduce selettivamente la valenza dell’atomo di cloro di un’unità. Mantenere un eccesso stechiometrico di acido e agente riducente ottimizza l’economia poiché il clorato è la materia prima più costosa.
L’economicità è un fattore cruciale che guida la selezione del processo. Tuttavia, l’accessibilità e la sicurezza della fornitura di ClO2 sono ugualmente importanti. I processi di produzione efficaci di biossido di cloro riducono al minimo l’impatto ambientale e rispettano le normative di sicurezza.
Oggi, ci sono due principali accordi di processo per la riduzione del clorato:
- I processi sotto vuoto offrono un approccio più complesso ma producono economie di produzione complessive superiori per operazioni su larga scala. Questi processi trattengono le materie prime nel reattore mentre cristallizzano e separano i sali sottoprodotti.
- I processi atmosferici utilizzano una serie di reattori per ottenere una reazione completa. L’effluente acido esausto da questi sistemi contiene sottoprodotti, clorato residuo e quantità significative di acido.
Il processo di produzione non è così semplice come sembra; possono esistere diverse reazioni concorrenti e parallele, che spesso coinvolgono 10-20 passaggi individuali.
Un attento controllo delle concentrazioni e della purezza dei reagenti è essenziale per ottenere rese ottimali ed efficienze del generatore. È possibile apportare modifiche al processo per soddisfare specifiche capacità di produzione e requisiti minimi di formazione di sottoprodotti senza investimenti significativi.
2.1. Produzione di biossido di cloro dal clorato usando metanolo come agente riducente
La reazione tra clorato di sodio, metanolo e acido solforico rappresenta la principale via industriale per la produzione di biossido di cloro:
9 NaClO3 + 2 CH3OH + 6 H2SO4 → 9 ClO2 + 3 Na3H(SO4)2 + 0,5 CO2 + 1,5 HCOOH + 7 H2O
Questa equazione sembra semplice, ma coinvolge numerosi passaggi di reazione concorrenti. Tuttavia, questo processo rimane il metodo più conveniente ed affidabile, rappresentando circa il 75% della produzione globale di ClO2. Offre diversi vantaggi:
- Efficienza economica: il processo ha bassi costi operativi.
- Affidabilità: è possibile ottenere una produzione costante e affidabile.
- Formazione minima di cloro: la formazione di cloro elementare è minima, in genere inferiore a 0,1 g/L in una soluzione di ClO2 da 10 g/L.
- Compatibilità con i sottoprodotti: l’acido formico generato (HCOOH) non inibisce i processi di sbiancamento a valle.
I processi più importanti che utilizzano questa metodologia sono SVP-LITE (Eka Chemicals) e il correlato R8 (ERCO Worldwide).
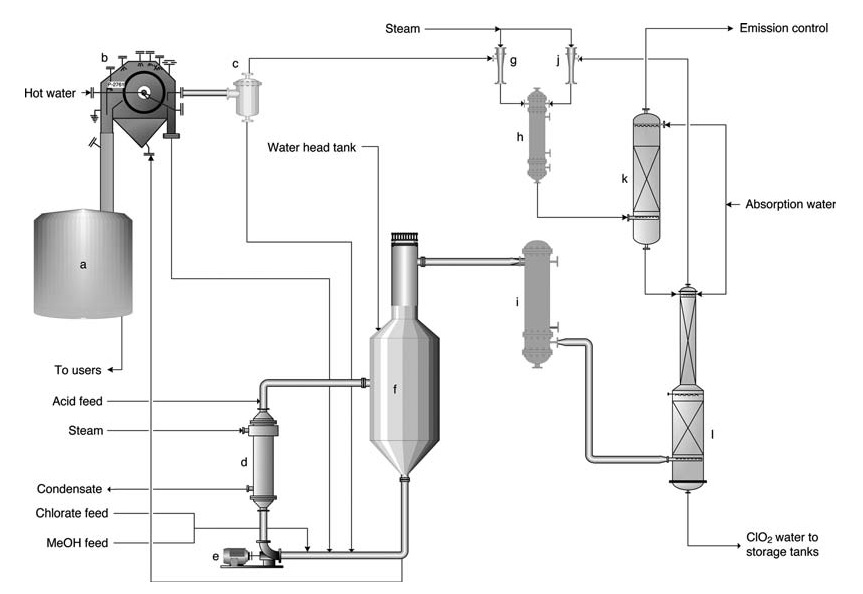
a) Vasca di dissoluzione della pan di sale; b) Filtro della pan di sale; c) Vasca di ricezione del filtrato; d) Ribollitore; e) Pompa di circolazione del generatore; f) Generatore SVP; g) Eiettore per vuoto del filtro; h) Condensatore del vapore dell'eiettore; i) Iniettore principale per vuoto di processo; j) Raffreddatore del gas; k) Scrubber di ventilazione; l) Torre di assorbimento
Il processo SVP-LITE (Figura 1) utilizza un sistema di circolazione all’interno di un recipiente del reattore principale mantenuto sotto vuoto. I reagenti (clorato, metanolo e acido solforico) vengono introdotti nel reattore, dove reagiscono per formare ClO2 e precipitare i sali sottoprodotti.
Il calore viene fornito tramite un ribollitore e dal calore di diluizione dell’acido solforico. Il biossido di cloro esce dal reattore insieme all’acqua evaporata e viene successivamente assorbito dall’acqua all’interno di una torre di assorbimento.
La soluzione di ClO2 risultante viene quindi pompata nello stoccaggio. Il gas di coda dall’assorbitore subisce un ulteriore lavaggio per ridurre al minimo le emissioni. Una parte della soluzione del reattore viene deviata verso un filtro per la rimozione del sale sottoprodotto prima di essere ricircolata nel reattore.
Per semplicità operativa, il sale solido viene in genere ridisciolto e indirizzato al sistema chimico del mulino.
I tassi di produzione variano generalmente da 5 a 60 tonnellate al giorno. Il prodotto finale contiene 9–10 g/L di ClO2 ed è praticamente privo di cloro elementare (il contenuto di Cl2 è in genere inferiore a 0,1 g/L ma garantito inferiore a 0,2 g/L).
Il sale sottoprodotto non elaborato del generatore è in genere un sale solfato acido noto come sesquisolfato di sodio (Na3H(SO4)2). Tuttavia, il processo può essere modificato per produrre solfato di sodio neutro (Na2SO4).
Questa conversione si ottiene trasformando il sesquisolfato di sodio all’interno di un’unità di impianto dedicata (da cui i nomi di processo SVP-SCW e R10, rispettivamente).
Il flusso di sesquisolfato dal sistema del reattore viene diretto a un serbatoio di miscelazione/metatesi, dove subisce una conversione parziale in solfato di sodio, che viene poi separato mediante ricristallizzazione e filtrazione. La soluzione acida viene quindi riportata al reattore ClO2.
La conversione del sale acido in una forma neutra offre vantaggi significativi, come un consumo ridotto di acido e un volume ridotto di pan di sale.
2.2. Produzione di biossido di cloro da clorato utilizzando perossido di idrogeno come agente riducente
Il perossido di idrogeno (H2O2) può anche essere utilizzato come agente riducente nella produzione di ClO2 a base di clorato. Questo processo genera ossigeno come sottoprodotto, che viene rilasciato nell’atmosfera:
NaClO3 + 0,5 H2O2 + 0,5 H2SO4 → ClO2 + 0,5 Na2SO4 + 0,5 O2 + H2O
Nonostante la sua apparente semplicità, la reazione effettiva è più complessa. Il sale sottoprodotto in condizioni di vuoto può essere solfato di sodio o sesquisolfato di sodio a seconda dell’acidità del reattore. Sebbene il funzionamento a un’acidità più elevata offra la produzione di sesquisolfato di sodio, ciò avviene a scapito di un maggiore consumo di acido e della generazione di pan di sale.
I vantaggi del perossido di idrogeno sono i seguenti:
- Maggiore capacità: la cinetica di reazione più rapida del perossido di idrogeno consente una maggiore capacità di produzione negli impianti ClO2 esistenti con un investimento di capitale minimo.
- Agente riducente più sicuro: il perossido di idrogeno offre un’alternativa più sicura rispetto ad altri agenti riducenti come metanolo, anidride solforosa o cloruro.
- Potenziale per sale neutro pan: le modifiche al processo possono produrre una pan di sale neutra, riducendo l’impatto ambientale.
- Biossido di cloro più puro: l’uso di perossido di idrogeno può contribuire a un prodotto ClO2 più puro.
Similmente ai processi sotto vuoto basati su metanolo (Figura 1), i processi sotto vuoto utilizzano i nomi commerciali SVP-HP o R11 (quest’ultimo impiega un catalizzatore).
Il processo più comune in condizioni atmosferiche è il processo Eka Chemicals HP-A (Figura 2), applicabile anche ai processi Solvay, Mathieson e R2. Questo processo è in genere implementato come aggiornamento per installazioni più vecchie grazie al suo design simile.
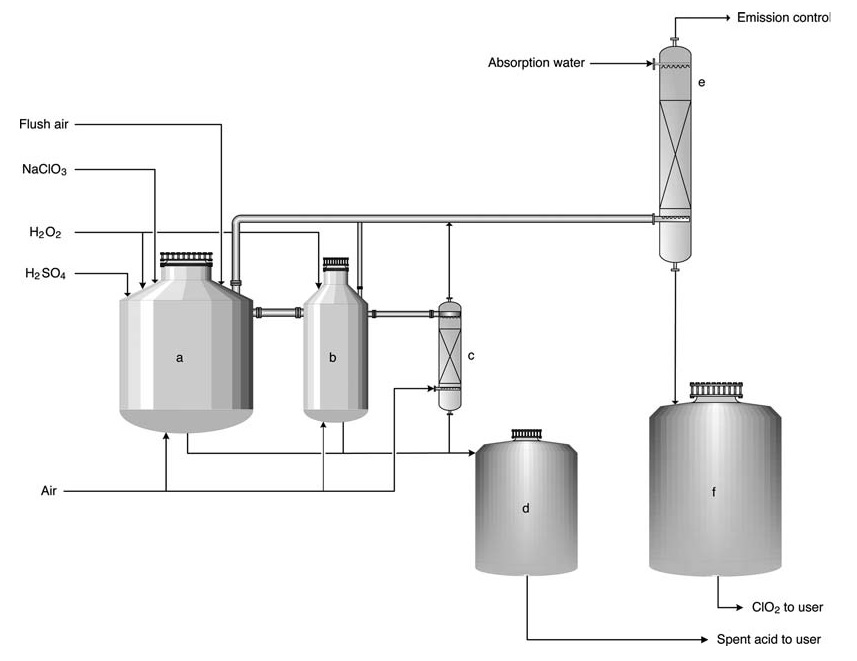
a) Reattore primario; b) Reattore secondario; c) Stripper; d) Serbatoio dell'acido esausto; e) Torre di assorbimento; f) Serbatoio di stoccaggio della soluzione di ClO2
Nel processo HP-A, i reagenti vengono immessi in una serie (solitamente 2-3) di reattori aperti. Il processo è essenzialmente adiabatico, basato sul calore di diluizione dell’acido solforico per mantenere la temperatura di reazione (tipicamente 58 °C) e una pressione leggermente sub-ambiente. La maggior parte della conversione del clorato in biossido di cloro avviene nel primo reattore.
Il sale sottoprodotto rimane in soluzione, mentre vengono introdotti grandi volumi d’aria per desorbire ClO2 e mantenere le concentrazioni di gas al di sotto del limite di esplosione (10–12 vol%). Il gas viene quindi indirizzato a una torre di assorbimento per la produzione di acqua ClO2.
L’acido esausto può essere utilizzato per l’acidificazione del mulino o per il reintegro all’interno del sistema della caldaia di recupero. Il prodotto contiene 8 g/L di biossido di cloro ed è praticamente privo di cloro elementare (concentrazione di Cl2 <0,2 g/L).
Per applicazioni su scala più piccola come il trattamento delle acque o la produzione di biocidi, il processo SVP-Pure di Eka Chemicals (Figura 3) offre una soluzione semplice e a basso investimento. Questo processo utilizza una soluzione premiscelata di clorato e perossido di idrogeno insieme ad acido solforico.
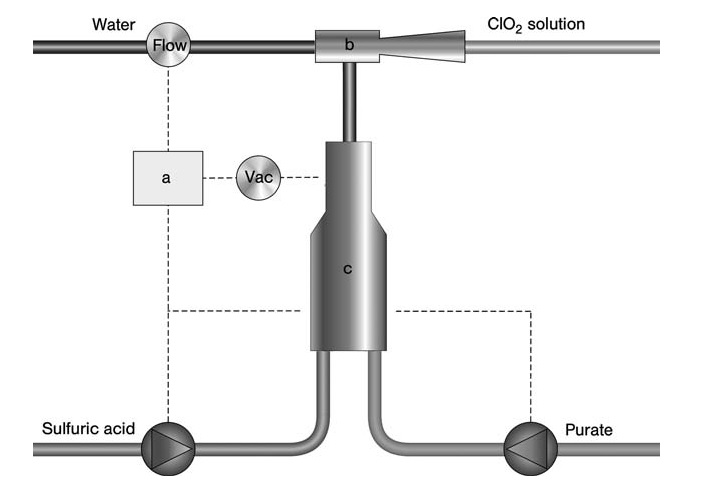
a) Controllore; b) Eiettore; c) Reattore
Tutti i reagenti vengono immessi simultaneamente in un reattore subatmosferico tramite un eiettore azionato da un flusso d’acqua. Questo flusso d’acqua assorbe il ClO2 generato e i sottoprodotti per formare il prodotto finale (biossido di cloro in acqua).
L’intero sistema è compatto e controllato da un microprocessore, consentendo la produzione su richiesta con applicazione diretta del prodotto. Il contenuto di ClO2 in questo processo varia in genere da 1 a 1,5 g/L, con varianti che raggiungono fino a 7 g/L per applicazioni di sbiancamento.
2.3. Produzione di biossido di cloro dal clorato utilizzando l’anidride solforosa come agente riducente
L’anidride solforosa (SO2) può essere utilizzata come agente riducente nei processi a base di clorato. Questa integrazione ha offerto vantaggi economici e operativi, contribuendo alla popolarità del processo Mathieson negli anni ’50.
Il processo Mathieson, insieme ai processi Solvay e R2, ha svolto un ruolo importante nella produzione di biossido di cloro per applicazioni di sbiancamento della polpa. Tuttavia, la sua importanza è diminuita negli ultimi tempi.
Il processo Mathieson segue una reazione leggermente esotermica, come rappresentato dall’equazione:
2 NaClO3 + H2SO4 + SO2 → 2 ClO2 + 2 NaHSO4
Mentre una reazione concorrente può portare alla formazione di cloro, questa può essere soppressa e la maggior parte del cloro generato reagisce ulteriormente. Tuttavia, la cinetica della reazione è relativamente lenta, con conseguente conversione incompleta del clorato.
Aggiungere 1-10% in peso di cloruro di sodio rispetto al clorato è una pratica comune per aumentare la velocità di reazione. Tuttavia, questa aggiunta aumenta anche la formazione di cloro come sottoprodotto, che può essere indesiderabile in alcune applicazioni.
Il layout del processo Mathieson assomiglia molto al processo HP-A (Figura 2). La differenza principale risiede nell’assenza di ingressi di perossido di idrogeno. Invece, l’anidride solforosa viene introdotta attraverso l’aria dello sparger.
2.4. Produzione di biossido di cloro dal clorito di sodio
Il clorito di sodio (NaClO2) può anche essere utilizzato come materia prima per la generazione di biossido di cloro, principalmente per applicazioni su piccola scala. Tuttavia, alcuni impianti di trattamento dell’acqua potabile possono utilizzare questo metodo per una produzione su larga scala (fino a diverse tonnellate al giorno). Esistono due metodi principali:
- Attivazione con un acido
In questo processo, il clorito reagisce con un acido (acido cloridrico, HCl), come mostrato nella seguente equazione:
5 NaClO2 + 4 HCl → 4 ClO2 + 5 NaCl + H2O
L’acido solforico può essere un sostituto, ma comporta tassi di produzione inferiori a causa dell’assenza di catalisi del cloruro. Sebbene più costoso, con un costo di produzione superiore del 25%, questo metodo offre un prodotto ClO2 privo di cloro.
- Attivazione con cloro
Questo metodo utilizza il cloro elementare nella fase gassosa o disciolto in acqua (dove si idrolizza in acido ipocloroso e acido cloridrico). La reazione complessiva è illustrata nell’equazione:
2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
Il processo attivato dal gas di cloro è da tempo lo standard del settore. Questo sistema a due alimentazioni sfrutta la rapida reazione tra cloro molecolare e ioni clorito.
Il metodo Rio Linda utilizza alimentazioni separate di soluzione di clorito di sodio e cloro gassoso, consentendo loro di reagire prima di essere aspirati nell’applicazione da un flusso d’acqua tramite un eiettore che crea la bassa pressione necessaria.
2.5. Produzione di biossido di cloro mediante processi elettrochimici
Il biossido di cloro può essere prodotto mediante metodi elettrochimici dal clorito di sodio, solitamente accompagnato dalla produzione di idrossido di sodio. L’elettrochimica consente un controllo accurato sulla produzione di ClO2; tuttavia, elettrodi e membrane sono sensibili alle impurità, rendendo necessaria acqua deionizzata per un funzionamento ottimale.
L’ossidazione del clorito in biossido di cloro avviene all’anodo e gli ioni sodio migrano attraverso una membrana verso il lato del catodo, dove l’elettrolisi dell’acqua produce gas idrogeno e ioni idrossido.
L’elettrolisi può anche essere utilizzata per generare l’acido necessario per l’attivazione del clorito nel processo del clorito di sodio.
Il biossido di cloro prodotto viene separato dalla soluzione di clorito mediante strippaggio ad aria prima di essere utilizzato.
L’elettrochimica può anche essere impiegata per ridurre al minimo la produzione di pan di sale in processi su larga scala basati sul clorato. Questo metodo riduce il consumo di acido solforico utilizzando protoni generati elettrochimicamente e rimuovendo gli ioni di sodio tramite soda caustica co-prodotta.
Sebbene siano vantaggiosi per l’ambiente, questi processi elettrochimici richiedono un elevato investimento di capitale e un consumo significativo di energia elettrica.
2.6. Prodotti di biossido di cloro stabilizzato
Vari fornitori commerciali offrono prodotti di biossido di cloro stabilizzato. Questi prodotti sono tutti soluzioni tamponate contenenti ioni clorito (o clorato) che richiedono l’attivazione per rilasciare biossido di cloro.
Questi prodotti si presentano in due forme:
- Le soluzioni acquose sono soluzioni tamponate con clorito o clorato, che richiedono l’aggiunta di acido per il rilascio di biossido di cloro.
- I solidi contengono clorito o clorato incorporati in matrici solide (gel o assorbenti) in cui è legato il biossido di cloro. L’attivazione si ottiene riscaldando o lavando via il biossido di cloro.
I prodotti di biossido di cloro stabilizzato sono utilizzati in varie applicazioni su piccola scala (meno di 5 kg/giorno), come il controllo degli odori, il trattamento dell’aria, le applicazioni biocide, la disinfezione e la purificazione dell’acqua.
3. Utilizzi del biossido di cloro
Il biossido di cloro è utilizzato in vari settori, con lo sbiancamento della polpa come applicazione dominante. Tuttavia, la sua redditività economica spesso passa inosservata a causa della natura delle statistiche di marketing e della stampa di settore.
A causa della sua natura instabile, ClO2 non può essere immagazzinato e deve essere generato nel punto di utilizzo. Nonostante questa limitazione, rimane l’ossido di cloro o acido ossigeno di cloro più prezioso a livello commerciale.
3.1. Utilizzi nello sbiancamento della polpa
Oltre il 90% della produzione mondiale di polpa Kraft (legno duro e legno tenero) utilizza il biossido di cloro in sequenze di sbiancamento senza cloro elementare (ECF). Questo perché ClO2 ossida selettivamente la lignina, il che aumenta la resa della polpa e mantiene le proprietà meccaniche.
Sebbene il potenziale sbiancante del biossido di cloro sia noto da oltre 150 anni, la sua adozione diffusa è avvenuta solo negli anni ’80. Processi di produzione su larga scala sicuri e affidabili emersi negli anni ’40 hanno contribuito ai moderni processi continui utilizzati oggi.
Il principale fattore trainante per l’adozione di ClO2 nello sbiancamento della polpa è stato quello di mitigare l’impatto ambientale dei composti organici clorurati formati durante lo sbiancamento con cloro elementare. Dalla fine degli anni ’80, il ClO2 ha ampiamente sostituito il cloro elementare.
A differenza del cloro elementare (un forte clorante universale), il biossido di cloro non introduce atomi di cloro negli anelli aromatici durante lo sbiancamento. Ciò elimina la formazione di sostanze organiche tossiche e altamente clorurate come diossine e fenoli policlorurati.
Sebbene alcuni alogenuri organici adsorbibili (AOX) vengano comunque generati anche con ClO2 puro, sono più facilmente biodegradabili, con conseguente minore impatto ambientale degli effluenti delle cartiere.
Sia lo sbiancamento ECF che quello Total Chlorine-Free (TCF), se eseguiti secondo le migliori pratiche, sono considerati accettabili dal punto di vista ambientale. Lo sbiancamento moderno prevede una combinazione di prodotti chimici e processi per ottenere efficienza dei costi, elevata qualità della polpa e basso impatto ambientale.
Gli stabilimenti ad alte prestazioni possono ottenere lo sbiancamento con 8-16 kg di biossido di cloro per tonnellata di polpa.
3.2. Altre applicazioni
Oltre allo sbiancamento della polpa, il biossido di cloro viene utilizzato in altri settori, spesso su scala minore.
- Sbiancamento delle fibre tessili: simile allo sbiancamento della polpa, il biossido di cloro consente di sbiancare le fibre naturali (lana, cotone) con proprietà specifiche.
- Trattamento delle acque: il biossido di cloro viene utilizzato in migliaia di impianti di trattamento delle acque potabili per la sua efficacia e selettività rispetto ad alternative come cloro elementare, ipoclorito, ozono e luce UV. Offre un controllo batterico superiore, controllo degli odori e controllo del gusto e non genera trialometani come cloro e ipoclorito.
- Industria alimentare: ClO2 trova applicazione nel controllo microbico nell’industria alimentare.
- Il biossido di cloro è utilizzato nella disinfezione delle acque reflue e nel controllo del limo nelle macchine per la carta.
- Il biossido di cloro è utilizzato nei giacimenti petroliferi per rimuovere i biofilm e neutralizzare l’acido solfidrico e il solfuro ferroso, che possono causare contropressione nei pozzi. Inoltre, trova impiego nel controllo degli odori nell’industria petrolifera.
- Un’applicazione emergente del ClO2 è la riduzione dei gas nitrosi dai processi di incenerimento (caldaie a carbone, inceneritori di rifiuti e caldaie di recupero). Questa applicazione offre elevate efficienze di rimozione (oltre il 90%) per NOx e mercurio con una buona economia.
4. Tossicologia del biossido di cloro

Il biossido di cloro presenta rischi specifici per la salute umana e potenziali esplosioni. Questa sezione delinea le principali considerazioni di sicurezza per la gestione di ClO2.
Effetti e limiti dell’esposizione
Il rilascio di gas o liquido di biossido di cloro è facilmente rilevabile a causa del suo odore pungente, simile a quello del cloro e basse concentrazioni irritano l’apparato respiratorio e gli occhi.
Concentrazioni più elevate possono causare tosse grave, edema polmonare (accumulo di liquidi nei polmoni) e persino la morte.
Non esistono dati sull’uomo sulla cancerogenicità o genotossicità del biossido di cloro.
I limiti di esposizione professionale sono:
- Media ponderata nel tempo (TWA) su 8 ore: 0,1 ppm
- Limite di esposizione a breve termine (STEL): 0,3 ppm
Pratiche di manipolazione sicura
- Effettuare la manipolazione e lo stoccaggio in aree ben ventilate.
- Mantenere temperature di stoccaggio basse e utilizzare quantità minime di soluzione.
- Implementare pratiche di gestione della sicurezza dei processi.
- Fornire formazione e attrezzature di sicurezza adeguate (protezione respiratoria, occhiali antispruzzo, guanti e stivali).
- Dotare gli impianti di ClO2 e i punti di applicazione di gas allarmi di rilevamento perdite impostati a 0,1 ppm (limite TWA).
Pericoli di esplosione
Il biossido di cloro gassoso è esplosivo a concentrazioni superiori al 10% nell’aria (pressione parziale di 10 kPa).
La decomposizione in cloro e ossigeno è esotermica e aumenta il volume del gas, determinando un aumento della pressione e una potenziale onda d’urto.
La decomposizione può essere avviata da impurità di ossido metallico, superfici calde, rapida diluizione acida, shock di pressione, calore o luce solare.
Riferimenti
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2
- Halogens; Descriptive Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128046975000178
- The Chemistry of Chlorine Dioxide. – https://onlinelibrary.wiley.com/doi/10.1002/9780470166161.ch3