Cloruro de alilo: producción, reacciones y usos

El cloruro de alilo (cas 107-05-1) es un cloropropeno que fue producido por primera vez en 1857 por Auguste Cahours y August Wilhelm Hofmann haciendo reaccionar cloruro de fósforo con alcohol alílico. El nombre «alilo» se deriva de la palabra latina «allium», que significa «ajo». El cloruro de alilo tiene un olor característico a ajo que puede detectarse incluso en pequeñas cantidades.
A finales de la década de 1930, IG Farbenindustrie y Shell Development Company desarrollaron un proceso para producir cloruro de alilo a gran escala mediante la cloración de propeno a altas temperaturas. Este proceso permitió obtener altos rendimientos de cloruro de alilo y fue rápidamente adoptado por otras empresas, incluidas Dow, Solvay y Asahi-Kashima.
El cloruro de alilo se utiliza en una variedad de aplicaciones, incluida la producción de epiclorhidrina, glicerina y pesticidas. También se utiliza como monómero en la producción de plásticos y resinas.
Tabla de contenido
1. Propiedades físicas del cloruro de alilo
El cloruro de alilo es un líquido móvil incoloro con un olor penetrante y acre. Tiene un peso molecular de 76,53 y un punto de fusión de -134 grados Celsius. Su punto de ebullición a 101,3 kPa es 44,4 grados Celsius. Su índice de refracción a 25 grados Celsius es 1,413.
La siguiente tabla muestra la dependencia de la temperatura de las propiedades físicas del cloruro de alilo.
| Temperatura (°C) | Densidad (g/cm³) | Capacidad calorífica específica (kJ kg⁻¹ K⁻¹) | Viscosidad (mPa·s) | Tensión superficial (mN/m) |
|---|---|---|---|---|
| 10 | 0,950 | 1.633 | 368 | 28.2 |
| 15 | 0,944 | 1.666 | 347 | 27.4 |
| 20 | 0,938 | 1.700 | 336 | 26,7 |
| 25 | 0,931 | 1.733 | 315 | 25,9 |
| 30 | 0,925 | 1.771 | 307 | 25.2 |
| 40 | 0,911 | 1.816 | 282 | 24.4 |
| 50 | 0,898 | 1.868 | 257 | 23,7 |
La presión de vapor del cloruro de alilo se puede calcular mediante la siguiente ecuación:
log(p) = 19,1403 – 2098 / T – 4,2114×log(T)
donde p es la presión de vapor en kPa y T es la temperatura en Kelvin.
El cloruro de alilo es miscible con la mayoría de los disolventes de uso general, como el octano, el tolueno y la acetona. La solubilidad del cloruro de alilo en agua a 20 grados Celsius es del 0,36% y la solubilidad del agua en cloruro de alilo es del 0,08%.
Los datos azeotrópicos para el cloruro de alilo se muestran en la Tabla 2.
| Componente | pb a 101,3 kPa, °C | Cloruro de alilo, fracción en masa, % |
|---|---|---|
| Agua | 43 | 97,8 |
| Metanol | 40 | 90 |
| Etanol | 44 | 95 |
| 2-Propanol | 45 | 98 |
| Ácido fórmico | 45 | 92,5 |
2. Reacciones químicas del cloruro de alilo
El cloruro de alilo es un compuesto muy reactivo que sufre una variedad de reacciones de adición, polimerización y sustitución. El átomo de cloro en el cloruro de alilo también se puede reemplazar fácilmente con otros grupos. Esto convierte al cloruro de alilo en un material de partida versátil para la síntesis de una amplia gama de compuestos.
2.1. Reacciones de adición
El cloruro de alilo se puede agregar a una variedad de compuestos, incluidos oxígeno, halógenos, haluros de hidrógeno, silanos, boranos, carboranos y tricloruro de fósforo. Estas reacciones se pueden utilizar para preparar una variedad de derivados alílicos.
Por ejemplo, cuando el cloruro de alilo reacciona con el oxígeno en la fase líquida a ca. 120 °C y en presencia de acetatos metálicos o peróxido de hidrógeno, se obtiene monoclorhidrina de glicerol.
Cuando el cloruro de alilo reacciona con halógenos, produce los correspondientes compuestos trihalógenos. La reacción con ácido hipocloroso, que produce 2,3- y 1,3-diclorhidrinas de glicerol (que luego se deshidrocloran con álcali para dar epiclorhidrina), es de gran importancia industrial.
El cloruro de alilo reacciona con haluros de hidrógeno para formar compuestos 1,2-dihalogeno. En presencia de peróxidos, la reacción con ácido bromhídrico produce 1-bromo-3-cloropropano (efecto Kharasch), pero en una solución de peróxido de hidrógeno altamente concentrada se forma 1,2-dibromo-3-cloropropano.
También se conocen reacciones de adición de silanos, boranos, carboranos y tricloruro de fósforo, así como cicloadiciones de cationes alilo con alquenos. El cloruro de alilo se polimeriza con dióxido de azufre para formar polisulfonas.
2.2. Polimerización
El cloruro de alilo puede polimerizarse para formar poli(cloruro de alilo), una resina dura e incolora. Esta resina se utiliza en una variedad de aplicaciones, incluidas pinturas, adhesivos y selladores.
2.3. Reacciones de sustitución
El átomo de cloro en el cloruro de alilo se puede reemplazar fácilmente con otros grupos, como yoduro, cianuro, isotiocianato, sulfuro, polisulfuros y alquiltioles. Estas reacciones se pueden utilizar para preparar una variedad de derivados alílicos con diferentes propiedades.
Por ejemplo, cuando el cloruro de alilo reacciona con el sulfito de sodio, produce alilsulfonato de sodio. El alilsulfonato de sodio es un compuesto versátil que se utiliza en una variedad de aplicaciones, incluidos cosméticos, productos farmacéuticos y aditivos alimentarios.
Además de estas reacciones comunes, el cloruro de alilo también puede sufrir una variedad de otras reacciones, como la carbonilación, la formación de policarbonatos orgánicos y la formación de éteres alílicos.
El cloruro de alilo es un compuesto peligroso y debe manipularse con cuidado. Es un líquido inflamable y puede irritar la piel y los ojos. También se sospecha que es cancerígeno. Si trabaja con cloruro de alilo, es importante usar equipo de protección, como guantes, gafas protectoras y un respirador.
3. Producción de cloruro de alilo
3.1. Proceso de cloración con propeno
La producción extensiva de cloruro de alilo se produce mediante el proceso de cloración del propeno a alta temperatura (300 – 600 °C):
CH2 = CH–CH3 + Cl2 → CH2 = CH–CH2Cl + HCl ⇒ ΔH(298k) = -113 kJ/mol
Durante estas temperaturas elevadas, el proceso de cloración avanza a través de un mecanismo de cadena de radicales libres. Este mecanismo sustituye predominantemente el átomo de hidrógeno ubicado en la posición alilo con cloro, produciendo así cloruro de alilo.
3.1.1. Reacciones secundarias y subproductos
A temperaturas inferiores a 200 °C, la reacción del propeno con cloro implica principalmente la adición del doble enlace, lo que da como resultado la formación de 1,2-dicloropropano. Cuando la temperatura supera los 300 °C, se produce la formación de cloruro de alilo, lo que produce 1,2-dicloropropano como subproducto. También se forman productos de cloración adicionales en pequeñas cantidades:
CH3–CH = CH2 + Cl2 → CH3–CHCl–CH2Cl ⇒ ΔH298 = -184 kJ/mol
ClCH2–CH = CH2 + Cl2 → CH2Cl–CH = CHCl + HCl ⇒ ΔH298 = -101 kJ/mol
CH3–CH = CH2 + Cl2 → CH3–C(Cl) = CH2 + HCl ⇒ ΔH298 = -121 kJ/mol
CH3–CH = CH2 + Cl2 → CH3–CH = CHCl + HCl
3.1.2. Parámetros críticos del proceso
En la cloración a escala industrial de propeno a cloruro de alilo, los factores más influyentes son la temperatura y la relación propeno-cloro. La presión y el tiempo de residencia tienen un impacto mínimo sobre el rendimiento de cloruro de alilo.
Para evitar la producción de 1,2-dicloropropano por debajo de 200 °C, la temperatura de mezcla del propeno y el cloro debe mantenerse por encima de 250 – 300 °C. Los mayores rendimientos de cloruro de alilo se obtienen en reactores industriales que funcionan a una temperatura máxima de 500 – 510 °C.
Si la temperatura supera este rango, se produce una pirólisis espontánea que produce hollín y alquitranes de alto punto de ebullición. En condiciones experimentales a aproximadamente 600 °C, se forma benceno, lo que provoca una reducción en el rendimiento del cloruro de alilo.
3.1.3. Relación propeno-cloro
Un aumento en el exceso de propeno da como resultado una formación reducida de subproductos. Sin embargo, amplifica los gastos de procesamiento del propeno. En consecuencia, las condiciones óptimas de reacción están determinadas por factores económicos, incluido el requisito de subproductos de dicloruro para su uso como nematicidas. Estos subproductos también pueden servir como materiales de partida para la síntesis de disolventes de tipo C1 o C2.
3.1.4. Presión del reactor y tiempo de residencia
La presión del reactor tiene un impacto mínimo en el rendimiento y la distribución del producto. Está determinado únicamente por la disminución de la presión dentro del sistema de circulación de propeno. De manera similar, el tiempo de residencia ejerce una influencia limitada sobre el rendimiento de cloruro de alilo.
El cloro reacciona completamente en 1 a 3 segundos a altas temperaturas de 300 a 600 °C y un tiempo de residencia excesivo conduce a la descomposición térmica del cloruro de alilo.
3.1.5. Diseño de reactores y selección de materiales.
Los reactores a escala industrial funcionan principalmente de forma adiabática, aunque se podrían lograr rendimientos óptimos con un funcionamiento isotérmico. Debido a la naturaleza rápida y exotérmica de la reacción, la pérdida de calor a través de las paredes del reactor es insignificante.
El tipo de reactor más sencillo y tradicional es el reactor tubular, a menudo equipado con funciones de dispersión de gas y eliminación de hollín. Se reconocen muchas otras configuraciones de reactor, cada una de las cuales se esfuerza por facilitar una mezcla rápida y completa de reactivos para mitigar la formación de 1,3-dicloropropeno.
En condiciones de flujo altamente turbulentas, se introducen propeno y cloro en la zona de reacción a velocidades de hasta 300 m/s. La importancia de unas condiciones de mezcla precisas se ve subrayada por un reactor ciclónico, en el que se obtienen rendimientos similares con una relación molar de 3:1 en comparación con una relación de 5:1 con diseños alternativos. Varios reactores tienen camisas de refrigeración.
Empleando una cascada de reactores con cloro distribuido, se pueden lograr tasas de conversión de cloro de hasta el 86%. Tal disposición permite temperaturas de precalentamiento elevadas debido a relaciones de propeno:cloro más altas en el reactor inicial.
3.1.6. Preparación de materia prima
La pureza del propeno y del cloro es muy importante. Las impurezas en el propeno provocan la formación de subproductos y la pérdida de cloro. En particular, el propano fomenta el desarrollo de derivados del cloro (1-cloropropano, 2-cloropropano) que son difíciles de separar.
Para la materia prima, a menudo se emplea propeno de pureza de grado polímero, alrededor del 99,5%. Para garantizar una pureza suficiente, el cloro se revaporiza. Sin embargo, esto introduce trazas de gases inertes, lo que provoca la pérdida de propeno al ventilar. Tanto el propeno como el cloro deben estar lo más libres de agua posible.
3.1.7. Vista general del proceso
En la Figura 1 se representa un proceso similar al empleado por Shell.
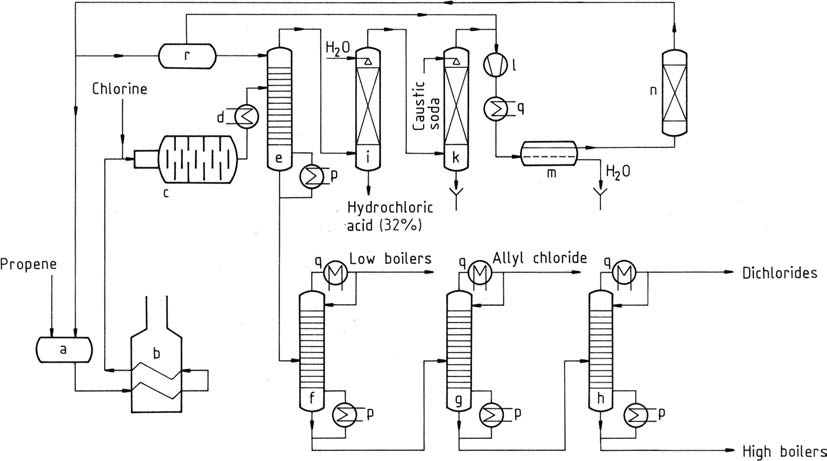
a) Recipiente de almacenamiento de propeno líquido; b) Evaporador y sobrecalentador de propeno; c) Reactor; d) Enfriador; e) Prefraccionador; f) Columna de extremos ligeros; g) columna de purificación de cloruro de alilo; h) columna de dicloropropeno; i) absorbente de cloruro de hidrógeno; k) Lavador de gases; l) Compresor; m) Decantador para retirar agua; n) Secadora de propeno; p) Evaporador; q) Condensador; r) Recipiente de almacenamiento de propeno en frío
El propeno líquido se vaporiza y luego se precalienta a temperaturas de 350 a 400 °C (b). Esta mezcla, junto con cloro gaseoso, se introduce en el reactor (c) a través de un chorro mezclador.
La reacción completa del cloro aumenta la temperatura a 500 – 510 °C (en condiciones óptimas). Incluso en las mejores circunstancias, se produce una formación mínima de carbono, lo que cataliza la cloración. Se forma una película protectora de carbón vítreo en las paredes del reactor.
Este material, compuesto por sustancias altamente cloradas y alquitrán, requiere una limpieza periódica cada 4 a 8 semanas. A menudo, se emplean cadenas de reactores paralelas para mantener la producción parcial durante la limpieza, o se puede buscar el funcionamiento alternativo de las dos cadenas.
La corriente de gas que sale del reactor de cloración sufre un preenfriamiento (d) y se dirige a un prefraccionador (e). La temperatura superior de este prefraccionador, mantenida en alrededor de -40 °C, se gestiona mediante alimentación de propeno líquido. De este modo se separan los hidrocarburos clorados y el producto de fondo está libre de propeno y cloruro de hidrógeno.
La mezcla gaseosa de cabeza se separa mediante absorción de agua (i), produciendo cloruro de hidrógeno acuoso de calidad comercial y propeno. A continuación se lava el propeno con sosa cáustica en un depurador (k) para eliminar trazas de cloruro de hidrógeno.
Después de la compresión a 1,2 MPa (12 bar), el propeno se condensa en un condensador (l, q). El propeno líquido se seca mediante adsorción (n) y se elimina el agua (m) y luego se devuelve al almacenamiento (a).
El producto de fondo del prefraccionador contiene 80 % de cloruro de alilo, 3 % de 2-cloro-1-propeno y otros componentes de bajo punto de ebullición, junto con un 16 % de dicloruros (principalmente 1,2-dicloropropano y cis- y trans-1,3-dicloro -1-propeno), y 1% de 1,2,3-tricloropropano y otras fracciones de alto punto de ebullición. Estas fracciones pueden separarse adicionalmente mediante destilación (f, g, h).
3.1.8. Selección de materiales para la construcción
La elección de materiales para la síntesis de cloruro de alilo (circulación de propeno) depende de las características específicas del proceso, la temperatura y la presión. Se puede utilizar acero al carbono estándar cuando las corrientes de productos mantienen un bajo contenido de agua.
Si no se precalienta cloro, también se puede emplear acero al carbono dentro del área del reactor. Sin embargo, en la región del reactor, la resistencia al cloro a altas temperaturas requiere materiales como aceros al cromo-níquel, níquel y aleaciones de cuproníquel.
Los recubrimientos de grafito y PTFE son ideales para la absorción de cloruro de hidrógeno, mientras que el acero engomado es adecuado para el depurador de soda cáustica. El acero al carbono es suficiente para toda la planta de fraccionamiento de hidrocarburos clorados, aunque los entornos con importantes volúmenes de agua exigen materiales costosos como el níquel y el cuproníquel. El cloruro de alilo seco se puede almacenar en recipientes de acero sin problemas de corrosión.
3.2. Otros procesos de producción
Se han propuesto procesos alternativos para la síntesis de cloruro de alilo, pero ninguno de estos métodos se ha implementado a escala comercial.
3.2.1. Cloración catalítica de propeno
La cloración del propeno en este método utiliza catalizadores que contienen teluro, lo que da como resultado rendimientos de cloruro de alilo de hasta el 82%. El subproducto principal es 17% de 2-cloropropano (cloruro de isopropilo). Cualquier propeno que no haya reaccionado y el cloruro de hidrógeno generado durante la reacción se pueden convertir en cloruro de alilo en un paso posterior que implica oxicloración.
3.2.2. Deshidrocloración de 1,2-dicloropropano
El proceso de deshidrocloración del 1,2-dicloropropano conduce a un rendimiento modesto de sólo el 55% de cloruro de alilo, acompañado de una cantidad significativa de monocloropropenos. A pesar de comenzar con abundantes cantidades de dicloropropano, que se producen durante la producción de óxido de propeno, este proceso no tiene usos comerciales.
3.2.3. oxicloración
La oxicloración se desarrolló como una estrategia para producir cloruro de alilo utilizando cloruro de hidrógeno fácilmente disponible en lugar de cloro como materia prima principal. Se han propuesto varios sistemas catalíticos, incluidos paladio, vanadio, teluro, cobre, litio, manganeso, así como sus respectivos cloruros, óxidos y combinaciones de los mismos.
Si bien muchos de estos procesos de oxicloración se inician a partir del propeno, algunos comienzan a partir del propano.
Un proceso, evaluado en una planta piloto por Hoechst, implica la reacción de propeno, cloruro de hidrógeno, oxígeno y 2-cloropropano (que puede producirse dentro de un reactor subsidiario o introducirse externamente) en un reactor primario de lecho fluido que funciona a temperaturas de 200 – 260 °C y presión manométrica de 0,1 MPa (1 bar) (ΔH = -218 kJ/mol).
La mezcla de catalizador incluye teluro, pentóxido de vanadio, ácido fosfórico y un compuesto de nitrógeno como promotor. Parte del flujo del catalizador se trata con aire y ácido nítrico en una corriente lateral para eliminar la formación de coque y mantener una reactividad constante.
En un reactor separado, se produce 2-cloropropano a partir de propeno, cloruro de hidrógeno y una solución de cloruro férrico. El propeno, el 2-cloropropano y el cloruro de hidrógeno que no han reaccionado se separan y reciclan.
El rendimiento de cloruro de alilo varía del 88 % al 94 % según el aporte de propeno. La pureza del propeno no es muy crítica en este caso.
Ciertos enfoques de oxicloración tienen inconvenientes inherentes. Por ejemplo, las actividades del catalizador disminuyen rápidamente debido a la volatilidad de las sales metálicas empleadas, lo que requiere grandes volúmenes de reactor debido a la baja conversión por paso.
Además, la extracción de cloruro de alilo altamente diluido de la mezcla de reacción sin una pérdida excesiva de propeno por oxidación plantea desafíos. Una solución a esto es utilizar dióxido de manganeso como catalizador y portador de oxígeno. Las principales reacciones que ocurren en el reactor primario son las siguientes:
MnO2 + 4 HCl → MnCl2 + Cl2 + 2 H2O
C3H6 + Cl2 → C3H5Cl + HCl
Posteriormente el catalizador se reoxida y se activa con oxígeno:
MnCl2 + O2 → MnO2 + Cl2
Este proceso logra rendimientos de cloruro de alilo que oscilan entre el 71 % y el 81 % según el consumo de propeno.
4. Usos del cloruro de alilo
El cloruro de alilo es un intermediario importante en la industria petroquímica. Se utiliza principalmente para producir epiclorhidrina, que se utiliza para fabricar resinas epoxi. El cloruro de alilo también es un material de partida para la síntesis de otros productos químicos, como glicerol, ésteres, éteres alílicos y alilaminas.
Otros compuestos que se pueden obtener a partir de cloruro de alilo incluyen isotiocianato de alilo (aceite de mostaza sintético), sulfonato de alilo, alilsilano y ciclopropano.
Aquí hay un desglose más detallado de los usos del cloruro de alilo:
1.Epiclorhidrina: El cloruro de alilo se utiliza para producir epiclorhidrina, que es un compuesto versátil con una amplia gama de aplicaciones. La epiclorhidrina se utiliza para fabricar resinas epoxi, que se utilizan en una variedad de productos, incluidos adhesivos, recubrimientos y compuestos.
La epiclorohidrina también se usa para producir glicerol, que es un líquido dulce e incoloro que se usa en una variedad de productos, incluidos alimentos, cosméticos y productos farmacéuticos.
2. Esterificación: El cloruro de alilo se utiliza en la esterificación de los ácidos ftálico, fosfórico y carboxílico. Este proceso produce ésteres, que son compuestos con una amplia gama de aplicaciones. Los ésteres se utilizan en perfumes, saborizantes y plásticos. También se utilizan como disolventes y como intermediarios en la producción de otras sustancias químicas.
3. Éteres alílicos y alilaminas: el cloruro de alilo se utiliza para producir éteres alílicos y alilaminas. Los éteres alílicos son compuestos de olor característico que se utilizan en perfumes y aromas. Las alilaminas son compuestos con una amplia gama de aplicaciones. Se utilizan en productos farmacéuticos, productos químicos agrícolas y plásticos.
4. Otros compuestos: El cloruro de alilo también se puede utilizar para producir otros compuestos, como isotiocianato de alilo, sulfonato de alilo, alilsilano y ciclopropano. El isotiocianato de alilo es un compuesto de fuerte olor que se utiliza en agentes fitosanitarios y preparados farmacéuticos.
El sulfonato de alilo se utiliza como aditivo para baños de galvanoplastia y en la producción de fibras de carbono. El alilsilano se utiliza para la producción de aditivos para la industria del caucho. El ciclopropano es un anestésico que se utiliza en cirugía.
5. Manipulación y protección ambiental del cloruro de alilo
El cloruro de alilo es una sustancia altamente reactiva, tóxica e inflamable. Por lo tanto, en muchos países está sujeto a estrictas regulaciones en cuanto a sus emisiones a la atmósfera. El cloruro de alilo debe manipularse en sistemas cerrados para cumplir con estas regulaciones.
Las mezclas gaseosas que contienen cloruro de alilo o subproductos derivados del proceso de producción deben purificarse mediante condensación, absorción, adsorción o combustión antes de ventilar. Una técnica eficaz para transferir cloruro de alilo de un recipiente a otro es la técnica de compensación.
Debe evitarse a toda costa la contaminación del suelo, las aguas subterráneas, los cursos de agua o las aguas residuales. Cualquier posible contaminación debe informarse inmediatamente a las autoridades.
La eliminación de desechos que contienen cloruro de alilo no plantea riesgos importantes cuando se emplean incineradores especializados como los que se utilizan para la eliminación de disolventes. Los gases de combustión de estos incineradores deben tratarse en absorbentes o depuradores para eliminar el cloruro de hidrógeno que se forma.
Debido a su alta volatilidad y bajo punto de inflamación, las plantas para la producción y procesamiento de cloruro de alilo deben cumplir con estrictas normas de seguridad contra incendios y explosiones.
La combustión de hidrocarburos clorados produce cloruro de hidrógeno, por lo que los bomberos que responden a incendios que involucran cloruro de alilo deben estar equipados con trajes protectores y aparatos respiratorios. Un suministro de aire inadecuado durante la combustión podría provocar la formación de monóxido de carbono.
El cloruro de alilo es muy reactivo y puede reaccionar de forma vigorosa, exotérmica e incluso explosiva con otras sustancias. Esto es especialmente válido para los metales alcalinos y alcalinotérreos, pero también para el aluminio y el zinc y para los agentes oxidantes fuertes, como el ácido sulfúrico concentrado.
Los haluros anhidros (por ejemplo, cloruros) de los metales mencionados anteriormente también reaccionan vigorosamente con el cloruro de alilo. Se debe prestar especial atención a los aspectos de seguridad de estas reacciones exotérmicas en plantas que producen o procesan cloruro de alilo.
En 1996, la Unión Europea clasificó el cloruro de alilo como «peligroso para el medio ambiente» y «muy tóxico para los organismos acuáticos».
6. Toxicología y Salud Ocupacional
En estudios de laboratorio con ratas y conejos, los valores de DL50 indican que el consumo oral de 460 mg/kg de cloruro de alilo resultó letal para las ratas, mientras que la aplicación percutánea de 3,7 mg/kg provocó la mortalidad en los conejos. Además, la inhalación de cloruro de alilo en una concentración de 11 mg/L durante 2 horas resultó letal para las ratas.
- El cloruro de alilo es una sustancia química tóxica que puede absorberse por inhalación, ingestión y a través de la piel.
- Es un fuerte irritante de la piel y las membranas mucosas y puede provocar síntomas como irritación ocular, tos, dificultad para respirar y entumecimiento.
- En altas concentraciones, el cloruro de alilo puede causar edema pulmonar (líquido en los pulmones), daño cardíaco, hepático y renal.
- También se sospecha que es carcinógeno y mutágeno.
- El valor límite umbral (TLV) para el cloruro de alilo es 1 ppm (promedio ponderado en el tiempo de 8 h). Esto significa que la concentración promedio de cloruro de alilo en el aire no debe exceder 1 ppm durante una jornada laboral de 8 horas.
- El límite de exposición a corto plazo al cloruro de alilo es de 2 ppm. Esto significa que la concentración de cloruro de alilo en el aire no debe exceder las 2 ppm durante un período de 15 minutos.
- El cloruro de alilo tiene un olor acre, pero este olor no es una señal de advertencia confiable. El umbral de percepción de olor para el cloruro de alilo es de 3 a 6 ppm, lo que está considerablemente por encima de las concentraciones de trabajo permitidas.
- Hay investigaciones limitadas sobre los efectos del cloruro de alilo en la salud humana. Sin embargo, la evidencia disponible sugiere que es una sustancia química tóxica con el potencial de causar una variedad de problemas de salud, incluidos cáncer y daños reproductivos.
Es importante señalar que la información contenida en el texto es sólo un resumen de la toxicidad conocida del cloruro de alilo. Los efectos reales de la exposición al cloruro de alilo pueden variar según el nivel de exposición del individuo, la duración de la exposición y otros factores.
Referencias
- Allyl Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_425
- https://www.solvay.com/sites/g/files/srpend221/files/2021-01/PSS-Allyl-Chloride-Epichlorohydrin.pdf
Preguntas más frecuentes
El cloruro de alilo, también conocido como 3-cloropropeno, es un compuesto orgánico con la fórmula química C3H5Cl. Es un líquido de incoloro a amarillo pálido que tiene importancia en el campo de la química orgánica debido a su reactividad y aplicaciones industriales.
Otro nombre para el cloruro de alilo es 3-cloropropeno. Este nombre alternativo refleja su estructura molecular, donde un átomo de cloro está unido al tercer átomo de carbono en una molécula de propeno.
La densidad del cloruro de alilo es 0,939 g/ml a 25 °C.
El cloruro de alilo se utiliza principalmente para producir epiclorhidrina, que se utiliza para fabricar resinas epoxi. El cloruro de alilo también es un material de partida para la síntesis de otros productos químicos, como glicerol, ésteres, éteres alílicos y alilaminas.
El cloruro de alilo se produce mediante la cloración de propeno a alta temperatura, un proceso conocido como cloración de propeno. Esto implica sustituir un átomo de hidrógeno en el carbono alílico por un átomo de cloro. Para su producción también se emplean varios otros métodos, como la cloración catalítica y la oxicloración.
Sí, el cloruro de alilo es tóxico y puede presentar riesgos para la salud por inhalación, contacto con la piel o ingestión. Puede causar irritación en el sistema respiratorio, la piel y los ojos. La exposición prolongada o altas concentraciones pueden provocar efectos más graves para la salud. Se deben tomar medidas de protección adecuadas al manipular cloruro de alilo.
El cloruro de alilo tiene un olor acre parecido al del ajo. El olor se puede detectar en concentraciones muy bajas.
El cloruro de alilo es altamente reactivo y puede sufrir diversas reacciones químicas. Puede reaccionar con una variedad de sustancias, incluidas agua, alcoholes, aminas y otros nucleófilos. Es particularmente reactivo con metales, metales alcalinos y alcalinotérreos, así como con agentes oxidantes fuertes como el ácido sulfúrico concentrado. Estas reacciones a menudo implican reacciones de sustitución o adición en el carbono alílico.
