Ácido pirúvico: propiedades, reacciones, producción y usos
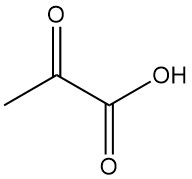
¿Qué es el ácido pirúvico?
El ácido pirúvico, también conocido como ácido 2-oxopropanoico, ácido piroacémico o ácido α-cetopropiónico, es un importante ácido α-oxocarboxílico con la fórmula C3H4O3. Es un líquido incoloro con un olor similar al del ácido acético que desempeña un papel importante en el metabolismo energético de los organismos vivos.
El ácido pirúvico se sintetiza a partir del glucógeno dentro del tejido muscular durante períodos de esfuerzo y posteriormente se reduce a ácido láctico. El metabolismo hepático del ácido pirúvico a alanina ocurre mediante aminación reductora.
El primer descubrimiento y descripción del ácido pirúvico se atribuye a Berzelius en 1835.
Tabla de contenido
1. Propiedades físicas del ácido pirúvico
El ácido pirúvico es un líquido incoloro con un olor similar al del vinagre agrio. Es miscible con agua, etanol y éter y existe únicamente en forma cetogénica; no se ha detectado la forma enólica.
Las propiedades físicas más importantes del ácido pirúvico se resumen en la siguiente tabla.
| Propiedad | Valor |
|---|---|
| Número CAS | [127-17-3] |
| Fórmula química | H3C-CO-COOH |
| Peso molecular | 88,06 g/mol |
| Punto de fusión | 13,6 °C |
| Punto de ebullición punto | a 101,31 kPa: 165 °C (descomposición) a 1,33 kPa: 57,9 °C a 0,13 kPa: 21,4 °C |
| Densidad (20 °C) | 1,268 g/cm3 |
| Índice de refracción (25 °C) | 1,4259 |
| pKa | 2,45 (a 25 °C) |
| Presión de vapor | 1,29 mmHg |
| Punto de inflamación | 91 °C |
| Temperatura de ignición | 305 °C |
2. Reacciones químicas del ácido pirúvico
El ácido pirúvico reacciona como ácido carboxílico y como cetona para formar derivados como oximas, hidrazonas y sales.
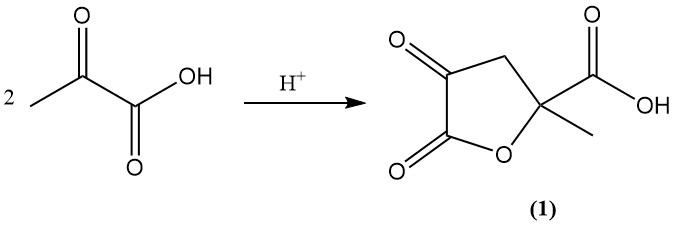
En condiciones ácidas o en reposo, el ácido pirúvico se convierte en ácido 4,5-dioxo-2-metiltetrahidrofurano-2-carboxílico (1).
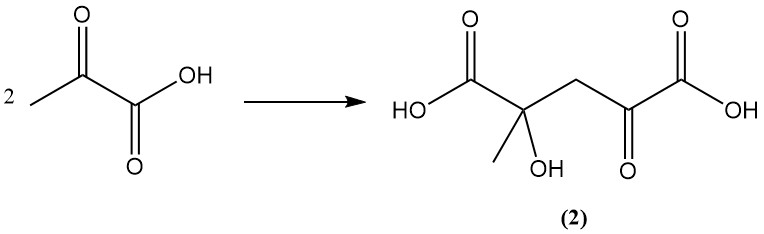
Las soluciones acuosas de ácido pirúvico se polimerizan a productos de mayor peso molecular a través del ácido cetoglutárico (2) y los productos aldólicos triméricos.
Al igual que otros 2-oxoácidos, cuando se trata con ácido sulfúrico concentrado, el ácido pirúvico elimina el monóxido de carbono.
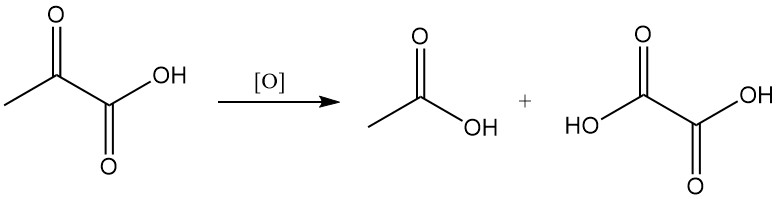
La oxidación del ácido pirúvico produce ácido acético u oxálico y dióxido de carbono, según las condiciones de reacción.
La reducción del ácido pirúvico produce ácido láctico.
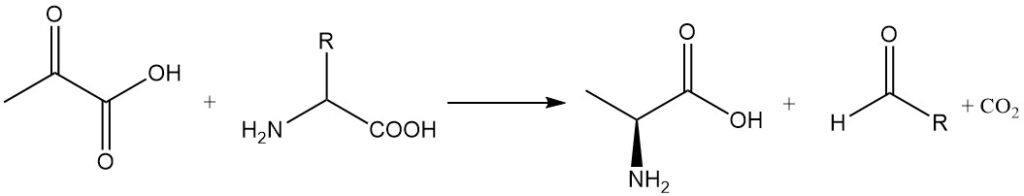
Las reacciones de transaminación entre el ácido pirúvico y los α-aminoácidos producen alanina y los aldehídos correspondientes con un átomo de carbono menos. La alanina también se puede sintetizar mediante aminación reductora del ácido pirúvico.
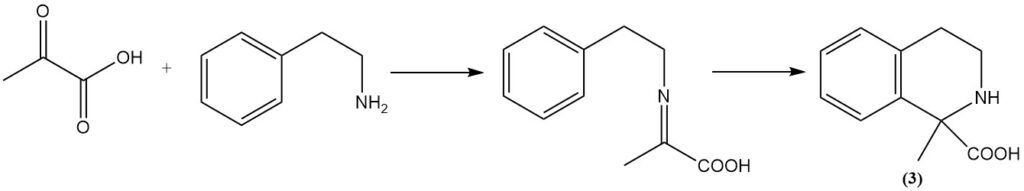
La reacción de Bischler-Napieralski de feniletilamina con ácido pirúvico produce la tetrahidroisoquinolina correspondiente (3).
El ácido pirúvico reacciona con o-fenilendiaminas para formar quinoxalinoles y con 4,5-diaminopirimidinas para producir hidroxipteridinas.
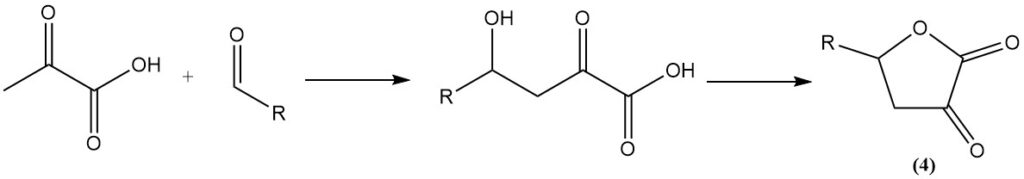
La reacción de los aldehídos con el ácido pirúvico produce α-ceto-γ-hidroxiácidos, que luego se ciclan para formar derivados de butirolactona (4).
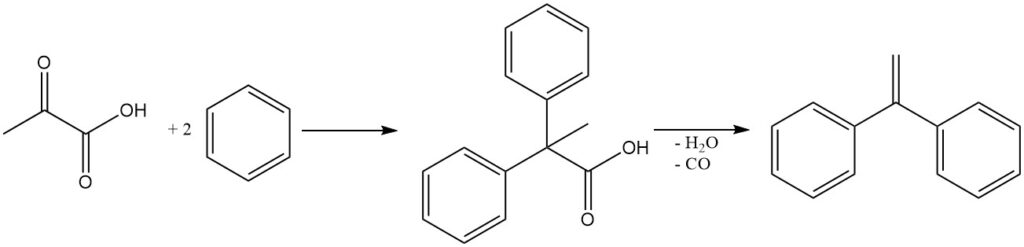
Los ácidos diarilpropiónicos se producen mediante reacciones de tipo Friedel-Crafts entre ácido pirúvico y compuestos aromáticos. Estos compuestos se utilizan como intermediarios en la síntesis de 1,1-diariletileno por deshidratación y descarbonilación.
3. Producción industrial de ácido pirúvico
El ácido pirúvico se produce industrialmente mediante la deshidratación y descarboxilación del ácido tartárico.
En este proceso, el ácido pirúvico se destila a partir de una mezcla de ácido tartárico e hidrogenosulfatos de potasio y sodio a 220 °C. El ácido crudo obtenido con un rendimiento de aproximadamente el 60 % se somete a una posterior destilación al vacío para su purificación. La adición de etilenglicol puede reducir la temperatura de reacción a 160 °C.
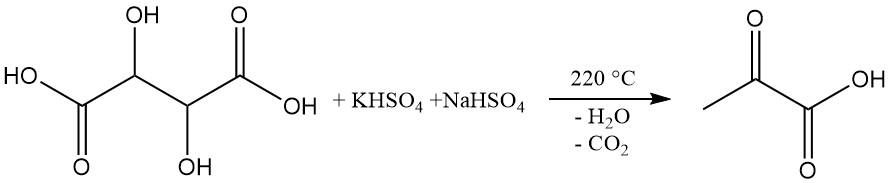
Los métodos de producción alternativos incluyen la oxidación en fase gaseosa del ácido láctico, aunque este proceso no ha logrado un éxito industrial.
Por el contrario, el proceso de oxidación microbiana del ácido D-láctico ofrece un alto rendimiento. Además, el ácido pirúvico se puede producir mediante la oxidación microbiana del propilenglicol o la hidrólisis de los ácidos 2,2-dihalopropiónicos. Otro método sintético es la oxidación de halógenos del metilglioxal.
4. Usos del ácido pirúvico
El ácido pirúvico se utiliza principalmente como intermediario en la síntesis de productos farmacéuticos como los antimicrobianos, antiinflamatorios y cardiovasculares.
También se utiliza en la producción de cosméticos por sus propiedades exfoliantes y renovadoras de la piel. A menudo se utiliza en peelings químicos.
El ácido pirúvico se utiliza en la industria alimentaria como agente aromatizante. A menudo se emplea en la producción de queso, yogur y otros productos lácteos. Contribuye al color y sabor del pan y la bollería y mejora el sabor de las carnes procesadas.
Además de sus propiedades potenciadoras del sabor, el ácido pirúvico también actúa como conservante en algunos productos alimenticios debido a su actividad antimicrobiana.
Otros usos del ácido pirúvico son la producción de agentes de protección de cultivos y polímeros.
5. Toxicología del ácido pirúvico
El ácido pirúvico es corrosivo e irrita los ojos, la piel y el sistema respiratorio.
Toxicidad aguda
- Ingestión: quemaduras graves en la boca y la garganta, con riesgo de perforación del esófago y el estómago.
- Inhalación: corrosivo para el sistema respiratorio.
- El contacto con la piel causa quemaduras graves.
- El contacto con los ojos causa lesiones oculares graves.
Otros efectos toxicológicos
- No hay datos disponibles sobre irritación o sensibilización dérmica.
- La prueba de Ames para mutagenicidad fue negativa.
- IARC, NTP y OSHA no clasifican el ácido pirúvico como carcinógeno.
- No hay datos disponibles sobre toxicidad para la reproducción.
- No hay información sobre toxicidad en órganos diana específicos ni sobre peligros por aspiración.
Referencias
- Oxocarboxylic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a18_313
- https://www.sciencedirect.com/topics/chemistry/bischler-napieralski-reaction
- https://pubchem.ncbi.nlm.nih.gov/compound/Pyruvic-Acid
- https://www.sigmaaldrich.com/US/en/sds/Aldrich/W297003
- https://chemistry-europe.onlinelibrary.wiley.com/doi/abs/10.1002/cber.19380711024
