Ácido oxálico: producción, reacciones y usos

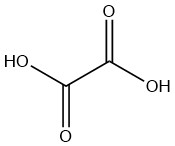
El ácido oxálico, un ácido dicarboxílico saturado, se considera el más simple de su tipo. Se presenta naturalmente en forma de dihidrato. El compuesto anhidro debe sintetizarse a partir del dihidrato incluso cuando se fabrica industrialmente.
Este ácido prevalece en el reino vegetal y animal, casi siempre en forma de sus sales y encuentra diversas aplicaciones industriales debido a sus propiedades químicas.
En particular, el ácido oxálico se conoce desde hace mucho tiempo y fue identificado por primera vez por WIEGLEB en 1769 en la sal potásica de la acedera.
Tabla de contenido
1. Producción de ácido oxálico
Existen numerosos procesos industriales utilizados en la producción de ácido oxálico, que han sido implementados por diversas empresas y todavía se utilizan en la actualidad.
En general, sólo se utilizan tres tipos de compuestos como materias primas en la producción de ácido oxálico. Estos incluyen carbohidratos (como melaza y etilenglicol), olefinas y monóxido de carbono.
En todos los procesos industriales el ácido oxálico se obtiene como dihidrato cristalino. Las siguientes secciones describen cuatro métodos que se utilizan actualmente industrialmente. Tres de estos métodos se basan en la oxidación del ácido nítrico y uno es una síntesis que utiliza monóxido de carbono.
1.1. Oxidación de carbohidratos
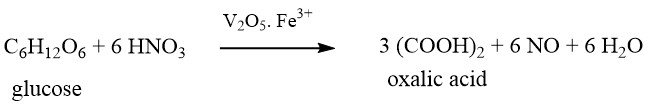
Este método, que es el más antiguo de los procesos químicos, fue descubierto por primera vez por SCHEELE hace más de 200 años, en 1776. Oxidó el azúcar con ácido nítrico concentrado para producir ácido oxálico.
Sin embargo, no fue hasta alrededor de 1940 que este proceso adquirió importancia industrial, cuando los óxidos de nitrógeno producidos en la reacción pudieron recuperarse y reciclarse.
En Alemania, I.G. Farben produjo 2.000 toneladas de ácido oxálico al año utilizando este método hasta 1944. Este proceso se utiliza actualmente en Brasil, China y varios países de Europa del Este.
Las materias primas utilizadas en este proceso incluyen azúcar, glucosa, fructosa, almidón de maíz, almidón de trigo, almidón recuperado, almidón de patata, mazorcas de maíz, tapioca y melaza.
La selección de materiales de partida para la producción de ácido oxálico depende de la disponibilidad, el costo y la optimización del proceso de reacción.
Diferentes materias primas pueden dar lugar a rendimientos variables y a la formación de espuma, grasas y limo, que deben gestionarse adecuadamente.
La melaza y otros desechos agrícolas se han vuelto cada vez más populares como materias primas debido a su bajo costo y los beneficios ambientales de su utilización.
La melaza, que es un subproducto del refinamiento del azúcar, contiene compuestos que contienen nitrógeno que se eliminan en su mayoría durante la oxidación del ácido nítrico, a pesar de provocar una formación excesiva de espuma durante la reacción.
En el caso de utilizar materiales a base de almidón como materias primas, primero deben hidrolizarse a glucosa en una etapa por lotes separada antes de la oxidación.
La solución de glucosa hidrolizada se mezcla con ácido sulfúrico, pentóxido de vanadio (0,001-0,05 % en peso) y sulfato de hierro (III) (0,39-0,8 % en peso) en un reactor.
Luego se añade lentamente ácido nítrico (65 %) con agitación vigorosa dentro de un rango de temperatura estrictamente controlado de alrededor de 70 °C, que varía según la materia prima.
La reacción es fuertemente exotérmica y debe enfriarse bien.
Simultáneamente se suministra aire al reactor para favorecer la reacción y eliminar NO y otros óxidos de nitrógeno de bajo número de oxidación. Los óxidos de nitrógeno expulsados se recogen en un sistema de adsorción y se reciclan después de la oxidación.
El ácido oxálico crudo se obtiene enfriando y centrifugando la mezcla de reacción, seguido de disolución en agua caliente, separación de grasa, recristalización, una segunda centrifugación y secado para obtener dihidrato de ácido oxálico con una pureza superior al 99%.
1.2. Oxidación del etilenglicol
La oxidación del etilenglicol con ácido nítrico es un proceso de un solo paso. Se utiliza una mezcla oxidante de 30-40% de ácido sulfúrico y 20-25% de ácido nítrico, y la reacción se lleva a cabo a 50-70°C y presión atmosférica en presencia de pentóxido de vanadio y sales de hierro (III). El subproducto formado durante esta reacción es sólo CO2.
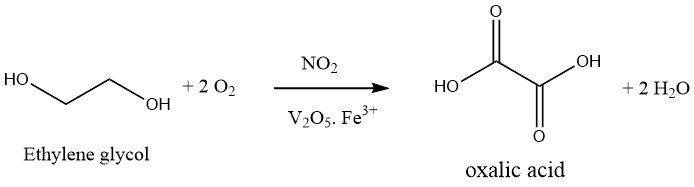
El proceso de producción de ácido oxálico ha sido objeto de importantes mejoras por parte de Mitsubishi Gas Company, lo que ha dado como resultado que Japón recurra principalmente a este método.
La técnica mejorada implica el uso de un reactor a presión que funciona a unos 10 bar. El ácido nítrico (aproximadamente 60%), así como el ácido sulfúrico (cuando corresponda), se someten a oxígeno presurizado, manteniendo una temperatura de 80°C.
A continuación se introduce continuamente etilenglicol y se mantienen la temperatura y la presión de la reacción mediante la adición de oxígeno. Se requiere un enfriamiento eficaz para evitar que la reacción exotérmica supere los 50-70°C.
El rendimiento de producción de ácido oxálico, basado en etilenglicol, oscila entre el 90 y el 94 % del máximo teórico. En particular, la mayor parte del ácido nítrico utilizado puede recuperarse. Esto sugiere que los óxidos de nitrógeno y el ácido nítrico actúan simplemente como catalizadores en el proceso de oxidación, siendo el oxígeno el principal agente oxidante.
También se pueden utilizar materiales de partida alternativos, como propilenglicol, acetaldehído o ácido glicólico. Para mejorar la eficiencia, se recomiendan como promotores compuestos de vanadio (0,001 – 0,1 % en peso). También se pueden emplear iniciadores tales como nitrito de sodio, ácido fórmico o formaldehído.
1.3. Oxidación del propeno
La producción de ácido oxálico mediante la reacción de propeno y ácido nítrico es el segundo proceso industrial más importante después de la oxidación de carbohidratos.
En 1978, este método representó 65.000 t/a de la producción mundial de ácido oxálico. Como materias primas viables para esta reacción sirven subproductos de refinería petroquímica, concretamente propeno puro o fracciones ricas en propeno.
Rhone-Poulenc, una corporación con sede en Francia, mejoró significativamente el proceso mediante la introducción de avances técnicos en ingeniería y construcción manteniendo al mismo tiempo un estricto cumplimiento de las condiciones de reacción.
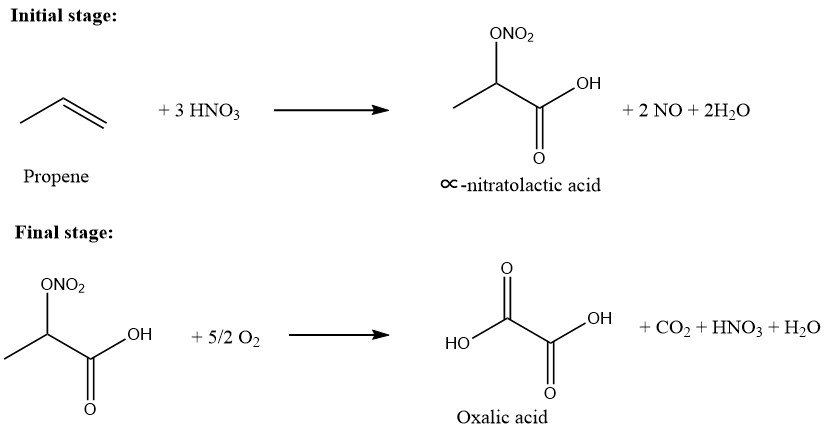
El proceso de oxidación del propeno a ácido oxálico comprende dos etapas principales.
En el paso inicial, se introduce propeno en una solución de ácido nítrico (50-75 % en peso) a un rango de temperatura de 10-40 °C. La relación molar de propeno a ácido nítrico se mantiene entre 0,01/1,0 y 0,5/1,0. Este paso produce intermedios de ácido ∝-nitratoláctico y ácido láctico solubles en agua.
En la segunda etapa, se introduce oxígeno en la solución que contiene los productos parcialmente oxidados en presencia de un catalizador, a un rango de temperatura de 45-100°C.
Posteriormente, el ácido oxálico resultante se cristaliza, se filtra y se recupera. El rendimiento global, basado en propeno, es de aproximadamente el 90% y la conversión de propeno es casi del 100%.
Los óxidos de nitrógeno generados en el segundo reactor son eliminados y recuperados. El consumo de ácido nítrico en este proceso es de 1,2 kg por kg de ácido oxálico dihidrato producido.
Se añaden catalizadores que contienen sales o compuestos de Fe, Al, Cr, Sn, Bi o I para mejorar el rendimiento. En este proceso, se utilizan nitrato de cromo (III), nitrato de hierro (III) o cloruro de estaño (II) en cantidades de 0,4 a 0,5 % en peso (basado en el metal) y se disuelven en ácido nítrico al 65 % para mejorar la eficiencia.
1.4. Producción a partir de monóxido de carbono
Ube Industries ha desarrollado el más reciente proceso para la producción industrial de ácido oxálico, que consta de dos pasos. En la primera etapa, se hacen reaccionar CO y un alcohol inferior bajo presión y en presencia de un catalizador para formar el correspondiente diéster de ácido oxálico.
En el segundo paso, la hidrólisis de este diéster da como resultado la formación de ácido oxálico y el alcohol original, que se recicla. La reacción está catalizada por paladio sobre carbón y nitritos de alquilo y se lleva a cabo a una presión de 10-11 MPa. El alcohol y disolvente preferido es el n-butanol.
Si bien este proceso se beneficia del uso de materiales de partida económicos, tiene importantes inconvenientes debido a la inversión de capital mucho mayor (debido a los requisitos de alta presión) y los costos de servicios públicos.
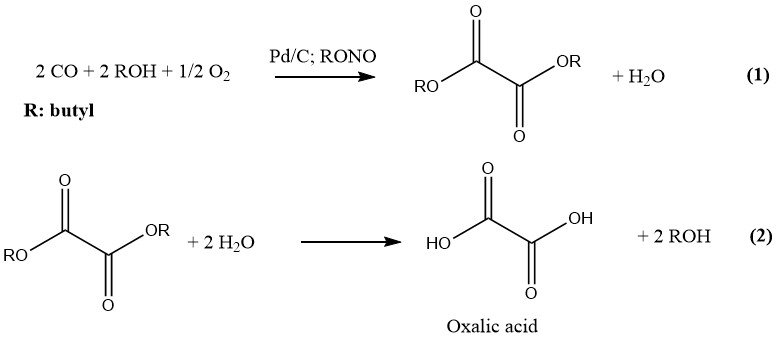
El nitrito de butilo y el nitrito de metilo son los nitritos de alquilo preferidos para fines industriales debido a su idoneidad en la producción de ácido oxálico. Una planta construida en 1978 empleaba nitrito de butilo en la producción de ácido oxálico a razón de 6.000 t/a.
El nitrito de butilo ofrece varias ventajas en este proceso, incluida su función como componente de reacción y agente deshidratante. El punto de ebullición más alto del nitrito de butilo en comparación con el agua y el nitrito de butilo permite la eliminación del agua formada como una mezcla azeotrópica, dejando la mayor parte del nitrito de butilo en el sistema.
El nitrito de butilo recuperado se puede reutilizar después de la separación. El nitrito de butilo finalmente se hidroliza a butanol, que puede separarse fácilmente de la solución de ácido oxálico mediante separación de fases.
La reacción para la producción de ácido oxálico con nitrito de butilo y un catalizador de paladio se lleva a cabo en una torre de reacción. Se presurizan y alimentan a la torre un líquido de circulación que contiene nitrito de butilo, butanol y el catalizador de paladio, así como un gas de circulación que contiene monóxido de carbono y oxígeno.
La reacción exotérmica entre el nitrito de butilo y el monóxido de carbono da como resultado la formación de oxalato de dibutilo y la regeneración simultánea del nitrito de butilo. La reacción se lleva a cabo a una temperatura de 90 – 100 °C y una presión de 10 –11 MPa para optimizar la selectividad por el oxalato de dibutilo.
La concentración de oxígeno en la torre de reacción se mantiene por debajo del límite de explosión mediante la circulación de gas, lo que también mejora la utilización del monóxido de carbono y la tasa de contacto gas-líquido.
La solución liberada de la torre se evapora instantáneamente para evaporar el gas dióxido de carbono formado como subproducto. El agua formada durante la reacción se elimina mediante destilación azeotrópica con nitrito de butilo y la mayor parte de la solución se recicla a la torre de reacción.
Parte de la solución se procesa adicionalmente para producir oxalato de dibutilo puro, que se obtiene después de la separación de catalizadores, nitrito de butilo y butanol.
El catalizador de paladio, el nitrito de butilo y el butanol se recuperan y se devuelven al líquido de circulación, al que también se le suministra butanol y ácido nítrico de reposición. Luego, el líquido en circulación se presuriza y se devuelve a la torre de reacción.
El oxalato de dibutilo refinado se mezcla con las aguas madre de la cristalización del ácido oxálico y se hidroliza a aproximadamente 80 °C en ácido oxálico y butanol.
La solución de ácido oxálico y el butanol se separan mediante separación de fases. Luego se cristaliza el dihidrato de ácido oxálico a partir de la solución de ácido oxálico y el butanol se recicla al proceso después del refinado.
2. Reacciones químicas del ácido oxálico
El comportamiento del ácido oxálico es único debido a la interacción entre grupos carboxilato vecinos, lo que resulta en una mayor constante de disociación y facilidad de descarboxilación.
Tras un calentamiento rápido a 100°C, el ácido oxálico se descompone en monóxido de carbono, dióxido de carbono y agua, con ácido fórmico como intermediario aislable.
La descomposición del ácido oxálico en soluciones acuosas puede ser inducida por la luz y, en mayor medida, por rayos γ o X, dando como resultado monóxido de carbono, dióxido de carbono, ácido fórmico y ocasionalmente hidrógeno. Las sales de metales pesados, como las sales de uranilo, catalizan esta descomposición.
El ácido oxálico no puede formar un anhídrido intramolecular, pero puede descomponerse en monóxido de carbono, dióxido de carbono y agua al calentarlo a más de 190 °C o en ácido sulfúrico o fosfórico concentrado. Esta descomposición no es exotérmica.
Las propiedades reductoras del ácido oxálico forman la base de sus aplicaciones prácticas, ya que puede oxidarse fácilmente hasta obtener productos finales inofensivos, dióxido de carbono y agua, mediante una variedad de agentes oxidantes, incluido el aire y las sales de metales pesados.
El ácido oxálico se esterifica fácilmente, produciendo monoésteres ácidos o diésteres neutros como intermedios en la síntesis química. Estos ésteres reaccionan fácilmente con agua, amoníaco o aminas para producir los correspondientes derivados acilo.
Las sales metálicas del ácido oxálico también demuestran características químicas importantes, existiendo como sales ácidas o neutras. Las sales de metales alcalinos y de hierro (III) son fácilmente solubles en agua, mientras que todas las demás sales son poco solubles.
La casi completa insolubilidad de las sales alcalinotérreas, especialmente el oxalato de calcio, encuentra aplicaciones en el análisis cuantitativo. Cuando se calientan, estas sales metálicas pierden monóxido de carbono y algunas sales más fáciles de descomponer también pierden dióxido de carbono. En estas condiciones, las sales alcalinas y alcalinotérreas forman carbonatos.
Las sales metálicas de manganeso, zinc y estaño forman óxidos, mientras que las sales de hierro, cadmio, mercurio y cobre forman mezclas de óxidos y metales. Las sales de níquel, cobalto y plata producen metales puros. La fusión anhidra de oxalatos con álcali produce carbonatos e hidrógeno.
3. Usos del ácido oxálico
En cuanto a sus aplicaciones como intermediario sintético, el ácido oxálico o sus sales también se han utilizado principalmente como agentes reductores, que producen productos finales inofensivos de dióxido de carbono y agua, así como precipitantes para iones de calcio, o como agentes complejantes para las sales. de metales pesados.
3.1 Tratamiento de metales
Los metales pesados, particularmente el hierro, forman sales dobles solubles con oxalatos de sodio, potasio o amonio.
El oxalato de hierro (III) es la única sal de metal pesado fácilmente soluble. Por lo tanto, las sales de ácido oxálico se emplean para eliminar el óxido de sistemas de refrigeración (como radiadores de automóviles), calderas o placas de acero antes del fosfatado.
También se pueden utilizar para eliminar vetas de hierro del mármol, como componente de limpiadores de metales con protección contra la oxidación, en particular para cobre, plata o aluminio, en el anodizado de aluminio y en la creación de productos muy duros que protegen contra la abrasión y la corrosión. Recubrimientos, donde el uso de aditivos imparte diferentes colores de superficie al aluminio.
El ácido oxálico también se emplea en materiales de limpieza para dispositivos electrónicos y como recubrimientos para proteger acero inoxidable, aleaciones de níquel, cromo, aceros aleados y titanio.
3.2 Tratamiento Textil
El ácido oxálico se utiliza como mordiente en el estampado y teñido de lana y algodón. Se utiliza como agente decapante de colores de lana para lograr efectos de patrones especiales, como auxiliar en la impresión por descarga cáustica de índigo y en el teñido en tina como agente reductor para dicromato de potasio.
En las lavanderías, el ácido oxálico se utiliza para eliminar las manchas de óxido y neutralizar la alcalinidad, además tiene propiedades antibacterianas.
El ácido oxálico se puede emplear como catalizador para la reticulación de agentes de acabado textil en el prensado permanente de tejidos de celulosa y para protección contra llamas.
3.3 Agentes blanqueadores
El ácido oxálico se utiliza en el curtido y blanqueo del cuero, así como en el blanqueo de corcho, madera (especialmente madera enchapada), paja, caña, plumas y ceras naturales y sintéticas.
La mayor parte del ácido oxálico se emplea para blanquear la madera para pasta.
En el procesamiento del cuero, se utiliza ácido oxálico para blanquear en lugar de ditionito de sodio.
Referencia
- Oxalic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a18_247.pub2
