Ácido maleico: propiedades, reacciones, producción y usos
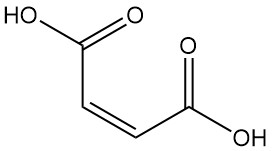
¿Qué es el ácido maleico?
El ácido maleico, también conocido como ácido cis-butenedioico, es un ácido dicarboxílico con la fórmula C4H4O4. Se presenta como un sólido cristalino incoloro con un ligero olor.
El ácido maleico no se encuentra en la naturaleza y se sintetizó por primera vez en 1834 calentando ácido málico. El ácido maleico adquirió importancia industrial después de que comenzara la producción comercial en 1919 a través de la oxidación catalítica en fase gaseosa del benceno.
El ácido maleico y su anhídrido estuvieron disponibles comercialmente en 1928 y 1933, respectivamente. El ácido maleico tiene aplicaciones industriales limitadas por sí solo, pero se utiliza como precursor de resinas de maleinato y copoliésteres.
Tabla de contenido
1. Propiedades físicas del ácido maleico
El ácido maleico forma cristales prismáticos monoclínicos cuando se cristaliza. Es muy soluble en agua y etanol, soluble en acetona y ácido acético glacial, ligeramente soluble en éter e insoluble en benceno.
La Tabla 1 resume las propiedades físicas del ácido maleico.
| Propiedad | Valor |
|---|---|
| Número CAS | [110-16-7] |
| Fórmula química | C4H4O4 |
| Peso molecular | 116,07 g/mol |
| Punto de fusión | 130,5 °C |
| Densidad | 1,590 g/cm3 |
| pKa1 a 25 °C | 1,94 |
| pKa2 a 25 °C | 6,23 |
| Calor de formación | -788,3 kJ/mol |
| Calor de combustión | -1358,9 kJ/mol |
| Solubilidad en agua |
|
| Punto de inflamación | 127 °C |
2. Reacciones del ácido maleico
El ácido maleico presenta una alta reactividad debido a la presencia de grupos carboxilo y un doble enlace. Por encima de los 100 °C, se deshidrata eliminando agua para formar anhídrido maleico. Un calentamiento posterior, especialmente con catalizadores, promueve la descarboxilación para producir ácido acrílico.
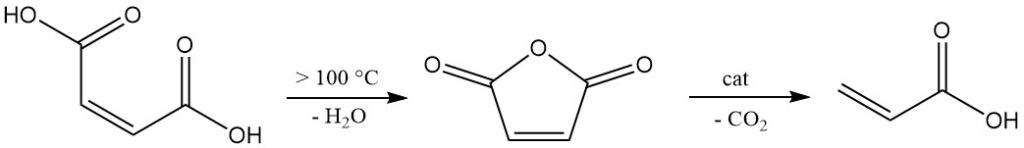
El ácido maleico participa en reacciones típicas de los ácidos carboxílicos, como la esterificación y la amidación, pero es incapaz de formar cloruro de ácido.
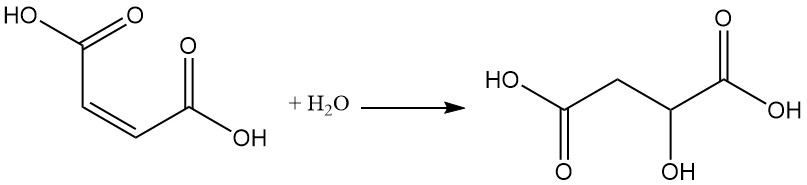
La presencia del doble enlace permite diversas reacciones, como la adición de agua a temperatura y presión elevadas, lo que da como resultado la formación de ácido málico.
La reacción del ácido maleico con el ozono produce ácido glioxílico.
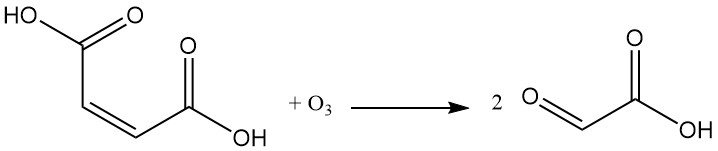
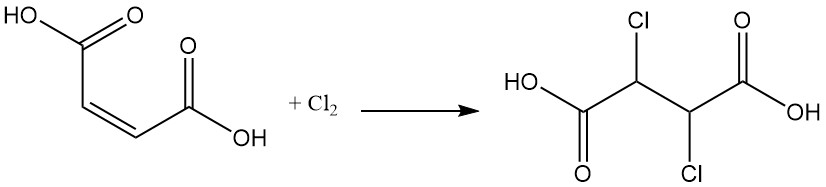
La adición de halógeno forma compuestos de ácido dihalogenosuccínico; por ejemplo, la adición de dicloro al ácido maleico produce ácido diclorosuccínico.
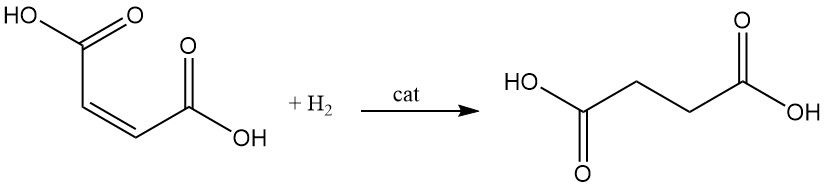
La hidrogenación catalítica del doble enlace del ácido maleico conduce a la formación de ácido succínico.
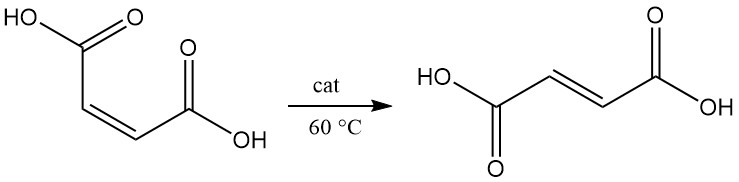
La isomerización del ácido maleico a ácido fumárico se produce lentamente, incluso a 100 °C. En presencia de un catalizador, la conversión se produce de forma casi cuantitativa, incluso a 60 °C.
3. Producción de ácido maleico
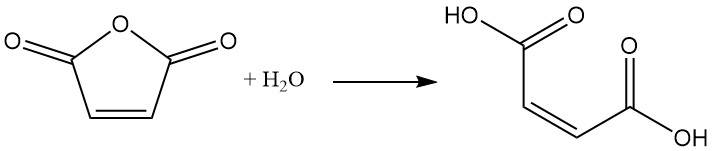
El método más común para la producción de ácido maleico es la hidratación controlada del anhídrido maleico con una pequeña cantidad de agua. Después de que la mezcla de reacción se enfría, el producto, el ácido maleico, precipita en forma de sólido.
El líquido sobrenadante (licor madre) se separa a continuación. El ácido maleico sólido se seca al vacío.
El licor madre se puede diluir y reciclar de nuevo a la etapa de hidratación para una mayor producción de ácido maleico o dirigirse a la unidad de deshidratación para la producción de anhídrido maleico, eliminando la necesidad de un tratamiento de efluente por separado. Sin embargo, este método requiere un equipo de acero resistente a la corrosión debido a las duras condiciones.
Como alternativa, el ácido maleico se puede obtener directamente del agua de lavado generada durante la producción de anhídrido maleico. Este proceso ahorra la energía necesaria para la deshidratación a la forma de anhídrido. Sin embargo, necesita la purificación y concentración del agua de lavado.
El agua de lavado debe tratarse con carbón activado para eliminar las impurezas. A continuación, se desecha el carbón usado. La solución purificada debe concentrarse al vacío porque las temperaturas elevadas promueven la formación de ácido fumárico y el equipo de acero al cromo-níquel utilizado en este proceso se corroe por encima de los 80 °C.
Las corrientes de agua de lavado enriquecidas provenientes de procesos de oxidación, como el o-xileno y el naftaleno utilizados en la producción de anhídrido ftálico, también se pueden utilizar como materia prima para la producción de ácido maleico, junto con el ácido fumárico y el anhídrido maleico.
4. Usos del ácido maleico

El ácido maleico es un componente importante en la producción de poliéster que se utiliza para molduras laminadas reforzadas con fibra y vehículos de pintura.
Se utiliza como materia prima para la síntesis de muchos otros productos químicos.
El ácido maleico se puede convertir en ácido fumárico, otro producto químico industrial valioso.
Debido a sus propiedades ácidas, se puede utilizar como regulador de la acidez en ciertos alimentos y bebidas.
Mejora la adhesión entre diversos materiales, como metales revestidos de zinc (acero galvanizado) y nailon, utilizados con adhesivos a base de metacrilato de metilo.
El ácido maleico se aplica en procesos de teñido y acabado de fibras naturales.
La forma ionizada (ion maleato) actúa como inhibidor de las reacciones de las transaminasas en la investigación bioquímica.
El ácido maleico se utiliza como agente tampón, agente espumante y regulador del pH en productos de limpieza y aplicaciones de cuidado del hogar.
5. Toxicología del ácido maleico
La principal preocupación toxicológica del ácido maleico es su efecto irritante y corrosivo local sobre la piel, las mucosas y los ojos. Los estudios muestran que una solución acuosa al 20% puede causar irritación leve y reversible de la piel en humanos, mientras que concentraciones más bajas (<5%) pueden irritar significativamente los ojos.
Los experimentos con animales confirman esta acción irritante local como la característica toxicológica más destacada.
El ácido maleico muestra una toxicidad oral y dérmica aguda moderada. Los valores de LD50 informados son:
- 708 mg/kg (rata, oral)
- 2400 mg/kg (ratón, oral)
- 1560 mg/kg (conejo, dérmica)
- >1000 mg/kg (conejillo de indias, dérmica)
El daño renal es un posible efecto tóxico sistémico del ácido maleico. Se observaron cambios morfológicos y funcionales en los riñones de ratas y perros tras la inyección intraperitoneal y la exposición por inhalación.
Este daño se asemeja al síndrome de Fanconi, posiblemente causado por la interacción del ácido maleico con el glutatión en las células renales, lo que conduce a la formación de radicales libres y peróxido. Además, el ácido maleico parece afectar los mecanismos de transporte de iones de sodio e hidrógeno.
Los estudios de exposición crónica en ratas macho (250–750 mg/kg/día durante hasta dos años) mostraron un aumento de la mortalidad, daño renal y retraso del crecimiento en todos los grupos de dosis. También se observaron daños hepáticos y testiculares en el grupo de dosis más alta.
No se evidenció carcinogenicidad ni genotoxicidad en estos estudios, aunque no fueron diseñados específicamente para este propósito.
Referencias
- Maleic and Fumaric Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_053
- https://pubchem.ncbi.nlm.nih.gov/compound/Maleic-Acid
