ácido glicólico: producción, reacciones y usos

El ácido glicólico sólido es el ácido α-hidroxicarboxílico más simple. Forma cristales prismáticos, monoclínicos, incoloros. Este ácido exhibe una alta solubilidad en varios disolventes, incluidos agua, metanol, etanol, acetona y acetato de etilo.
La volatilidad del ácido glicólico es limitada, con una tendencia mínima a evaporarse cuando se expone al calor. En consecuencia, no se puede destilar eficazmente en condiciones de vacío.
Los esfuerzos para destilarlo a menudo resultan en una autoesterificación, acompañada de pérdida de agua, lo que lleva a la formación de diglicólidos y poliglicólidos.
Tabla de contenido
Propiedades físicas del ácido glicólico
En forma pura, el ácido glicólico es cristalizable y no puede destilarse sin descomponerse, ni siquiera al vacío.
Las propiedades físicas son las siguientes:
- Masa molar = 76 g/mol
- punto de fusión = 78-80 °C
- punto de ebullición = 100 °C (descomponerse)
- Densidad a 25 °C = 1,49
- Índice de refracción (20 °C) = 1,423
- pKa = 3,81 a 25 °C
Reacciones químicas del ácido glicólico
El ácido glicólico exhibe la capacidad de sufrir dimerización mediante la eliminación de agua, lo que resulta en la formación de un diéster cíclico conocido como 1,4-dioxano-2,5-diona. Estos diésteres se conocen comúnmente como lactidas debido a su descubrimiento inicial durante estudios con ácido láctico.

La polimerización del ácido glicólico mediante policondensación da poliglicólido o poli(ácido glicólico) (PGA), que es un polímero biodegradable y termoplástico. Este tipo de esterificación, conocida como formación de estolida, no se limita a los ácidos α-hidroxicarboxílicos.

Otra característica importante del ácido glicólico es que la proximidad de sus dos grupos funcionales debilita los enlaces C-C intermedios. En consecuencia, el tratamiento de dichos compuestos con ácido sulfúrico conduce a la eliminación del ácido fórmico. Tras la exposición al ácido sulfúrico concentrado, el ácido fórmico se descompone y produce monóxido de carbono y agua.
Esta reacción de eliminación se produce con alta eficiencia, lo que la convierte en una herramienta valiosa para la determinación cuantitativa de ácido glicólico.
La escisión oxidativa también es factible para el ácido glicólico. Por ejemplo, cuando se trata con peróxido de hidrógeno en presencia de iones de hierro (II), el ácido glicólico sufre fácilmente eliminación de dióxido de carbono.
El ácido glicólico se puede deshidrogenar catalíticamente a ácido glioxílico en fase de vapor.
Cuando el ácido glicólico reacciona con PCl3, forma cloruro de cloroacetilo (ClCH2COCl).
Producción de ácido glicólico
El ácido glicólico se sintetiza comúnmente mediante la hidrólisis de ácido monocloroacético fundido utilizando una solución acuosa al 50% de hidróxido de sodio a temperaturas que oscilan entre 90 y 130 °C.
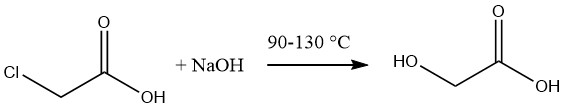
La solución resultante de ácido glicólico tiene una concentración aproximada del 60%, acompañada de un contenido de cloruro de sodio del 12-14%. La eliminación de la sal se puede lograr mediante evaporación seguida de extracción del ácido con acetona.
Se han explorado enfoques alternativos en los que la hidrólisis se realiza con catalizadores ácidos a temperaturas más altas de 150-200 °C, empleando agua o vapor a presión.
En este proceso se forma cloruro de hidrógeno como subproducto en lugar de cloruro de sodio, que puede separarse mediante destilación. Sin embargo, este método requiere la utilización de cantidades sustanciales de agua, lo que plantea un inconveniente importante.
En Estados Unidos, la producción comercial de ácido glicólico (de Du Pont) implica el tratamiento de formaldehído o trioximetileno con monóxido de carbono y agua en presencia de catalizadores ácidos a presiones superiores a 30 MPa.

Otro método, empleado anteriormente por Degussa, consiste en la reducción electrolítica del ácido oxálico.
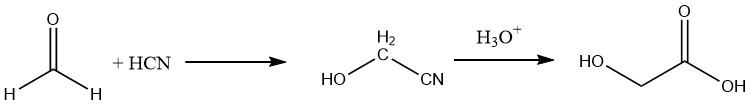
Además, el ácido glicólico se puede preparar con un rendimiento de aproximadamente el 90% hidrolizando el nitrilo correspondiente, que se obtiene haciendo reaccionar formaldehído con ácido cianhídrico.
Un estudio reciente muestra que el ácido glicólico se puede producir mediante un proceso de oxidación selectiva de etilenglicol (EG) utilizando nanocatalizadores bimetálicos de PtMn/MCM-41 altamente eficientes.
Usos del ácido glicólico
El ácido glicólico está disponible comercialmente en forma de soluciones acuosas, con concentraciones del 57% (Hoechst) o del 70% (Du Pont). El consumo anual global de estas soluciones es de aproximadamente 2000-3000 toneladas.
En diversas industrias, el ácido glicólico encuentra aplicación en el teñido, estampado y antiarrugas de textiles. Su capacidad para formar quelatos con iones calcio (II) lo hace particularmente adecuado para enmascarar el desencalado en la industria del cuero. También se utiliza en mordientes de alumbre y cromo, así como en operaciones de procesamiento de pieles.
Debido a su naturaleza poco corrosiva y sus propiedades bactericidas, el ácido glicólico se incorpora comúnmente a los agentes de limpieza ácidos. Es especialmente eficaz para limpiar recipientes de leche, equipos de procesamiento de leche, bebederos y para eliminar óxido y sarro en intercambiadores de calor y tuberías.
El ácido glicólico exhibe efectos inhibidores sobre el crecimiento de bacterias oxidantes del hierro. Su uso elimina la necesidad de la adición simultánea de agentes quelantes y bactericidas.
Las propiedades complejantes del ácido glicólico también lo hacen adecuado para aplicaciones como pulimentos de cobre, agente de grabado para placas litográficas y en la formulación de baños de electropulido y galvanizado.
Derivados del ácido glicólico
El glicolato de metilo y el glicolato de etilo son dos ésteres de ácido glicólico comúnmente utilizados como materiales de partida para la síntesis de laboratorio de ácido glicólico puro. Antiguamente también se utilizaban como disolventes para resinas y nitro o acetilcelulosa. Aparte de estos ésteres, sólo la carboximetilcelulosa y el n-butilglicolato tienen importancia comercial.
Glicolato de n-butilo
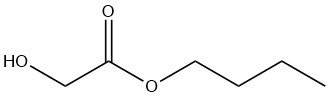
El glicolato de n-butilo es un líquido incoloro que es miscible con la mayoría de los disolventes orgánicos. Su solubilidad en agua está limitada al 8% en peso a 20 °C, aunque el propio compuesto puede contener hasta un 25% en peso de agua.
Producción de n-butilglicolato
La producción de n-butilglicolato implica el tratamiento de cloroacetato de sodio con alcohol n-butílico a temperaturas que oscilan entre 125 y 160 °C, seguido de una destilación al vacío.
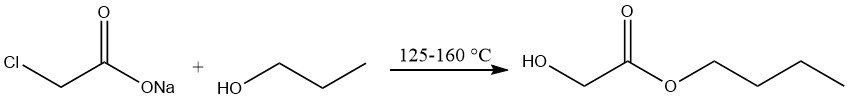
Usos del glicolato de n-butilo
El glicolato de n-butilo encuentra su aplicación principal como aditivo en barnices, valorado por su baja volatilidad. Algunos nombres comerciales de n-butilglicolato incluyen Polysolvan-O (Hoechst) y GB-Ester (Wacker).
Confiere propiedades de extensión suave y alto brillo a los barnices de nitrocelulosa. En el caso de la acetilcelulosa, actúa eficazmente como inhibidor del rubor en condiciones de alta humedad.
Debido a sus favorables propiedades de mezcla, el glicolato de n-butilo también se utiliza como aditivo en resinas alquídicas y pinturas a base de aceite.
El glicolato de n-butilo no se considera peligroso.
Referencias
- Hydroxycarboxylic Acids, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_507
- Process for manufacture of glycolic acid. – https://patents.google.com/patent/US2152852A/en
- Glycolic Acid Production from Ethylene Glycol. – https://pubs.acs.org/doi/10.1021/acssuschemeng.1c03717
