Triethylamin: Eigenschaften, Herstellung und Verwendung
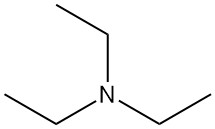
Triethylamin (TEA) ist tertiäres Amin, dargestellt durch die chemische Formel N(CH2CH3)3. Es handelt sich um eine farblose, leicht entzündliche Flüssigkeit mit ammoniakartigem Geruch. Es ist eine der am häufigsten verwendeten organischen Aminbasen in der synthetischen organischen Chemie.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Triethylamin
Triethylamin ist eine farblose, unangenehm riechende und brennbare Flüssigkeit. Wichtige physikalische Eigenschaften sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| CAS-Registrierungsnummer | [121-44-8] |
| Chemische Formel | (C2H5)3N |
| Farbe | Farblos |
| Physischer Zustand | Flüssigkeit |
| Molekulargewicht (Mr) | 101,19 |
| Schmelzpunkt (Schmelzpunkt), °C | -115 |
| Siedepunkt (Siedepunkt), °C | 89,3 |
| Dichte (d) bei 20 °C | 0,7275 |
| Brechungsindex (n) bei 20 °C | 1.4010 |
| Flammpunkt, °C | -11 |
| pKb (25 °C) | 3.24 |
| Dissoziationskonstante (pKa) | 10,76 |
| Geruchsschwelle, ppm; v/v | 0,48 |
| Löslichkeit in Wasser | Mit Wasser mischbar (112 g/L bei 20 °C) |
| Löslichkeit in organischen Lösungsmitteln | Mischbar mit Ethanol und Ethylether |
| Dampfdruckdichte | 3,48 |
| Dampfdruck bei 20 °C, Torr | 54 |
| Automatische Entflammbarkeit (°C) | 215 |
2. Chemische Reaktionen von Triethylamin
Triethylamin stellt ein hohes Brand- und Sicherheitsrisiko dar, wenn es Hitze, Flammen oder Oxidationsmitteln ausgesetzt wird, und wird in Dampfform explosiv.
Unverdünntes Triethylamin im Komplex mit Distickstofftetraoxid kann sich unter 0 °C explosionsartig zersetzen.
Triethylamin reagiert exotherm mit Maleinsäureanhydrid über 150 °C, wodurch Hitze entsteht und möglicherweise Brandgefahr besteht. Bei der Zersetzung durch Hitze entstehen giftige Stickoxiddämpfe (NOx).
Die Hauptreaktionen von Triethylamin sind:
1. Salzbildung mit Säuren
Aufgrund seiner Alkylsubstituenten ist Triethylamin eine stärkere Base als Ammoniak und bildet mit organischen und anorganischen Säuren gut wasserlösliche Salze. Der Unterschied in der Löslichkeit zwischen Triethylamin und seinem Salz macht es zu einem guten Säureakzeptor und Lösungsmittel für die Gaswäsche und für bestimmte Extraktionsprozesse wie die Herstellung von halbsynthetischem Penicillin.
Außerdem fungiert es als starker Protonenakzeptor bei verschiedenen Reaktionen, einschließlich Oxidationen, Reduktionen, Eliminierungen, Substitutionen und Additionen. Die resultierenden quartären Salze lassen sich nach Fertigstellung leicht entfernen.
2. Alkylierung
Die Reaktion von Triethylamin mit Alkylhalogeniden und Dialkylsulfaten zu letztlich quartären Ammoniumverbindungen wird in der präparativen pharmazeutischen Chemie sowie zur Herstellung von Korrosionsschutzmitteln und Bioziden eingesetzt.
3. Oxidation
Triethylamin wird durch Wasserstoffperoxid zu Triethylaminoxid oxidiert.

3. Herstellung von Triethylamin
Triethylamin wird durch Reaktion von Ammoniak mit Ethanol, N,N-Diethylacetamid mit Lithiumaluminiumhydrid, Ethylchlorid mit Ammoniak unter Hitze und Druck hergestellt. und katalytische Gasphasenhydrierung von Acetonitril.
1. Ammoniak und Ethanol

Die gebräuchlichste Methode ist die Reaktion von Ammoniak (NH3) mit Ethanol (CH3CH2OH) bei hohen Temperaturen und Drücken über einem Dehydratisierungs- oder Dehydrierungskatalysator. Katalysatoren wie Aluminiumoxid, Siliciumdioxid-Aluminiumoxid oder Silber fördern effektiv die Reaktion und ergeben eine Mischung aus Ethylamin, Diethylamin und Triethylamin.
Anschließende Trennungen durch Extraktionen und Destillationen isolieren Triethylamin mit hoher Reinheit. Diese Methode bietet hohe Ausbeuten, erfordert jedoch einen sorgfältigen Umgang mit flüchtigen Zwischenprodukten und energieintensiven Reaktionsbedingungen.
Mischungen aus Mono-, Di- und Triethylamin können auch aus Acetaldehyd, Ammoniak und Wasserstoff in Gegenwart eines Hydrierungskatalysators.

a) Verdampfer; b) Wärmetauscher; c) Überhitzer; d) Katalysator; e) Produktkühler; f) Gasabscheider; g) Ammoniaksäule; h) Monoethylamin-Säule; i) Diethylamin-Säule; j) Dekanter; k) Triethylamin-Säule
2. N,N-Diethylacetamid und Lithiumaluminiumhydrid

Eine spezielle Route verwendet N,N-Diethylacetamid (CH3CH2CON(CH2CH3)2) als Substrat. Durch Reduktion mit Lithiumaluminiumhydrid (LiAlH4) entsteht direkt Triethylamin. Diese Methode vermeidet die komplexe Mischung von Aminprodukten, erfordert jedoch aufgrund der pyrophoren Natur von LiAlH4 spezielle Reagenzien und spezifische Sicherheitsprotokolle.
3. Ethylchlorid und Ammoniak

Unter hoher Temperatur und hohem Druck kann Ethylchlorid (CH3CH2Cl) mit Ammoniak reagieren Es entsteht Triethylamin. Dieser Prozess erfordert jedoch typischerweise zusätzliche Reinigungsschritte, um Nebenprodukte (HCl) und restliche Reaktanten zu entfernen.
4. Gasphasenkatalytische Hydrierung von Acetonitril

Triethylamin kann kontinuierlich durch Hydrierung von Acetonitril in der Gasphase hergestellt werden, wobei ein Edelmetall der Gruppe VIII des Periodensystems (z. B. Platin, Palladium) als Katalysator verwendet wird.
Zur Verbesserung der Katalysatorleistung wird ein Lithium-Aluminium-Spinell-Träger verwendet. Diese Reaktion wird bei einer Temperatur von 80 °C bis 115 °C und einem Druck von 1 bis 60 bar (relativer Druck) durchgeführt.
Bezogen auf Acetonitril werden bis zu 3 Gew.-% Monoethylamin und/oder Diethylamin zugesetzt. Diese wirken als Promotoren und können möglicherweise die Reaktionsgeschwindigkeit oder Selektivität verbessern.
4. Verwendung von Triethylamin
Triethylamin (TEA) wird überwiegend als Katalysator bei der Aushärtung von Harzsystemen in Gießereiformen verwendet, insbesondere bei der Herstellung von Sandkernen für Cold-Box- oder Isocure-Verfahren. TEA wird zu einem Gas verdampft und in das System eingeleitet.
Abgesehen von seiner Rolle in Gießereianwendungen findet TEA umfangreiche Verwendung als Härtungskatalysator in Phenol-Formaldehyd-Spanplattenklebstoffen, wobei der jährliche Verbrauch in den USA etwa 5 Millionen Pfund beträgt.
Darüber hinaus wird es bei der Reinigung von Penicillin- und Cephalosporin-Antibiotika und im Grenzflächenpolymerisationsprozess zur Herstellung von Polycarbonatharzen verwendet.
Triethylamin wird auch als HCl-Fänger in Reaktionen eingesetzt, beispielsweise bei der Herstellung von Benzylphthalaten, wobei der Schwerpunkt auf der Rückgewinnung und dem Recycling liegt.
TEA dient als Bestandteil von Versiegelungsfarben (0,5 % w/w), bei der Herstellung von Papier- und Kartonklebstoffen und als Stabilisator für chlorierte Lösungsmittel wie Perchlorethylen und Trichlorethylen.
Es wirkt als Katalysator bei der Bildung von Urethanschäumen und Epoxidharzen und beteiligt sich an Dehydrohalogenierungsreaktionen und Säureneutralisierung für Kondensationsreaktionen. TEA findet auch Anwendung in der Umkehrphasen-Hochleistungsflüssigkeitschromatographie (HPLC) als Modifikator für die mobile Phase.
In bestimmten Branchen wird TEA als Neutralisationsmittel für anionisch stabilisierte wasserbasierte Harze eingesetzt, darunter Polyester, Alkyde, Acrylharze und Polyurethane, die Carboxyl- oder andere saure Gruppen enthalten.
Weitere Verwendungsmöglichkeiten von Triethylamin sind die Verwendung als Beschleunigeraktivator für Gummi, als Korrosionsinhibitor, als Treibmittel, als Emulgator für Farbstoffe, als Bestandteil von fotografischen Entwicklungsbeschleunigern, zum Trocknen von Druckfarben, in Teppichreinigern und in der Produktion von Herbiziden und Pestiziden sowie bei der Herstellung von Emulgatoren für Pestizide.
5. Toxikologie von Triethylamin
1. Akute Toxizität
- Einatmen: Freiwillige, die Triethylamindämpfen ausgesetzt waren, erlebten Sehstörungen und Veränderungen der Gehirnaktivität. Berufliche Exposition wurde auch mit Augen- und Atemwegserkrankungen in Verbindung gebracht. Tierstudien zeigen schwere Toxizität und Mortalität nach Inhalation hoher Dosen, wobei die LD50-Werte bei Ratten zwischen 420 und 10.000 mg/m³ liegen.
- Verschlucken: Die orale Exposition bei Tieren führte zu einer dosisabhängigen Toxizität, wobei die LD50-Werte bei Nagetieren zwischen 450 und 1000 mg/kg lagen. Beim Menschen wird aufgenommenes Triethylamin hauptsächlich unverändert ausgeschieden, wobei ein geringer Teil zu Triethylaminoxid und Diethylamin verstoffwechselt wird.
- Dermal: Triethylamin führt bei Tieren zu erheblichen Hautreizungen, wobei die LD50-Werte bei Kaninchen bei etwa 0,5–0,794 ml/kg liegen.
2. Chronische Toxizität
- Einatmen: Eine langfristige Exposition (Monate) gegenüber mäßigen Triethylaminkonzentrationen bei Ratten verursachte Lungen-, Gehirn- und Leberveränderungen. Bei höheren Expositionsniveaus wurden Veränderungen des Nervensystems, Anämie und chronische Lungenentzündung beobachtet.
- Oral: Bei Ratten, denen Triethylamin 2 Monate lang oral in einer moderaten Dosis verabreicht wurde, wurden keine Nebenwirkungen berichtet. Höhere Dosen führten jedoch zu Verhaltensänderungen und Krämpfen, wobei Frauen eine größere Empfindlichkeit zeigten.
- Genotoxizität: In-vitro- und In-vivo-Studien ergaben widersprüchliche Ergebnisse hinsichtlich der Genotoxizität von Triethylamin. Während einige Tests auf ein mutagenes Potenzial bei Bakterien schließen ließen, zeigten andere keine klastogenen oder aneugenen Wirkungen bei Ratten.
3. Fortpflanzung und Entwicklung
- Reproduktionsstudien: Eine Mehrgenerationenstudie an Ratten ergab keine signifikanten Auswirkungen auf die Fruchtbarkeit oder die Lebensfähigkeit der Nachkommen, obwohl in der dritten Generation eine leichte Verringerung des durchschnittlichen Körpergewichts beobachtet wurde.
- Entwicklungstoxizität: Die Verabreichung von Triethylamin an trächtige Kaninchen störte die frühe Embryonalentwicklung.
4. Humanepidemiologie
- Eine Studie in einer dänischen Gießerei brachte einen Zusammenhang zwischen berufsbedingter Triethylamin-Exposition und einem erhöhten Risiko für die Sterblichkeit durch Blasenkrebs.
- Sensibilisierung: Tierstudien deuten auf ein geringes Potenzial für eine Sensibilisierung der Haut oder der Atemwege gegenüber Triethylamin hin.
5. Andere Beobachtungen
- Triethylamin hemmt die Monoaminoxidase (MAO)- und Sulfotransferase-Aktivität in tierischen Geweben und beeinflusst möglicherweise den Neurotransmitter- und Steroidstoffwechsel.
- In-vitro-Studien deuten darauf hin, dass Triethylamin mit dem Abbau und der Synthese von Zellproteinen interagiert und eine lysosomale Schwellung auslösen kann.
Verweise
- Amines, Aliphatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_001.pub2
- Process for the preparation of triethylamine. – https://patents.google.com/patent/US4297512A/en
- Triethylamine; Review of Toxicological Literature
- Triethylamine. – https://onlinelibrary.wiley.com/doi/10.1002/3527600418.mb12144e0013
- Triethylamine anhydrous(BASF). – https://products.basf.com/global/en/ci/triethylamine-anhydrous.html
