Methanol: Herstellung, Reaktionen und Verwendungen
Methanol, auch Holzalkohol genannt, ist eine chemische Verbindung mit der Formel CH3OH. Es ist eine farblose, brennbare Flüssigkeit mit einem charakteristischen alkoholischen Geruch. Methanol ist der einfachste Alkohol und industriell der wichtigste Alkohol.
Methanol ist ein wichtiger chemischer Rohstoff, der bei der Herstellung einer breiten Palette von Produkten verwendet wird, darunter Kunststoffe, Farben und Arzneimittel. Es wird auch als Treibstoff und Energiequelle genutzt.
Methanol wurde erstmals im 17. Jahrhundert isoliert, doch erst zu Beginn des 20. Jahrhunderts begann die kommerzielle Produktion. Heutzutage wird Methanol mit verschiedenen Verfahren hergestellt. Die gebräuchlichste Methode ist jedoch die Reaktion von Kohlenmonoxid und Wasserstoff in Gegenwart eines Kupferoxidkatalysators.
Methanol ist ein äußerst vielseitiges Molekül und kann durch verschiedene chemische Reaktionen in eine Vielzahl anderer Chemikalien umgewandelt werden. Beispielsweise kann Methanol zur Herstellung von Formaldehyd, Essigsäure und Methylmethacrylat verwendet werden.
Methanol wird auch als Kraftstoff und Energiequelle verwendet. Es kann Benzin beigemischt werden, um Emissionen zu reduzieren, und es kann auch in Brennstoffzellen zur Stromerzeugung eingesetzt werden.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Methanol
Methanol ist eine farblose Flüssigkeit mit hoher Polarität und mittlerem Dampfdruck. Es ist ein vielseitiges Lösungsmittel, das eine Vielzahl von Substanzen lösen kann, darunter Wasser, Alkohole und andere organische Lösungsmittel. Es ist bedingt mit Ölen und Fetten mischbar.
Methanol hat die in der folgenden Tabelle aufgeführten physikalischen Eigenschaften:
| Eigenschaft | Wert |
|---|---|
| Physischer Zustand | Flüssigkeit |
| Farbe | Farblos |
| Geruch | Leicht süß, alkoholisch |
| Schmelzpunkt | –97,6 °C (–143,7 °F; 175,6 K) |
| Siedepunkt | 64,7 °C (148,5 °F; 337,8 K) |
| Dichte | 0,792 g/cm³ |
| Löslichkeit in Wasser | Mischbar |
| Dampfdruck | 160 mmHg bei 20 °C (68 °F) |
| Flammpunkt | 11 °C (52 °F) |
| Brennbarkeitsgrenzen | 6,7–36 Vol.-% in Luft |
| Selbstentzündungstemperatur | 455 °C (851 °F) |
2. Chemische Reaktionen von Methanol
Methanol ist der einfachste Alkohol und seine Reaktivität wird durch die Hydroxylgruppe bestimmt. Methanol reagiert durch Spaltung der C-O- oder O-H-Bindung, wobei die Wasserstoff- oder Hydroxylgruppe substituiert werden kann. Im Gegensatz zu höheren Alkoholen kann Methanol nicht durch β-Eliminierung eine Mehrfachbindung bilden.
Zu den wichtigsten industriellen Reaktionen von Methanol gehören:
- Dehydrierung und oxidative Dehydrierung
- Carbonylierung
- Veresterung mit organischen oder anorganischen Säuren und Säurederivaten
- Veretherung
- Zusatz zu ungesättigten Bindungen
- Austausch von Hydroxylgruppen
1. Methanolverbrennung: Methanol kann verbrannt werden. Hierbei handelt es sich um eine chemische Reaktion, bei der Methanol mit Sauerstoffgas (O2) kombiniert wird, um Kohlendioxid (CO2), Wasser (H2O) und Energie zu erzeugen.
2CH3OH + 3O2 → 2CO2 + 4H2O + Energie
Diese Reaktion ist exotherm und erzeugt viel Wärme, was Methanol zu einem nützlichen Brennstoff macht.
2. Veresterung: Methanol kann mit Carbonsäuren unter Bildung von Estern reagieren, bei denen es sich um organische Verbindungen mit einem charakteristischen süßen Geruch handelt. Diese Reaktion wird durch einen Säurekatalysator wie Schwefelsäure oder Salzsäure katalysiert.
RCOOH + CH3OH → RCOOCH3 + H2O
3. Dehydrierung: Methanol kann dehydriert werden. Hierbei handelt es sich um eine chemische Reaktion, bei der Wassermoleküle aus Methanol entfernt werden, um Dimethylether (DME) zu erzeugen. Diese Reaktion wird durch einen Säurekatalysator wie Aluminiumoxid oder Zeolith katalysiert.
2CH3OH → CH3OCH3 + H2O
4. Oxidation: Methanol kann zu Formaldehyd (HCHO) oxidiert werden, einem nützlichen Zwischenprodukt bei der Herstellung verschiedener Chemikalien.
2CH3OH + O2 → 2HCHO + 2H2O
Diese Reaktion wird typischerweise durch einen Metallkatalysator wie Kupfer oder Silber katalysiert.
5. Methylierung: Methanol kann als Quelle für Methylgruppen (-CH3) in verschiedenen chemischen Reaktionen verwendet werden, beispielsweise bei der Methylierung von Phenolen zur Herstellung von Methylphenolen.
C6H5OH + CH3OH → C6H4(OCH3)OH + H2O
3. Herstellung von Methanol
Methanol wird derzeit im industriellen Maßstab durch eine katalytische Niederdruckumwandlung von Synthesegas hergestellt. Dieses Verfahren weist im Vergleich zu anderen Verfahren geringere Investitions- und Produktionskosten, eine verbesserte Betriebssicherheit und eine größere Flexibilität auf.
Die Methanolproduktion kann in drei Hauptschritte unterteilt werden:
- Herstellung von Synthesegas
- Synthese von Methanol
- Verarbeitung von Rohmethanol
3.1. Herstellung von Synthesegas
Synthesegas kann aus einer Vielzahl kohlenstoffhaltiger Materialien hergestellt werden, darunter Kohle, Koks, Erdgas, Erdöl und Erdölfraktionen. Erdgas ist der häufigste Rohstoff für die großtechnische Synthesegasproduktion für die Methanolsynthese.
Die Zusammensetzung des für die Methanolsynthese benötigten Synthesegases wird durch die Stöchiometriezahl S charakterisiert, die wie folgt definiert ist:
S = (H2 – CO2)/(CO + CO2)
Die Stöchiometriezahl sollte für das Synthesegasgemisch mindestens 2,0 betragen. Werte über 2,0 weisen auf einen Wasserstoffüberschuss hin, Werte unter 2,0 auf einen Wasserstoffmangel.
Ein Mangel an Wasserstoff verringert die Selektivität für Methanol, während ein Überschuss an Wasserstoff die Größe des Synthesekreislaufs vergrößert. Daher ist eine Synthesegaszusammensetzung mit einer stöchiometrischen Zahl etwas über 2,0 optimal für die Methanolsynthese.
3.1.1. Synthesegas aus Erdgas
Der größte Teil des weltweit produzierten Methanols wird aus Erdgas gewonnen, das durch Dampfreformierung, autotherme Reformierung, eine Kombination davon oder durch partielle Oxidation gecrackt werden kann.
Dampfreformierung
Bei der Dampfreformierung wird der Erdgaseinsatzstoff unter Ausschluss von Sauerstoff unter Zugabe von Wasserdampf und ggf. Kohlendioxid katalytisch gecrackt. Dadurch entsteht ein Synthesegas mit einer stöchiometrischen Zahl von deutlich über 2,0.
Die stöchiometrische Zahl kann durch Zugabe von CO2 entweder vor oder nach dem Dampfreformer auf den gewünschten Wert von etwas über 2,0 eingestellt werden. Die für die Reaktion benötigte Wärme wird von außen zugeführt.
Autotherme Reformierung
Bei der autothermen Reformierung wird der Erdgasrohstoff durch partielle Oxidation mit Sauerstoff und Reaktion an einem Ni-basierten Katalysator umgewandelt. Die Wärme für die Reaktion wird durch die exotherme partielle Oxidationsreaktion bereitgestellt. Da das gewonnene Synthesegas einen Mangel an Wasserstoff aufweist, muss vor der Einleitung in den Methanolsynthesekreislauf Wasserstoff hinzugefügt werden.
Kombination aus Dampf- und autothermer Reformierung
Bei einer Kombination beider Verfahren wird nur ein Teil des Erdgasstroms der Dampfreformierung unterzogen. Der Rest wird zusammen mit dem dampfreformierten Gas einem autothermen Reformer (ATR) zugeführt, der mit einem Ni-basierten Katalysator gefüllt ist.
Im ATR wird das Erdgas teilweise mit Sauerstoff oxidiert. Die stöchiometrische Zahl des Synthesegases kann auf etwas über 2,0 eingestellt werden, indem die Aufteilung zwischen Dampf- und autothermer Reformierung angepasst und die richtigen Prozessparameter ausgewählt werden.
Teilweise Oxidation
Bei der partiellen Oxidation wird der Erdgasrohstoff ohne Katalysator durch direkte Oxidation mit Sauerstoff gecrackt. Dadurch entsteht Wärme für die Reaktion.
3.1.2. Synthesegas aus anderen Rohstoffen
Kohlenwasserstoffe
Auch höhere Kohlenwasserstoffe wie Flüssiggas, Raffinerieabgase und Naphtha können als Rohstoffe für die Synthesegasproduktion für Methanolanlagen verwendet werden. Sie werden hauptsächlich durch Dampfreformierung verarbeitet.
Rohöl, Schweröl, Teer und Asphalt
Auch Rohöl, Schweröl, Teer und Asphaltprodukte können in Synthesegas umgewandelt werden, allerdings ist dies schwieriger als bei Erdgas. Ihr Schwefelgehalt ist deutlich höher (0,7-1,5 % H2S und COS) und muss gesenkt werden.
Das erzeugte Synthesegas enthält außerdem überschüssiges Kohlenmonoxid und muss daher einer Konvertierung mit Wasser unterzogen werden. Der entstehende Überschuss an Kohlendioxid wird aus dem Gas entfernt. Gasreinigung und Kohlendioxidentfernung können beispielsweise im Rahmen eines Rectisol-Prozesses erreicht werden.
Kohle
Kohle kann mit Dampf und Sauerstoff durch verschiedene Prozesse bei unterschiedlichen Drücken (0,5–8 MPa) und Temperaturen (400–1500 °C) in Synthesegas umgewandelt werden. Das kohlebasierte Synthesegas muss entschwefelt und einer Konvertierung unterzogen werden, um die erforderliche Stöchiometrie zu erhalten.
3.2. Synthese von Methanol
Methanol wird aus Synthesegas in einem Reaktor bei 200–300 °C und 5–10 MPa synthetisiert. Die Reaktion ist exotherm, daher muss Wärme abgeführt werden, um eine Überhitzung des Reaktors zu verhindern.
Das den Reaktor verlassende Gas wird abgekühlt und das Methanol kondensiert. Das verbleibende Gas wird zusammen mit frischem Synthesegas in den Reaktor zurückgeführt. Dies ist notwendig, da in einem Durchgang nur 50–80 % des Synthesegases in Methanol umgewandelt werden.
Anschließend wird das Rohmethanol gereinigt und destilliert. Das Spülgas aus dem Rückführungskreislauf wird zum Erhitzen des Reformers verwendet.
Technische Entwicklung
Bis 1997 bestand der Hauptunterschied zwischen industriellen Niederdruck-Methanolprozessen im Reaktordesign. Die maximale Kapazität der Methanolanlagen lag bei 2.500 bis 3.000 t/d.
1997 führte Lurgi das MegaMethanol-Verfahren ein, das verschiedene Reaktortypen mit einer groß angelegten Synthesegasproduktionsanlage kombiniert. Dies ebnete den Weg für Methanolanlagen mit Kapazitäten von bis zu 10.000 t/d pro Zug.
Heutzutage stehen verschiedene Methanolsynthesetechnologien zur Verfügung, von denen jede ihre eigenen Vor- und Nachteile hat. Die wichtigsten Technologieanbieter sind Lurgi, JM/Davy, Topsøe, MGC, JM/Uhde, JM/Jacobs, JM/Others und JM/Toyo.
Alle diese Technologien basieren auf hochintegrierten Konzepten, die alle Schritte von der Vergasung und Gasreinigung bis hin zur Synthese und Aufarbeitung umfassen. Dies ermöglicht eine hohe Energie- und CO2-Effizienz von bis zu 67 % bzw. 83 %.
3.2.1. Reaktordesign
Seit den 1960er-Jahren wird Methanol im industriellen Maßstab hergestellt, und auch heute noch sind verschiedene Grundreaktorkonstruktionen im Einsatz. Das beste Design für eine bestimmte Anlage hängt von den spezifischen Anforderungen ab, wie z. B. der Kohlenstoffquelle, der Verfügbarkeit von Versorgungseinrichtungen und der Wärmeintegration.
Adiabatische Reaktoren
Adiabatische Reaktoren führen während der Reaktion keine Wärme ab, sodass die Temperatur entlang der Reaktorachse allmählich ansteigt. Dies kann durch das Abschrecken der Reaktion mit kaltem Gas an mehreren Stellen oder durch den Einsatz einer Reihe von Reaktorbetten mit Zwischenkühlern gemildert werden.
Quasi-isotherme Reaktoren
Quasi-isotherme Reaktoren halten im gesamten Reaktor eine relativ konstante Temperatur aufrecht. Dies geschieht typischerweise durch die Verwendung eines Rohrreaktors mit Kühlung durch siedendes Wasser. Es gibt auch gasgekühlte Reaktoren, bei denen die Reaktionswärme auf das Reaktionsgas übertragen wird.
Spezifische Reaktordesigns
Zu den spezifischen Konstruktionen von Methanolreaktoren gehören:
- Standardmäßiger quasi-isothermer Reaktor: Dieser Reaktor verwendet einen Rohrreaktor mit Kühlung durch siedendes Wasser.
- Variobar-Reaktor: Bei diesem Reaktor handelt es sich um einen in mehreren Lagen gewickelten Rohrbündelreaktor mit in die Katalysatorpackung eingebetteten Kühlrohren.
- Gasgekühlter Reaktor: Dieser Reaktor hat ein Katalysatorbett auf der Mantelseite und das Synthesegas strömt entweder in axialer, radialer oder axial-radialer Richtung durch das Katalysatorbett.
- Superkonverter: Dieser Reaktor verwendet doppelwandige Rohre, die im Ringraum mit Katalysator gefüllt sind. Das Synthesegas strömt zunächst durch das Innenrohr, um es aufzuheizen, und dann in umgekehrter Richtung durch das Katalysatorbett, um Reaktionswärme abzugeben.
3.2.2. Groß angelegte Schleifenentwürfe für die Methanolsynthese
Methanol ist ein guter Energieträger für abgelegene Gebiete, da es leicht transportiert werden kann. Um wirtschaftlich zu sein, müssen Methanolproduktionsanlagen jedoch großtechnisch sein. Das bedeutet, dass die Umwandlungsrate von Synthesegas zu Methanol hoch sein muss, damit die durch den Kreislauf strömende Gasmenge minimiert wird.
Ein Entwurf für eine Hochkonvertierungs-Methanolsyntheseanlage ist die Lurgi Combined Converter Methanol Synthesis (Abbildung 1). Bei diesem Verfahren kommen zwei Reaktoren parallel zum Einsatz: ein quasi-isothermer Siedewasserreaktor und ein gasgekühlter Reaktor.
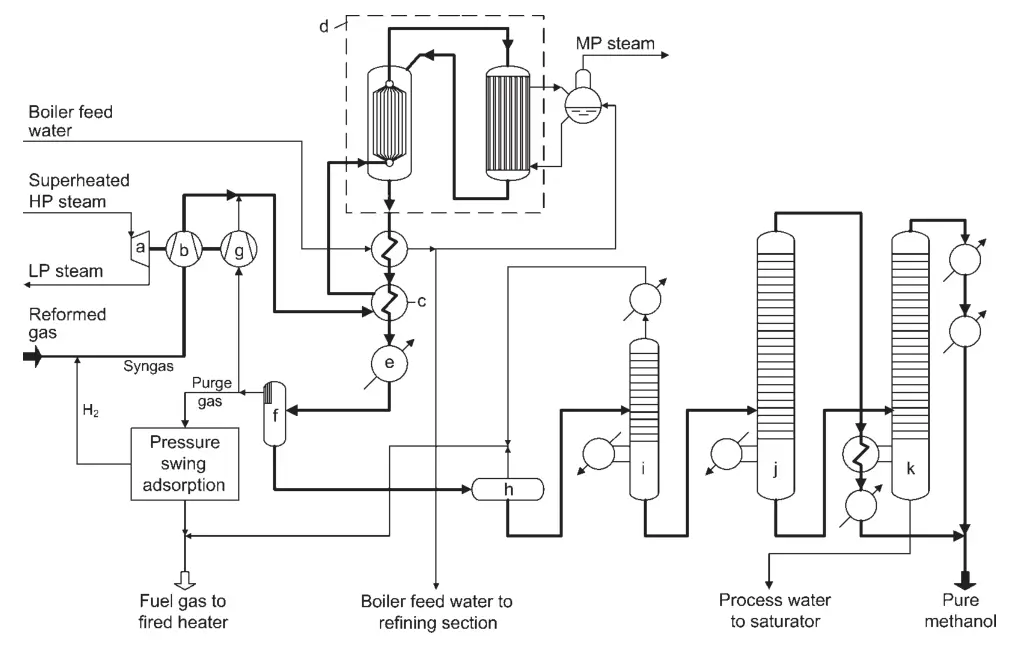
a) Turbine für Synthesegas und Recycle-Kompressor; b) Synthesegaskompressor; c) Heizung trimmen; d) Kombiniertes Konvertersystem; e) Endkühler; f) Methanolabscheider; g) Recyclinggaskompressor; h) Ausdehnungsgefäß; i) Lichtendensäule; j) Drucksäule für reines Methanol; k) Atmosphärische Methanolsäule
Der quasi-isotherme Reaktor wandelt den reaktivsten Teil des Synthesegases um, während der gasgekühlte Reaktor das restliche Gas umwandelt. Die Reaktionswärme des gasgekühlten Reaktors wird zur Vorwärmung des Reaktoreinlassgases für den quasi-isothermen Reaktor genutzt.
Ein weiteres Design für eine Hochkonversions-Methanolsyntheseanlage ist die Reihenschleifentechnologie von Davy Process Technology (Abbildung 2). Bei diesem Verfahren werden zwei Reaktoren in Reihe verwendet, wobei das gleiche Umlaufgas zweimal verwendet wird. Die treibende Kraft für die Reaktion wird durch die Kondensation von Methanol zwischen den beiden Reaktoren aufrechterhalten.
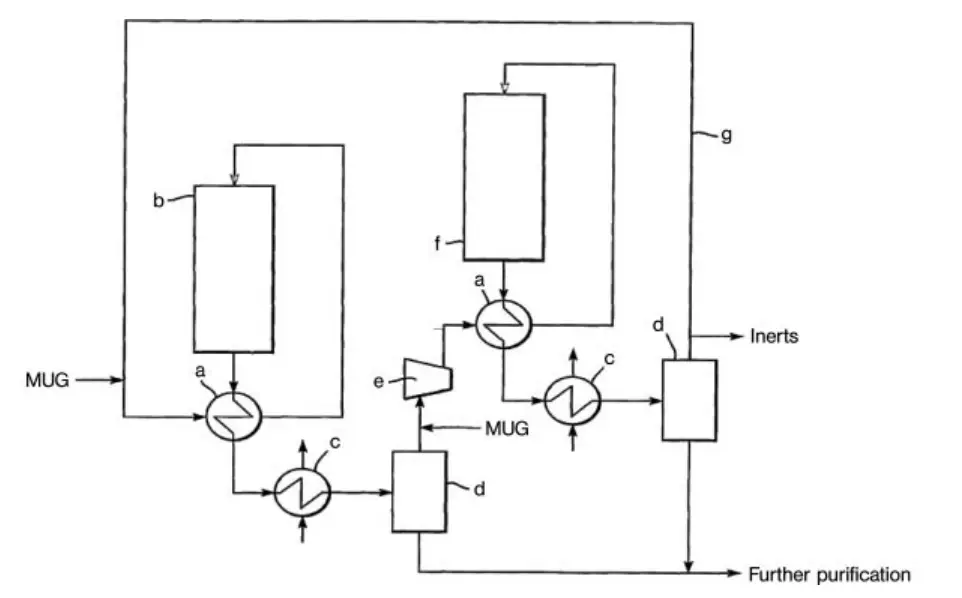
a) Austauscher; b) Reaktor; c) Kondensator; d) Gas-Flüssigkeits-Abscheider; e) Zirkulator; f) Endreaktor; g) Rückführungsgasleitung
3.3. Alternative Synthesewege von Methanol
3.3.1. CO2-zu-Methanol
Die chemische Verwertung von CO2 durch Hydrierung zu Methanol wird seit Anfang der 1990er Jahre untersucht. Allerdings hat es erst in den letzten Jahren an kommerziellem Interesse gewonnen, da das Bewusstsein für die Notwendigkeit der Reduzierung von CO2-Emissionen und die Entwicklung staatlicher Maßnahmen wie CO2-Steuern und Cap-and-Trade-Programme gestiegen sind.
Mehrere Unternehmen haben Katalysatorsysteme und Prozesskonzepte für die CO2-zu-Methanol-Produktion entwickelt. Es liegen jedoch nur wenige Ergebnisse im Pilotmaßstab vor, und die einzigen Projekte im Demonstrationsmaßstab stammen von Mitsui Chemicals und Carbonrecycling, Island.
Das Grundwissen zur CO2-zu-Methanol-Technologie ist bereits vorhanden, die eigentlichen Herausforderungen liegen jedoch in der Produktion von erneuerbarem Wasserstoff und der wirtschaftlichen Produktion von sauberem CO2 aus Abgasströmen.
Die politischen, ökologischen und wirtschaftlichen Treiber werden darüber entscheiden, ob und wann diese Technologie auf den Markt kommt.
3.3.2. Flüssigphasen-Methanolsynthese
Methanol kann auch durch die Umwandlung von Kohlenmonoxid (CO) mit Wasserstoff in einer flüssigen Phase, typischerweise Methanol, hergestellt werden. Bei Verwendung geeigneter Reaktionsbedingungen und alkalihaltiger Katalysatorsysteme können erhebliche Produktivitäten von bis zu 1,3 kg kgKat⁻¹ h⁻¹ erreicht werden.
Der Reaktionsmechanismus in der flüssigen Phase unterscheidet sich von dem in der Gasphase. Dabei erfolgt die Carbonylierung von Methanol (oder einem höheren Alkohol) zum jeweiligen Methylester, gefolgt von der Hydrogenolyse zum jeweiligen Alkohol und Methanol.
Ende der 1990er Jahre nahm das US-Energieministerium (DOE) zusammen mit Eastman und Air Products eine Demonstrationsanlage zur Flüssigphasen-Methanolsynthese in Betrieb. Es wurde jedoch festgestellt, dass die Katalysatorlebensdauern schlechter sind als bei herkömmlichen Verfahren (Bestfall: 0,17 %/Tag bei 215 °C). Sowohl Wasser als auch CO2 wirken sich negativ auf die Katalysatorleistung aus.
Trotz dieser Herausforderungen wird weiterhin an der Flüssigphasen-Methanolsynthese geforscht. Dieses Konzept ist vielversprechend, da es das Potenzial hat, effizienter und kostengünstiger zu sein als die herkömmliche Gasphasen-Methanolsynthese.
3.3.3. Direkte Oxidation von Methan
Die direkte Oxidation von Methan zu Methanol ist eine äußerst wünschenswerte Reaktion, aber auch eine große Herausforderung. Dies liegt daran, dass die Reaktion sowohl kinetisch als auch thermodynamisch ungünstig ist.
Die meisten Katalysatorsysteme für die Direktoxidation von Methan zu Methanol liefern entweder einen geringen Umsatz (<10 %) oder eine geringe Selektivität (<80 %). Einige Unternehmen behaupten jedoch, einfache und effiziente Verfahren für diese Reaktion entwickelt zu haben, hauptsächlich für kleine Gasquellen.
Ein vielversprechendes Katalysatorsystem sind heterogene Pt-CTF-Katalysatoren (kovalentes triazinbasiertes Gerüst) in einem Schwefelsäuremedium. Es hat sich gezeigt, dass dieses System eine hohe Umwandlung und Selektivität für die direkte Oxidation von Methan zu Methanol erreicht.
3.4. Destillation von Rohmethanol
Rohes Methanol, das den Reaktor verlässt, enthält Wasser und andere Verunreinigungen, einschließlich leichter und schwerer Enden. Die Menge und Zusammensetzung dieser Verunreinigungen hängt von den Reaktionsbedingungen, dem Einsatzgas und dem Katalysator ab.
Um das Rohmethanol zu reinigen, wird es zunächst durch Zugabe kleiner Mengen wässriger Natronlauge leicht alkalisch gemacht, um niedere Carbonsäuren zu neutralisieren und Ester teilweise zu hydrolysieren. Dann werden die hellen Enden in einer leichten Endensäule entfernt. Abschließend wird reines Methanol über Kopf in einer oder mehreren Destillationskolonnen destilliert.
Wenn die Destillationskolonnen bei unterschiedlichen Drücken betrieben werden, kann die Kondensationswärme der Dämpfe der bei höherem Druck betriebenen Kolonne zum Erhitzen der Kolonne bei niedrigerem Druck genutzt werden.
Sollte das Prozesswasser leichte Verunreinigungen enthalten, ist entweder ein Seitenabzug oder eine zusätzliche Kolonne zur Reinigung erforderlich.
Einige Komponenten bilden mit Methanol azeotrope Gemische, wie zum Beispiel Aceton, Ethylformiat, Methylacetat, Ethylacetat und Methylproprionat.
4. Verwendung von Methanol
Methanol hat vielfältige Einsatzmöglichkeiten in verschiedenen Branchen. Ausführliche Informationen finden Sie in diesem Artikel: Verwendung von Methanol →
5. Toxikologie von Methanol
Methanol ist ein giftiger Alkohol, der über Mund, Haut und Lunge aufgenommen werden kann. Es wird zu Ameisensäure verstoffwechselt, was zu Azidose und anderen Gesundheitsproblemen führen kann.
Zu den Symptomen einer Methanolvergiftung gehören Bauchschmerzen, Übelkeit, Kopfschmerzen, Erbrechen, Mattigkeit, verschwommenes Sehen, Ophthalmalgie, Photophobie und Xanthopsie. In schweren Fällen kann eine Methanolvergiftung zum Koma und zum Tod führen.
Die tödliche Methanoldosis liegt zwischen 30 und 100 ml/kg Körpergewicht. Die Empfindlichkeit gegenüber Methanol ist sehr unterschiedlich.
Die Behandlung einer Methanolvergiftung umfasst:
- Verabreichung von Ethanol zur Hemmung der Oxidation von Methanol zu Ameisensäure
- Magenspülung
- Hämodialyse
- Behandlung mit Alkali zur Kontrolle der Übersäuerung des Blutes
- Verabreichung von ZNS-Stimulanzien
- Trinken größerer Flüssigkeitsmengen
- Augenbinde zum Schutz der Augen vor Licht
- Hält den Patienten warm
Methanol kann auch chronische Vergiftungen verursachen, die durch eine Schädigung des Seh- und Zentralnervensystems gekennzeichnet sind.
Referenz
- Methanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_465.pub3
