Lävulinsäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Lävulinsäure?
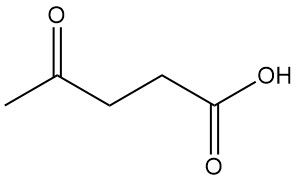
Lävulinsäure, auch bekannt als 4-Oxopentansäure oder γ-Ketovaleriansäure, ist die einfachste und wichtigste γ-Oxocarbonsäure mit der Formel C5H8O3. Sie ist ein weißer kristalliner Feststoff, der in Wasser und polaren organischen Lösungsmitteln löslich ist.
Lävulinsäure wurde erstmals 1875 von Grote und Tollens beschrieben und benannt, erlangte jedoch erst 1960 kommerzielle Bedeutung.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Lävulinsäure
Lävulinsäure bildet farblose Kristalle, die in Wasser, Ethanol und Diethylether gut löslich sind.
Wichtige physikalische Eigenschaften von Lävulinsäure sind in der folgenden Tabelle aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [123-76-2] |
| Chemische Formel | H3C-CO-CH2-CH2-COOH |
| Molekularmasse | 116,11 g/mol |
| Schmelzpunkt | 37 °C |
| Siedepunkt | bei (101,31 kPa): 245–246 °C bei (1,33 kPa): 137–139 °C |
| Spezifische Dichte (20 °C) | 1,14 |
| Brechungsindex (25 °C) | 1,4396 g/cm3 |
| pKa | 4,64 (bei 18 °C) |
| Flammpunkt | 138 °C |
2. Reaktionen von Lävulinsäure
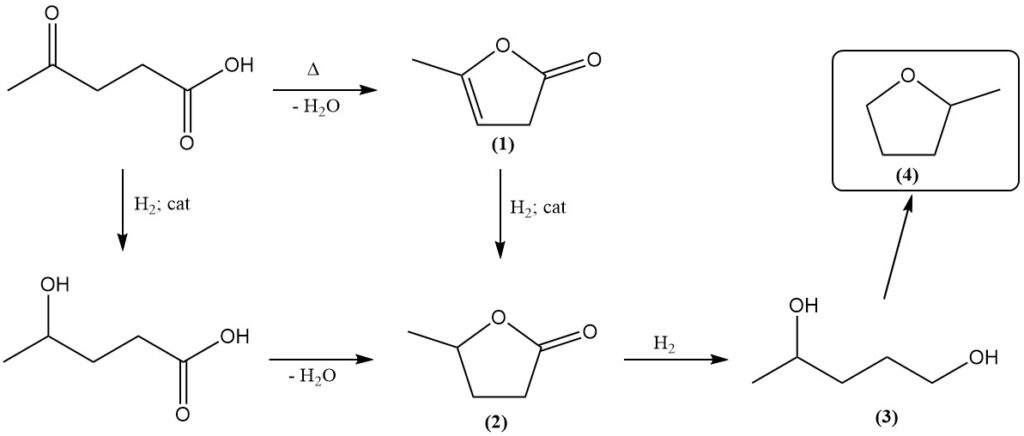
Lävulinsäure reagiert sowohl als Keton als auch als Carbonsäure. Längeres Erhitzen führt zur Dehydratation und ergibt Angelicalacton (1).
Katalytische Hydrierung wandelt Lävulinsäure in γ-Valerolacton (2) um. Dabei wurden verschiedene Katalysatoren eingesetzt, darunter Platinoxid, Raney-Nickel, Kupferchromit und rheniumbasierte Systeme. Die anschließende Hydrierung ergibt 1,4-Pentandiol (3), einen Vorläufer von Methyltetrahydrofuran (4).
Kondensationsreaktionen mit Aldehyden finden je nach Reaktionsbedingungen an den Kohlenstoffpositionen α, β oder δ statt.
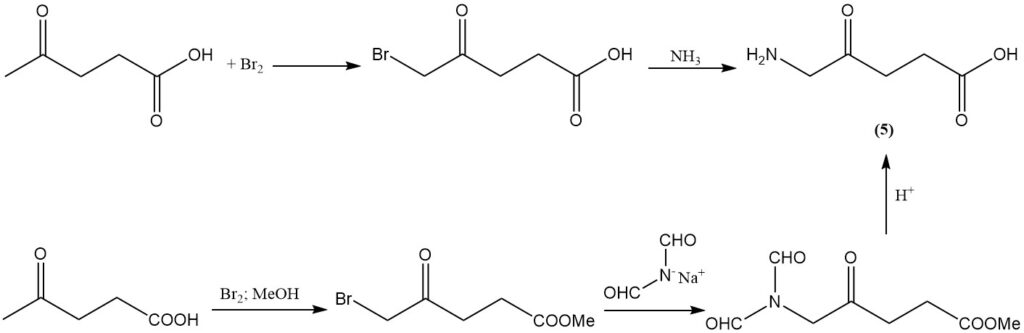
Die Bromierung von Lävulinsäure mit Brom, gefolgt von einer Aminierung, ergibt Aminolävulinsäure (5), ein Herbizid mit Breitbandwirkung. Dieses Herbizid kann auch in hoher Ausbeute durch Bromierung von Lävulinsäure, gefolgt von einer Reaktion mit dem Diformylamid-Anion und anschließender Säurehydrolyse hergestellt werden.
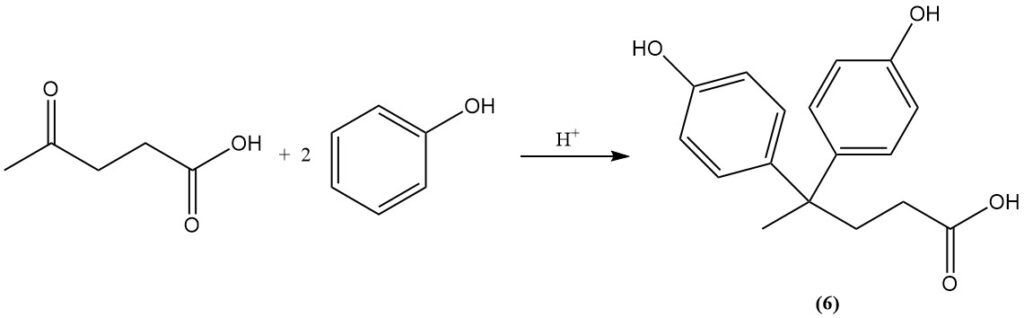
Durch die Reaktion von Lävulinsäure mit Phenol entsteht Diphenolsäure (6), eine Verbindung, die bei der Herstellung von Polymeren verwendet wird.
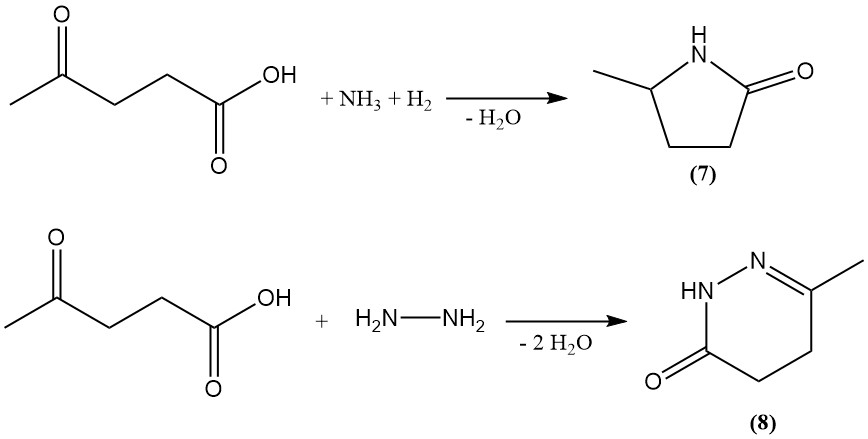
Lävulinsäure wird als Vorstufe zur Synthese diverser heterozyklischer Verbindungen verwendet. Durch reduktive Aminierung entsteht 5-Methyl-2-pyrrolidon (7), während durch Reaktion mit Hydrazin 6-Keto-3-methyl-1,4,5,6-tetrahydropyridazon (8) entsteht.
Lävulinsäure kann mit Alkoholen reagieren und Ester bilden, wie z. B. Ethyllävulinat, das in Duftstoffen verwendet wird.
3. Herstellung von Lävulinsäure
Lävulinsäure wird industriell aus Kohlenhydratpolymeren wie Zellulose oder Stärke synthetisiert. Diese Polymere werden zunächst durch säurekatalysierte Hydrolyse zu Hexosemonomeren, hauptsächlich D-Glucose, depolymerisiert, gefolgt von einer enzymatischen Isomerisierung von D-Glucose zu D-Fructose.
Die anschließende Dehydratisierung von D-Fructose ergibt Hydroxymethylfurfural, ein wichtiges Zwischenprodukt bei der Bildung von Lävulinsäure. Die klassische Synthese nutzt die direkte Reaktion von D-Fructose mit Salzsäure.
Alternative Synthesewege umfassen Esterhydrolyse, Furfurylalkoholhydrolyse, Ketonoxidation, palladiumkatalysierte Carbonylierung von Ketonen und Nitroalkanalkylierung. Allerdings führen diese Verfahren häufig zu erheblichen Nebenprodukten oder erfordern teure Ausgangsstoffe.
Das Biofine-Verfahren (Abbildung 1) stellt einen bemerkenswerten Fortschritt in der Lävulinsäureproduktion dar. Für die Lävulinsäuresynthese aus Kohlenhydratrohstoffen wird ein zweistufiges Reaktorsystem eingesetzt.
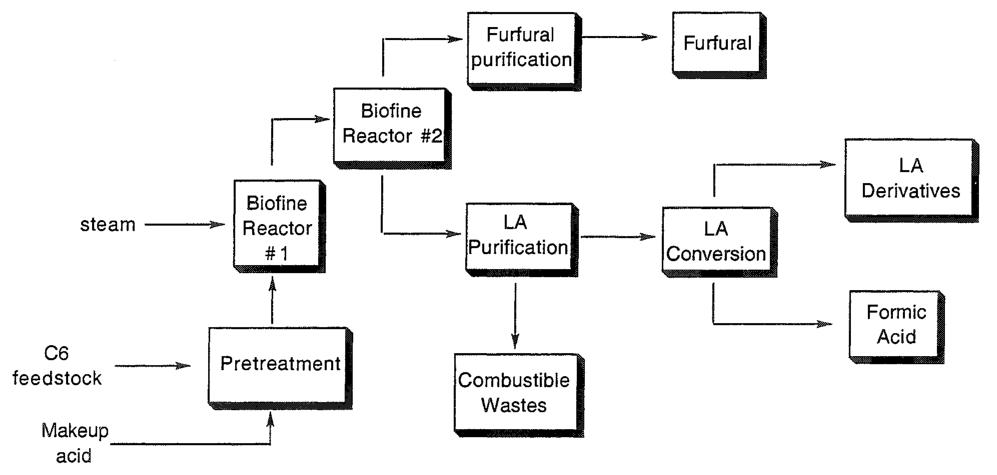
Im ersten Reaktor findet die Kohlenhydrathydrolyse bei Temperaturen zwischen 210 und 230 °C für kurze 13 bis 25 Sekunden in Gegenwart eines verdünnten Mineralsäurekatalysators statt. In dieser Phase entsteht Hydroxymethylfurfural, das kontinuierlich extrahiert und in den nachfolgenden Reaktor überführt wird.
Im zweiten Reaktor wird Hydroxymethylfurfural bei Temperaturen zwischen 195 und 215 °C für eine Dauer von 15 bis 30 Minuten weiter hydrolysiert. Lävulinsäure wird kontinuierlich aus diesem Reaktor entfernt.
Die Gesamtausbeute an Lävulinsäure, berechnet auf der Grundlage des anfänglichen Hexosegehalts des Kohlenhydratrohstoffs, beträgt ungefähr 60 %. Diese Effizienz ist im Vergleich zu zuvor gemeldeten Methoden bemerkenswert hoch.
Dieses Verfahren liefert hohe Ausbeuten, reduzierte Nebenproduktbildung und das Potenzial für eine kostengünstige Produktion aus verschiedenen Zelluloseabfallströmen. Wirtschaftliche Prognosen deuten auf erhebliche Energieeinsparungen und Abfallreduzierung durch die großtechnische Umsetzung des Biofine-Verfahrens hin.
Alternativ kann Lävulinsäure aus petrochemischen Rohstoffen hergestellt werden. Ein patentiertes Verfahren nutzt die Ozonolyse ungesättigter Kohlenwasserstoffe zur Erzeugung von Lävulinsäure, obwohl die Reaktion komplex ist.
4. Verwendung von Lävulinsäure
Lävulinsäure wird als Vorläufer für die Synthese von Arzneimitteln, Weichmachern und als Hilfsmittel bei der Galvanisierung verwendet. Sie wird bei der Herstellung von Aminolävulinsäure (einem biologisch abbaubaren Herbizid), Gamma-Valerolacton (einem Lösungsmittel, Kraftstoffzusatz und Zwischenprodukt für andere Chemikalien) und Diphenolsäure verwendet.
Das Calciumsalz der Lävulinsäure wird in der Calciumtherapie verwendet, und Lävulinsäureester werden bei der Herstellung von Kosmetika und Duftstoffen verwendet.
5. Toxikologie der Lävulinsäure
Lävulinsäure weist eine geringe akute Toxizität auf. Die orale LD50 bei Ratten beträgt 1850 mg/kg. Die dermale LD50 bei Ratten liegt über 2000 mg/kg. Daten zur Inhalationstoxizität sind nicht verfügbar.
Lävulinsäure ist ein Hautreizmittel. Sie verursacht schwere Augenschäden. Sie ist ein Hautsensibilisator, wie positive Ergebnisse bei lokalen Lymphknotentests zeigen.
Lävulinsäure verursacht in vitro keine Chromosomenaberrationen in menschlichen Lymphozyten oder Genmutationen in Lungenzellen chinesischer Hamster.
Die verfügbaren Daten zur Karzinogenität, Reproduktionstoxizität und spezifischen Zielorgantoxizität für Lävulinsäure sind unzureichend.
Lävulinsäure enthält keine Komponenten, die gemäß den REACH-Vorschriften als endokrine Disruptoren identifiziert wurden.
Daten zur Toxizität, Persistenz und Abbaubarkeit von Lävulinsäure in der Umwelt sind begrenzt.
Lävulinsäure ist beim Verschlucken gesundheitsschädlich, kann allergische Hautreaktionen hervorrufen und verursacht schwere Augenschäden.
Referenzen
- Oxocarboxylic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a18_313
- https://pubchem.ncbi.nlm.nih.gov/compound/Levulinic-acid
- https://www.aceee.org/files/proceedings/1999/data/papers/SS99_Panel1_Paper60.pdf
- https://www.merckmillipore.com/INTL/en/product/msds/MDA_CHEM-814254
