Indol: Eigenschaften, Reaktionen, Herstellung und Verwendung
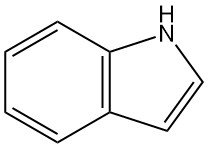
Was ist Indol?
Indol, auch bekannt als 1-Benzo[b]pyrrol, ist eine aromatische heterozyklische organische Verbindung mit einer bizyklischen Struktur (ein Benzol, das mit einem Pyrrol verschmolzen ist) und der chemischen Formel C8H7N. Es ist ein farbloser Feststoff mit einem sehr hartnäckigen muffigen Geruch.
Indol wurde erstmals 1866 von A. V. Baeyer und C. A. Knop als Ergebnis von Forschungen zur Reduktion von Isatin entdeckt, das aus dem natürlichen Farbstoff Indigo gewonnen wird. Indol wurde durch Erhitzen von Oxindol mit Zinkstaub synthetisiert. 1910 isolierte R. Weissgerber Indol aus Kohlenteer.
Indol wurde in Robinia pseudacacia, Jasmin und bestimmten Zitruspflanzen gefunden; im Parfüm von Hevea bruziLiensis in Orangenblüten und im Holz von Celtis reticulosa. Es macht 2,5 % des Jasminöls und 0,1 % des Orangenblütenöls aus. Bei Verwendung in höheren Konzentrationen in Duftstoffen verströmt es einen intensiven Fäkalgeruch.
Indol ist planar mit 10 π-Elektronen in einem vollständig konjugierten System. Der Ring wird aufgrund des elektronenspendenden Charakters des Pyrrol-Stickstoffatoms als π-überschüssige heteroaromatische Verbindung klassifiziert. Das π-System ist relativ elektronenreich, insbesondere am Kohlenstoff C-3.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Indol
Indol ist ein farbloser, kristalliner Feststoff, der in Alkohol, Benzol, Ether und den meisten organischen Lösungsmitteln gut löslich, in Wasser jedoch kaum löslich ist. Es ist mit Dampf flüchtig.
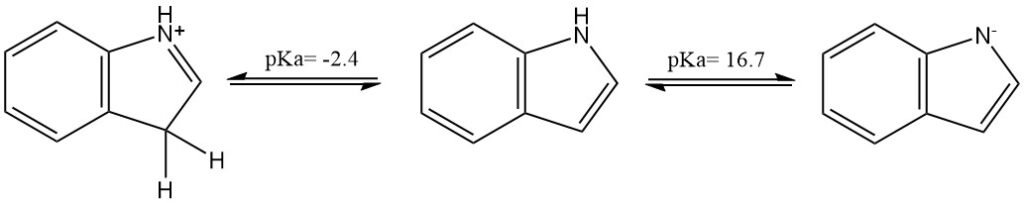
Indol ist eine neutrale Verbindung (nichtbasische Stickstoffverbindung), kann aber durch eine sehr starke Säure bzw. Base protoniert oder deprotoniert werden. Der pKa der konjugierten Säure beträgt etwa −2,4; der der neutralen Verbindung etwa 16,7.
Die physikalischen Eigenschaften von Indol sind in der folgenden Tabelle zusammengefasst:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [120-72-9] |
| Chemische Formel | C8H7N |
| Molekulargewicht | 117,15 g/mol |
| Schmelzpunkt | 52–54◦C |
| Siedepunkt | 254 °C |
| Dichte | 1,22 g/cm3 |
| pKa | 16,7 |
| Verbrennungswärme | 3,650 kJ/kg (bei 25 °C) |
| Verdampfungsenthalpie (10,3–27,4 °C) | 597,5 kJ/kg |
| Dipolmoment | 2,11 D (Benzol) |
2. Chemische Reaktionen von Indol
Indol als heterozyklische Verbindung zeigt eine Reaktivität, die für Pyrrol und Benzol charakteristisch ist. Das an den Stickstoff gebundene Wasserstoffatom kann durch Alkalimetalle ersetzt werden. Die Oxidation von Indol ergibt Indigo, während eine milde Hydrierung 2,3-Dihydroindol (Indolin) erzeugt. Reaktionen mit Säuren führen zur Bildung von Diindol, Triindol und Polymerprodukten.
2.1. Elektrophile aromatische Substitution von Indol
Indol kann aufgrund der elektronenreichen Natur der Pyrroleinheit eine elektrophile aromatische Substitution erfahren. Das Kohlenstoffatom in Position 3 ist aufgrund der Elektronendichteverteilung und der Stabilität der Zwischenstrukturen am reaktivsten.
Computergestützte Studien mit Molekülorbitalmethoden haben ergeben, dass die Elektronendichte in Position 3 höher ist als in Position 2. Darüber hinaus legen die relativen Energien der während der elektrophilen Substitution gebildeten Zwischenstrukturen nahe, dass die 3-Position für einen Angriff günstiger ist.
Diese Präferenz ist wahrscheinlich auf die Beibehaltung des benzoiden Charakters des carbocyclischen Rings im an der 3-Position gebildeten Zwischenprodukt zurückzuführen.
Im Fall von 3-substituierten Indolen kann ein elektrophiler Angriff immer noch an der 3-Position erfolgen, selbst wenn diese bereits substituiert ist. Dies kann zu einem komplexen Substitutionsmuster führen, da entweder der neue oder der ursprüngliche Substituent an die 2-Position wandern kann.
Viele gängige elektrophile aromatische Substitutionsreaktionen können an Indol durchgeführt werden. Allerdings treten häufig Komplikationen aufgrund der übermäßigen Reaktivität von Indol oder der relativen Instabilität der Substitutionsprodukte auf. Ein solches Beispiel ist die Halogenierung.
2.1.1. Halogenierung
Die Halogenierung von Indol kann mithilfe verschiedener Reagenzien wie Hypochlorition, Sulfurylchlorid, Pyridiniumtribromid und Iod erreicht werden. Das Hauptprodukt der Halogenierung ist typischerweise das 3-Haloindol-Derivat.
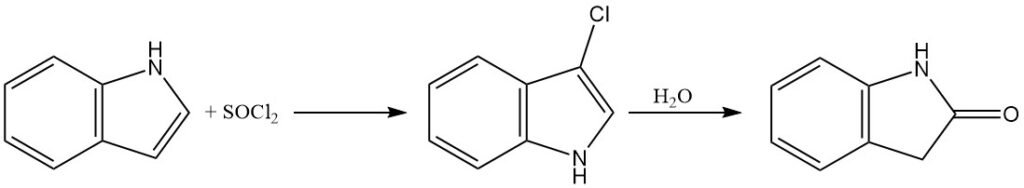
Indol kann mit Hypochloritionen oder Sulfurylchlorid chloriert werden, um 3-Chlorindol zu erhalten. 3-Chlorindol ist jedoch in sauren wässrigen Lösungen relativ instabil und kann zu Oxindol hydrolysiert werden.
3-Bromindol kann unter Verwendung von Pyridiniumtribromid als Quelle für elektrophiles Brom hergestellt werden. Indol reagiert mit Iod zu 3-Iodindol.
Sowohl 3-Bromindol als auch 3-Iodindol sind in sauren Bedingungen anfällig für Hydrolyse, sind jedoch in basischen Umgebungen relativ stabil.
2.1.2. Nitrierung
Die Nitrierung von Indol kann aufgrund der Bildung von Stickoxiden, die an oxidativen Umwandlungen beteiligt sein können, eine komplexe Reaktion sein. In stark sauren Medien erfolgt die Nitrierung von 2-substituierten Indolen hauptsächlich an der 5-Position.
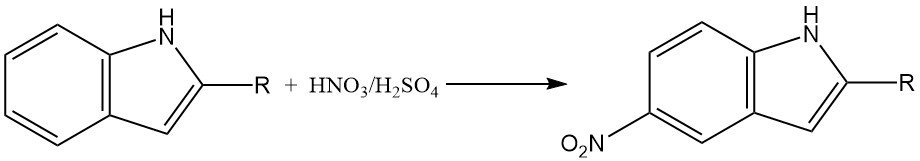
Dies ist wahrscheinlich auf die Bildung eines konjugierten Säurezwischenprodukts zurückzuführen, das einen reduzierten aromatischen Charakter aufweist und anfälliger für eine Nitrierung an der 5-Position ist.
2.1.3. C-Alkylierung
Die C-Alkylierung von Indol kann durch Reaktion von Indol mit Alkylierungsmitteln unter geeigneten Bedingungen erreicht werden. Die Regioselektivität der C-Alkylierung kann durch die Reaktionsbedingungen und die Art des Alkylierungsmittels beeinflusst werden.
Bedingungen, die die Bildung des elektrophilen aromatischen Substitutionszwischenprodukts fördern, wie die Verwendung starker Basen oder eine enge Metallkoordination am Stickstoff oder hochreaktive Alkylierungsmittel wie allylische und benzylische Verbindungen, begünstigen die C-3-Alkylierung.
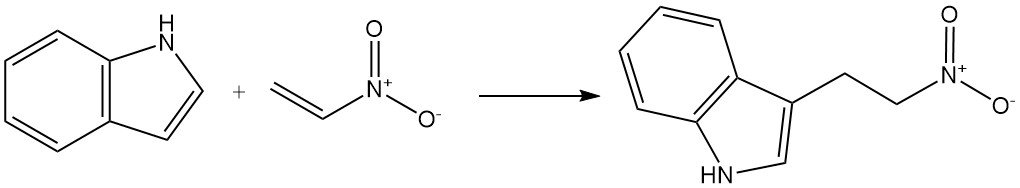
Ungesättigte Reagenzien, die durch elektronenziehende Gruppen aktiviert werden, können ebenfalls mit Indol reagieren und eine C-3-Alkylierung eingehen. Ein Beispiel ist die Reaktion von Indol mit Nitroethylen zu 3-(2-Nitroethyl)indol.
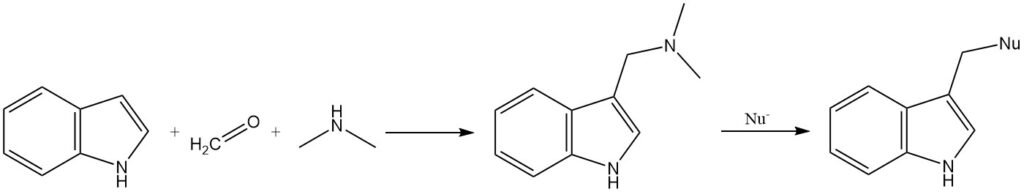
Gramin, ein Zwischenprodukt, das durch die Reaktion von Indol mit N,N-Dimethylformaldiminiumion entsteht, kann verwendet werden, um eine Vielzahl von Substituenten an der 3-Position einzuführen. Die Dimethylaminogruppe in Gramin kann durch Nukleophile ersetzt werden, oder Gramin kann vor der Substitution in sein quaternäres Salz umgewandelt werden.
2.1.4. Acylierung
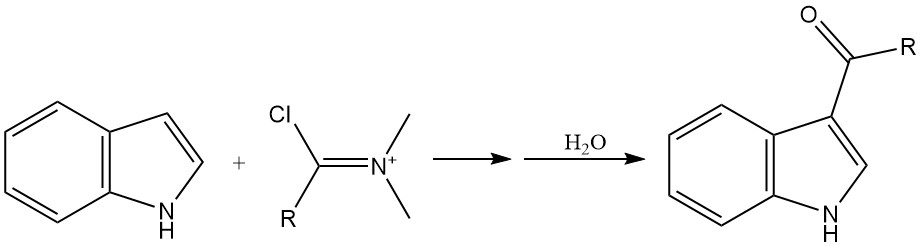
Die Acylierung ist eine weitere wichtige Methode zur Einführung von Substituenten in den Indolring, insbesondere an der 3-Position. Die Acylierung kann mithilfe verschiedener Reagenzien wie Acylhalogeniden und Vilsmeier-Haack-Reagenzien erreicht werden.
Hochreaktive Acylhalogenide wie Oxalylchlorid können Indol direkt acylieren, ohne dass ein Katalysator erforderlich ist. Normale Säurechloride können mit den Magnesium- oder Zinksalzen von Indol umgesetzt werden, um Acylierungsprodukte herzustellen.
Die Vilsmeier-Haack-Reaktion, an der ein Amid und Phosphoroxychlorid beteiligt sind, ist eine gängige Methode zur Acylierung von Indol.
2.2. N-Alkylierung von Indol
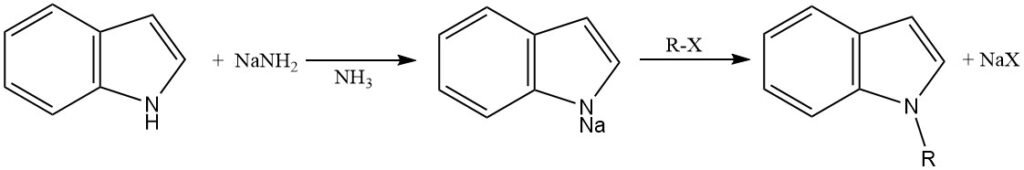
Um die N-Alkylierung zu ermöglichen, muss der Indolring deprotoniert werden, um das Indolanion zu erzeugen, das ein stärkeres Nukleophil ist als das neutrale Indolmolekül.
Diese Deprotonierung kann durch verschiedene starke Basen, wie Natriumamid in flüssigem Ammoniak, Natriumhydrid oder Kaliumhydrid in aprotischen Lösungsmitteln (N,N-Dimethylformamid und Dimethylsulfoxid), oder durch Phasentransferkatalyse erreicht werden.
Das erzeugte Indolanion wird durch Reaktion mit einem Alkylhalogenid oder einem anderen Alkylierungsmittel alkyliert. Die Wahl des Alkylierungsmittels und der Reaktionsbedingungen kann die Regioselektivität der N-Alkylierung beeinflussen.
Primäre, sekundäre und tertiäre Alkylhalogenide können zur N-Alkylierung von Indol verwendet werden. Primäre Alkylhalogenide sind jedoch im Allgemeinen reaktiver als sekundäre oder tertiäre Alkylhalogenide. Andere Alkylierungsmittel wie Dialkylsulfate, Alkyltosylate und Alkyltriflate können ebenfalls verwendet werden.
2.3. Arylierung von Indol
Bei der Arylierung von Indol wird eine Arylgruppe in den Indolring eingeführt. Diese Reaktion wird typischerweise über substituierte Zwischenprodukte und nicht direkt am Indol durchgeführt. Palladiumkatalysierte Kreuzkupplungsreaktionen sind zur bevorzugten Methode für die Arylierung von Indolen und anderen heteroaromatischen Ringen geworden.
Palladiumkatalysierte Kreuzkupplungsreaktionen umfassen die Kupplung eines Arylhalogenids oder Aryltriflats mit Indol in Gegenwart eines Palladiumkatalysators. Das Arylnukleophil kann eine Indol-Zinn-, Indol-Zink- oder Indol-Boronsäure sein.
Palladiumkatalysierte Kreuzkupplungsreaktionen sind hochselektiv, können zur Einführung einer Vielzahl von Arylgruppen in den Indolring verwendet werden und werden unter milden Bedingungen durchgeführt.
2.4. Lithiierung und nachfolgende Transformationen
Bei der Lithiierung von Indol wird ein Lithiumatom in den Indolring in Position 2 eingeführt. Drei Zwischenprodukte wurden häufig verwendet, wie 1-Phenylsulfonylindol (1), 1-t-Butoxycarbonylindol (2) oder Lithiumindol-1-carboxylat (3) und erzielten eine gute Ausbeute.
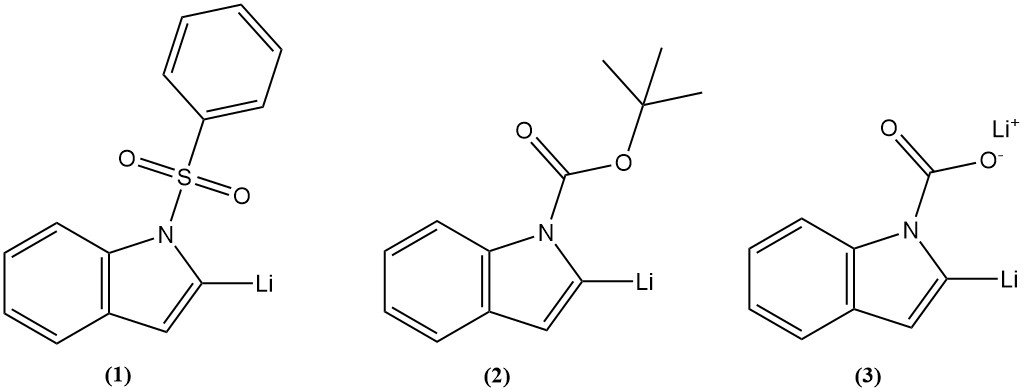
Auf die Lithiierung von Indol an der 2-Position kann eine Reaktion mit verschiedenen Elektrophilen folgen, um eine Vielzahl von Substituenten einzuführen. Die Lithiierung an anderen Positionen des Indolrings kann durch Halogen-Metall-Austausch erreicht werden.
2.5. Oxidation von Indol
Indol ist aufgrund seiner elektronenreichen Natur anfällig für Oxidation. Die Oxidation von Indol kann je nach verwendetem Oxidationsmittel zur Bildung verschiedener Zwischenprodukte und Produkte führen.
Die Oxidation von Indol mit Sauerstoff führt häufig zur Bildung von 3-Hydroperoxy-3H-indol-Zwischenprodukten. Diese Zwischenprodukte können weitere Transformationen, wie Zersetzung oder Umlagerung, durchlaufen, um verschiedene Oxidationsprodukte zu bilden.
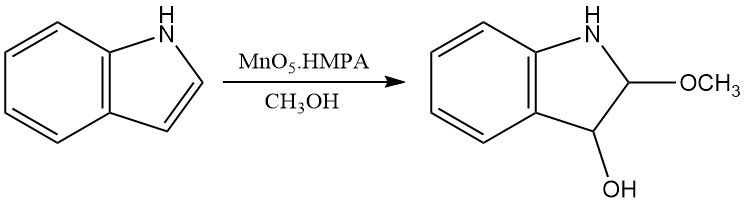
Peroxycarbonsäuren können Indol ebenfalls oxidieren, um ähnliche Produkte zu ergeben wie die mit Sauerstoff erhaltenen. Andere chemische Oxidationsmittel, wie Dimethylsulfoxid in wässriger Säure oder MoO5·HMPA, erzeugen Oxindole bzw. 3-Hydroxy-2-methoxyindoline.
3. Produktion von Indol
Indol wird hauptsächlich aus zwei Quellen gewonnen: Kohlenteer und chemische Synthese. Obwohl synthetische Methoden zur Produktion von Indol beschrieben wurden, ist die Extraktion aus der Kohlenteerdestillatfraktion die einzige kommerzielle Quelle.
Hochtemperaturkohlenteer enthält etwa 0,2 % Indol. Während der Kohlenteerdestillation wird Indol in einer Biphenylindolfraktion konzentriert, die in einem engen Temperaturbereich von 245 bis 255 °C siedet.
Nach dem Entfernen von Phenolen und Basen wird Indol von Biphenyl getrennt durch:
- Reaktion mit Kaliumhydroxid zur Bildung seines Kaliumsalzes, das von Biphenyl getrennt werden kann.
- Azeotrope Destillation mit Diethylenglykol.
- Extraktion aus der Biphenyl-Indol-Mischung unter Verwendung selektiver Lösungsmittel wie Glykole, wässriges Dimethylsulfoxid oder Monoethanolamin.
Das aus diesen Verfahren gewonnene Rohindol kann durch Kristallisation aus aliphatischen Kohlenwasserstofflösungsmitteln weiter gereinigt werden.
Es wurden mehrere chemische Methoden für die Synthese von Indol im technischen Maßstab entwickelt, darunter:
- Die Madelung-Synthese umfasst die Formylierung von o-Toluidin mit Ameisensäure, gefolgt von einer Cyclisierung zu Indol.
- Dehydrierung und Cyclisierung von 2-Ethylanilin zu Indol.
- Cyclokondensation von Anilin und Ethylenglykol in der Flüssig- oder Gasphase zur Herstellung von Indol.
- Cyclisierung von 2-(2-Nitrophenyl)ethanol.
3.1. Herstellung von Indol durch Madelung-Synthese
Die Madelung-Synthese ist eine klassische Methode zur Herstellung von Indolen. Diese Reaktion ist eine intramolekulare Kondensation eines o-Alkylanilids. O-Toluidin reagiert mit Ameisensäure zu N-Formyl-o-toluidin, das mit Natriumamid zu Indol behandelt wird.
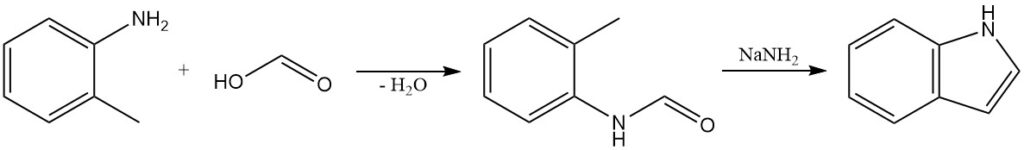
Die Madelung-Synthese wurde zur Herstellung einer Vielzahl substituierter Indole verwendet, darunter auch solche mit funktionellen Gruppen wie Halogenen, Alkylgruppen und Arylgruppen.
Bei der ursprünglichen Madelung-Synthese wurden hohe Temperaturen und starke Basen wie Natriumamid verwendet. Beispielsweise kann o-Methylacetanilid durch Erhitzen mit Natriumamid bei erhöhten Temperaturen in 2-Methylindol umgewandelt werden.
In den letzten Jahren haben Forscher mildere Bedingungen für die Madelung-Synthese entwickelt, die für empfindliche Substrate oder wenn die Vermeidung von Nebenreaktionen wichtig ist, von Vorteil sein können.
Eine Methode besteht darin, starke, nicht nukleophile Basen wie n-Butyllithium oder Lithiumdiisopropylamid zu verwenden, um ein Dilithioderivat des Anilids zu bilden, das dann unter milderen Bedingungen zyklisiert werden kann.
3.2. Andere Synthesemethoden
Indol kann auf verschiedenen Wegen synthetisiert werden, darunter durch die Reaktion von Anilin mit Ethylenbromid, das Erhitzen von o-Amino-ω-Chlorstyrol mit Natriumethoxid und das Erhitzen des Dianilids von Weinsäure mit Zinkchlorid.
Indol-2-carbonsäure, die durch Decarboxylierung Indol ergibt, kann durch Erhitzen von o-Formylphenylglycin mit Essigsäureanhydrid und Natriumacetat gebildet werden.
Andere Methoden zur Indolsynthese umfassen die Destillation von Oxal-o-toluylsäure mit Zinkstaub oder dessen Bariumsalz, die Pyrolyse von N-Ethylanilin, die katalytische Dehydrierung von o-Ethylanilin und das Erhitzen von o,o’-Diaminostilbenhydrochlorid unter reduziertem Druck.
Indol kann auch durch die Reduktion von o-Nitrophenylacetonitril, o-Nitrozimtsäure oder o-Nitrophenylacetaldehyd gewonnen werden.
Schließlich kann Indol durch Behandlung von Acetyl-o-aminozimtsäure mit Salzsäure bei hohen Temperaturen oder durch Reduktion von o-ω-Dinitrostyrol hergestellt werden. Durch Erhitzen von Indol-2-carbonsäure und Chinolin-2,3-dicarbonsäure mit Calciumcarbonat erhält man ebenfalls Indol.
3.3. Die Fischer-Indolsynthese
Die Fischer-Reaktion hat sich als die vielseitigste für die Synthese von Indolderivaten erwiesen, obwohl die Reaktion selbst kein Indol produzieren kann. Theoretisch würde Acetaldehydphenylhydrazon durch die Fischer-Synthese Indol ergeben, in Wirklichkeit wird jedoch keins erhalten.
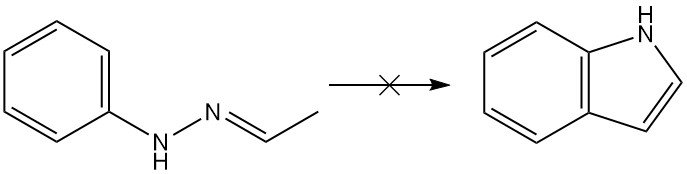
Die Fischer-Indolsynthese ist eine klassische Methode zur Herstellung von Indolen, bei der ein N-Arylhydrazon unter sauren Bedingungen zyklisiert wird, um ein Indol zu bilden.
Der Schlüsselschritt bei der Fischer-Indolsynthese ist eine [3,3]-sigmatrope Umlagerung des Enhydrazon-Tautomers des Hydrazons. Damit die Zyklisierung stattfinden kann, muss mindestens ein α-Wasserstoffatom an der C-N-Bindung vorhanden sein. Die Regioselektivität der Reaktion wird durch die Substituenten am Hydrazon-Kohlenstoff beeinflusst.
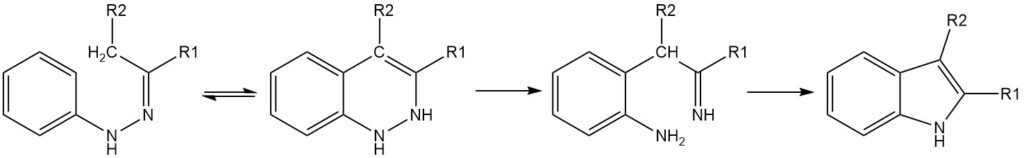
Wenn sich nur ein Wasserstoffatom α zur C-N-Bindung befindet, ist das Produkt ein 3,3-disubstituiertes 3H-Indol. Wenn beide Substituenten am Hydrazonkohlenstoff ein oder mehrere α-Wasserstoffe aufweisen, können Produktgemische entstehen.
Im Allgemeinen ist es wahrscheinlicher, dass der stärker verzweigte Substituent eine Cyclisierung durchmacht. Beispielsweise ergeben Phenylhydrazone, die von Methylalkylketonen abgeleitet sind, typischerweise 2-Methylindole. Die Selektivität kann jedoch unter bestimmten Reaktionsbedingungen umgekehrt werden.
Das Vorhandensein von Substituenten am Phenylring des Hydrazons kann auch die Regioselektivität der Fischer-Indolsynthese beeinflussen. Meta-Substituenten können zur Bildung isomerer Indole führen, während Ortho-Substituenten die Reaktion komplizierter machen.
3.4. Biosynthese von Indol aus Tryptophan
Eine der Hauptquellen von Indol in biologischen Systemen ist die Aminosäure Tryptophan. Die Umwandlung von Tryptophan in Indol erfolgt durch eine Reihe enzymatischer Reaktionen, die als Tryptophanabbauweg bekannt sind. Dieser Weg kommt hauptsächlich in Bakterien und Pilzen vor, kann aber auch in bestimmten Geweben von Säugetieren wie Leber und Darm aktiv sein.
Der erste Schritt in diesem Weg ist die Spaltung von Tryptophan durch das Enzym Tryptophanase. Diese Reaktion erzeugt Indol, Pyruvat und Ammoniak.
Zusätzlich zum Tryptophanaseweg kann Tryptophan auch über den Kynureninweg abgebaut werden, der hauptsächlich an der Produktion von Niacin (Vitamin B3) beteiligt ist, aber auch Indolderivate produziert.
4. Verwendung von Indol
Indol wird in verschiedenen Industriezweigen verwendet, darunter in der Pharmazie, Parfümerie und Aromaherstellung. Es ist außerdem ein natürlicher Bestandteil mehrerer Substanzen wie Tabakrauch, Jasminöl und Orangenblütenöl. Es ist ein bakterielles Abbauprodukt von Tryptophan im Darm.
Aufgrund seines angenehmen Aromas wird Indol seit vielen Jahren als Duftfixiermittel verwendet. Es wird auch als synthetisches Aromamittel verwendet.
Indol kann als Kairomone wirken, eine flüchtige Chemikalie, die von Pflanzen freigesetzt wird, um phytophage Insekten anzulocken.
Indol ist ein Vorläufer für die Synthese der essentiellen Aminosäure Tryptophan. Sowohl chemische als auch biotechnologische Methoden können verwendet werden, um Tryptophan aus Indol herzustellen.
Indol wird verwendet, um Pflanzenwachstumsregulatoren wie Indol-3-Essigsäure und Indol-3-Buttersäure zu synthetisieren. Indolin, ein Derivat von Indol, wird bei der Synthese von fungiziden und bakteriziden Pflanzenschutzmitteln verwendet.
Indolderivate haben eine breite Palette pharmazeutischer Anwendungen, wie zum Beispiel:
- Indomethacin und andere Indolderivate werden als milde Analgetika verwendet.
- Indolin und seine Derivate werden bei der Synthese von blutdrucksenkenden Medikamenten verwendet.
- Tryptamin, ein Derivat von Indol, wird bei der Synthese des Vasodilatators Vincamin verwendet.
- Pyridylalkylindole, die aus Indol gewonnen werden, werden als Antidepressiva, Antihistaminika und Antihypertensiva verwendet.
- 3-Peridinylindole, die aus Indol gewonnen werden, werden zur Vorbeugung von Anoxie verwendet.
- 5-Chlorindol, ein Derivat von Indol, wird bei der Herstellung von Beruhigungsmitteln, blutdrucksenkenden Medikamenten und Antiemetika sowie bei der Behandlung der Parkinson-Krankheit verwendet.
Indol und seine Derivate werden als Zwischenprodukte bei der Synthese verschiedener Farbstoffe verwendet, darunter kationische Diazofarbstoffe, Cyaninfarbstoffe, Indolylmethanfarbstoffe und Carbazolphthaleinfarbstoffe.
5. Toxikologie von Indol
Die Bevölkerung kann Indol durch Einatmen von Umgebungsluft oder Tabakrauch, durch Einnahme kontaminierter Lebensmittel und durch Hautkontakt mit Dämpfen, Lebensmitteln, Parfüms oder anderen Produkten, die Indol enthalten, ausgesetzt sein. Berufliche Exposition kann an Arbeitsplätzen auftreten, an denen Indol hergestellt oder verwendet wird.
Indol kann auf verschiedenen Wegen aufgenommen werden, darunter durch Einatmen, Einnahme und Hautkontakt.
Aus dem Magen-Darm-Trakt aufgenommenes Indol wird in der Leber zu Indoxyl metabolisiert, das dann mit Sulfat konjugiert wird, um Indican zu bilden. Diese Metaboliten werden hauptsächlich über den Urin ausgeschieden.
Indol wird leicht aus dem Magen-Darm-Trakt aufgenommen und unterliegt einem schnellen Metabolismus in der Leber. Zu den Hauptmetaboliten von Indol zählen Indican und Oxindol, die hauptsächlich über den Urin ausgeschieden werden.
Die akute orale LD50 von Indol bei Ratten und Mäusen beträgt etwa 1000–1100 mg/kg bzw. 500 mg/kg. Autopsiestudien nach akuter Exposition ergaben Blutungen und Hyperämie in inneren Organen und Geweben. Indol hat einen unangenehmen Geruch und kann in geringen Konzentrationen Übelkeit verursachen.
Indol kann bei topischer Anwendung leichte vorübergehende Reizungen der Haut und der Augen verursachen. Im Gegensatz zu seinem methylierten Derivat Skatol verursacht Indol bei Rindern nach wiederholter oraler Verabreichung keine Lungenschäden.
Hohe chronische Dosen von Indol (20–200 mg/kg/Tag über mehr als drei Monate) bei Mäusen, Ratten, Kaninchen und Hunden wurden mit hämatologischen Wirkungen in Verbindung gebracht, darunter Anämie, Leukozytose und Leukopenie. Bei Rindern wurden nach wiederholter oraler Verabreichung Hämolyse und hämoglobinurische Nephrose beobachtet.
Obwohl es keine eindeutigen experimentellen Beweise für die Karzinogenität von Indol gibt, kann es die Bildung von Tumoren beeinflussen, die durch andere Wirkstoffe verursacht werden. Hohe Indol-Dosen (800 mg/kg/Tag) haben in Tiermodellen die Entwicklung von Hauttumoren und Blasenkarzinomen beschleunigt.
In Bezug auf die Genotoxizität wurde festgestellt, dass Indol im Ames-Test die mutagenen Wirkungen anderer Wirkstoffe verstärkt. Indol selbst war jedoch im Ames-Test oder in einem Zelltransformationstest nicht mutagen. In einem DNA-Reparaturtest verursachte Indol bei Bacillus subtilis reparierbare DNA-Schäden.
Indol wurde von der Flavor and Extract Manufacturer’s Association (FEMA) der GRAS-Status (allgemein als sicher anerkannt) zuerkannt und es ist zur Verwendung als Aromastoff in Lebensmitteln zugelassen. Es gibt jedoch keine spezifischen Grenzwerte für die berufliche Exposition von Indol, die von Aufsichtsbehörden festgelegt wurden.
Referenzen
- Indole; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_167
- Indole; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0914041519211404.a01
- Indole; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543008605
- Indole; Chemistry of Heterocyclic Compounds, Volume 8. – https://onlinelibrary.wiley.com/doi/10.1002/9780470186572.ch1
- https://www.sciencedirect.com/science/article/abs/pii/S092809871630207X
- https://www.sciencedirect.com/science/article/abs/pii/S0040403921007413
