Herstellung und Verwendung von Ammoniumchlorid

Ammoniumchlorid, NH4Cl, kommt natürlicherweise in vulkanischem Material vor, seine Gewinnung aus natürlichen Quellen hat jedoch nur eine untergeordnete Bedeutung. Die industrielle Produktion von NH4Cl ist eng mit der Weiterentwicklung der Sodaindustrie und der großtechnischen Synthese von synthetischem NH3 verbunden.
Ursprünglich als Düngemittel gedacht, findet Ammoniumchlorid heute vielfältige Anwendungsmöglichkeiten. Seine Produktionsprozesse sind aufgrund ihrer historischen Bedeutung als frühes Beispiel der chemischen Verarbeitung, die alle drei Phasen umfasst: fest, flüssig und gasförmig, für die Chemietechnik von besonderem Interesse.
Inhaltsverzeichnis
1. Eigenschaften von Ammoniumchlorid
Die Molmasse von Ammoniumchlorid beträgt 53,49 g/mol und es ist ein Feststoff mit einer spezifischen Dichte von 1,530 bei 20 °C. Seine durchschnittliche spezifische Wärme cp zwischen 298 K und 372 K wird mit 1,63 kJ/kg gemessen. Ammoniumchlorid hat zwei reversible kristalline Formen, wobei die Umwandlung zwischen ihnen bei 457,6 K (184,5 °C) erfolgt.
Die bei Raumtemperatur stabile Form ist die α-Form, während das β-NH4Cl (kubisch; NaCl-Typ) bei 793,2 K unter 3,45 MPa schmilzt und bei Atmosphärendruck sublimiert. Bei niedrigeren Temperaturen ist NH4Cl relativ flüchtig und zerfällt in NH3 und HCl.
Die Löslichkeit von NH4Cl in Wasser nimmt mit steigender Temperatur zu. Die integrale Lösungswärme bis zur Sättigung beträgt +15,7 kJ/mol und die differentielle Lösungswärme bei Sättigung beträgt +15,2 kJ/mol.
Die Zugabe von Ammoniak kann die Löslichkeit in Wasser erhöhen, während die Anwesenheit von NaCl dazu neigt, NH4Cl aus ammoniakalischen Lösungen auszufällen. NH4Cl zeigt auch schwache hygroskopische Eigenschaften.
Feuchtigkeit kann zum Zusammenbacken des Produkts führen, und es ist ungewiss, ob Feuchtigkeitsgehalte unter 0,1 Gew.-% allein für das Zusammenbacken von Ammoniumchlorid verantwortlich sind. Sublimation könnte eine weitere mögliche Erklärung für dieses Phänomen sein.
Ammoniumchlorid ist in flüssigem NH3 gut löslich, in Aceton und Pyridin jedoch praktisch unlöslich. Bei 292,7 K weist es eine Löslichkeit von 3,24 Gew.-% in Methanol und 0,64 Gew.-% in Ethanol auf.
Die aus wässrigen NH4Cl-Lösungen erhaltene Kristallform kann durch andere Substanzen beeinflusst werden, was zur Bildung großer Kristalle ausgenutzt wurde und bei der Identifizierung von Verunreinigungen während der NH4Cl-Produktion hilft.
2. Herstellung von Ammoniumchlorid
Die kommerzielle Produktion von Ammoniumchlorid umfasst zwei Hauptprozesse:
1. Modifizierter Solvay-Prozess (Ammoniak-Soda-Asche-Prozess oder ASAP): Dies ist eine der am weitesten verbreiteten Methoden für die kommerzielle NH4Cl-Produktion. Dabei entsteht durch die Reaktion von Ammoniak und Soda (Natriumcarbonat) Ammoniumbicarbonat, das dann durch Erhitzen in Ammoniumchlorid umgewandelt wird.
2. Direkte Reaktion zwischen HCl und NH3: Bei diesem Verfahren entsteht Ammoniumchlorid direkt durch die Reaktion zwischen Salzsäure (HCl) und Ammoniak (NH3).
Darüber hinaus gibt es einen dritten Prozess, die Reaktion reziproker Salzpaare, der aus wissenschaftlicher Sicht immer noch von Interesse ist, jedoch noch nicht kommerziell für die Ammoniumchloridproduktion eingesetzt wird.
2.1. Modifizierter Solvay-Prozess (Ammoniak – Soda)
Beim Solvay-Verfahren erfolgt die Herstellung von Ammoniumchlorid und Natriumcarbonat durch eine Reihe von Reaktionen. Ammoniak und Kohlendioxid werden in einer wässrigen Natriumchloridlösung gelöst, wodurch schwerlösliches Natriumbicarbonat entsteht.
Dieses Natriumbicarbonat wird dann erhitzt (kalziniert), um Natriumcarbonat zu ergeben. Aus der verbleibenden Flüssigkeit (Mutterlauge) wird Ammoniak durch Reaktion mit Kalk gewonnen, wobei ebenfalls Calciumchlorid entsteht.
Die Hauptquellen für Kalk und Kohlendioxid sind Kalkstein. Die Gesamtreaktion umfasst die Umwandlung von Steinsalz und Kalkstein in Natriumcarbonat und Calciumchlorid als Nebenprodukte.
Um Pflanzenverluste auszugleichen, werden nur die notwendigen Mengen an Wasser, Kohlendioxid und Ammoniak hinzugefügt. Die Wahl des Rohstoffs und der daraus resultierenden Produkte bestimmen den Standort einer Solvay-Anlage und machen diese Anlagen zu weitgehend unabhängigen Einheiten.
Das modifizierte Solvay-Verfahren, bekannt als Ammoniumchlorid-Soda-Verfahren, ist ein frühes Beispiel einer integrierten industriellen Produktion mit zwei Stoffen. Bei diesem modifizierten Verfahren wird zusätzlich Ammoniumchlorid aus der Mutterlauge ausgefällt. Die Gesamtreaktion für diesen Prozess ist:
2NH3 + CO2 + H2O + 2NaCl → 2NH4Cl + Na2CO3
Die erzeugten Mengen an Ammoniumchlorid und Soda sind nahezu gleich: Für jedes Mol (106 g) Na2CO3 werden zwei Mol (107 g) NH4Cl erzeugt. Der geänderte Prozess erfordert externen NH3 und CO2 und muss in ein System vernetzter Anlagen integriert werden.
Darüber hinaus erfolgt die Behandlung ammoniakhaltiger Abgase aus Umweltschutzgründen und nicht nur zur Reduzierung von NH3- und CO2-Verlusten. Die Energiebilanz des modifizierten Prozesses unterscheidet sich aufgrund der unterschiedlichen Einsatzstoffe und Produkte erheblich von der des traditionellen Solvay-Prozesses.
2.1.1. Prozessbeschreibung
Bei der Herstellung von NH4Cl und Na2CO3 kommt ein kontinuierlich betriebener Kreislaufprozess zum Einsatz, wobei die Konzentrationen danach angepasst werden, ob Ammoniumchlorid oder Natriumcarbonat das Hauptprodukt ist. Dieser Prozess wurde ursprünglich von BASF entwickelt und konzentriert sich auf NH4Cl als Hauptprodukt (Abbildung 1).
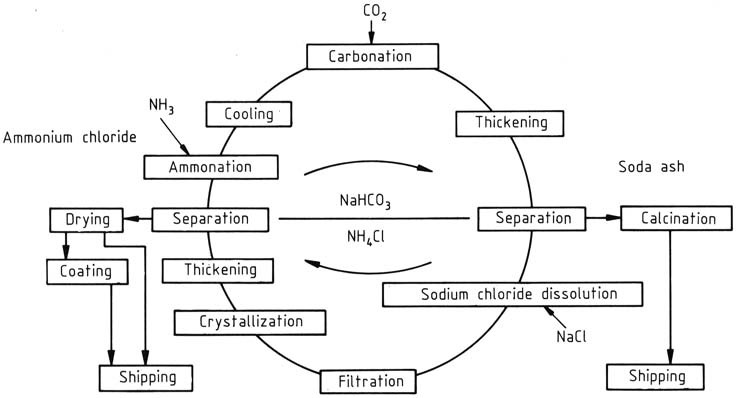
Der Zyklus beginnt mit der Zugabe von Ammoniak und Kohlendioxid zu einer wässrigen Recyclinglösung. Gebildetes Ammoniumbicarbonat reagiert weiter mit Natriumchlorid in der Lösung, was zur Bildung von Ammoniumchlorid und schwerlöslichem Natriumbicarbonat führt. Letzteres wird mithilfe einer Zentrifuge abgetrennt, gewaschen und anschließend kalziniert, um Natriumcarbonat herzustellen.
Durch Erhitzen des restlichen Natriumbicarbonats in der Mutterlauge auf 337,2 K wird es zersetzt. Das gut lösliche Natriumcarbonat stört die Kristallisation von Ammoniumchlorid nicht.
Die hohe Temperatur der Lösung wird genutzt, um Steinsalz-Ausgangsmaterial schnell aufzulösen, das über Mischtanks zugeführt wird, wobei die Menge basierend auf der Materialbilanz über den gesamten Zyklus angepasst wird.
Unlösliche Verunreinigungen wie Sulfate, Eisen-, Calcium- und Magnesiumsalze werden herausgefiltert. Der zunehmenden Entsorgung von Reststoffen wird durch die Verwendung von reinem Salz als Rohstoff anstelle von Steinsalz begegnet.
Ammoniumchlorid wird durch zweistufige Kristallisation mit indirekter Kühlung gewonnen. Die aus dem Kristallisator resultierende Suspension wird in Hydrozyklonen eingedickt, der Feststoff abgetrennt und in einer Zentrifuge gewaschen.
Der Feststoff mit einem Wassergehalt von etwa 5–7 Gew.-% wird dann in einem Stromtrockner getrocknet, um den Feuchtigkeitsgehalt auf weniger als 0,1 % zu reduzieren. Das Endprodukt kann mit einer Antibackmittelbeschichtung versehen werden. Nach der Entfernung des Ammoniumchlorids ist der Zyklus abgeschlossen und die Mutterlauge kann wiederverwendet werden.
Asahi Glass hat ein alternatives Verfahren entwickelt, das Soda als Hauptprodukt produziert. Bei diesem Verfahren wird der Mutterlauge vor der Kristallisation des Ammoniumchlorids Ammoniak zugesetzt. Zerkleinertes Rohsalz kann mit oder ohne Waschen hinzugefügt werden und wird in der Lösung gelöst.
Das Abkühlen der Lösung auf unter 20 °C führt zur Kristallisation von Ammoniumchlorid. Die Kristalle werden mit einem Zentrifugalabscheider abgetrennt und die Mutterlauge in den Karbonisierungsbereich zurückgeführt. Ammoniumchloridkristalle werden in einem Rotations- oder Wirbelschichttrockner getrocknet, um den Feuchtigkeitsgehalt auf weniger als 0,3 % zu reduzieren. Die Größe der Kristalle kann für verschiedene Anwendungen gesteuert werden.
Im Karbonisierungsabschnitt wird die Lösung in einen Karbonisierungsturm geleitet, wo Natriumbikarbonat durch Reaktion mit Kohlendioxid bei 30–40 °C ausfällt.
Die resultierende Aufschlämmung wird in Natriumbicarbonatkristalle und die Mutterlauge getrennt. Die Mutterlauge wird in den Ammoniak-Absorptionsbereich geleitet. Die abgetrennten Kristalle werden kalziniert und in dichte Soda umgewandelt.
Der Asahi Glass-Prozess umfasst alle Schritte des in Abbildung 1 dargestellten BASF-Prozesses mit einer anderen Reihenfolge. Nach der Abtrennung von Natriumbicarbonat wird Ammoniak zugegeben. Die bei der Ammoniakzugabe freigesetzte Wärme liefert die Energie, die zur Zersetzung des verbleibenden Natriumbicarbonats erforderlich ist.
Während durch diesen Ansatz Energieeinsparungen beobachtet werden, gleicht der höhere Energiebedarf in der Kristallisationsstufe einige der Vorteile aus, da Ammoniumchlorid in ammoniakreichen Lösungen besser löslich ist.
Der Prozess kann einen Waschschritt für die Steinsalzbeschickung vor der Lösung umfassen, um die Notwendigkeit einer Filtration vor der Kristallisation zu vermeiden. Mit oder ohne Waschen maximiert dieser Prozess die Nutzung von Rohsalz, ein wichtiger Aspekt in Japan, wo Salz importiert werden muss.
2.1.2. Verschmutzungsprobleme
Die mit dem Betrieb der Anlagen verbundenen Verschmutzungsprobleme sind nicht gravierend und können durch sorgfältigen Betrieb wirksam bewältigt werden. Mit geeigneten Maßnahmen kann die Entstehung von Abwasserströmen erheblich reduziert, wenn nicht sogar ganz verhindert werden. Allerdings muss jedes Abwasser, das aufgrund seines hohen Ammoniakgehalts anfällt, entsprechend behandelt werden.
Um gasförmigen Emissionen entgegenzuwirken, besteht eine praktische Lösung darin, Abgase mit Salzsäure zu waschen, was zur Produktion von zusätzlichem Ammoniumchlorid führt.
Typischerweise werden hohe Ammoniakumwandlungen von etwa 98 % und Steinsalzumwandlungen von etwa 95 % erreicht, wobei die genauen Werte je nach spezifischem Prozesstyp und den umgesetzten Umweltmaßnahmen variieren können. Dieser Ansatz trägt zur Minimierung gasförmiger Emissionen bei und trägt zur allgemeinen Umweltverträglichkeit des Herstellungsprozesses bei.
2.1.3. Sorten und Kapazität
Ab 1997, nachdem mehrere Produktionsanlagen aufgrund der geringeren Marktnachfrage geschlossen wurden, betrug die geschätzte Kapazität für die NH4Cl-Produktion nach dem modifizierten Solvay-Verfahren in der westlichen Hemisphäre und in Japan etwa 100.000 Tonnen pro Jahr.
In Asien ist die Herstellung eines körnigen Produkts mit über 97 % NH4Cl-Gehalt üblich. Dieses NH4Cl in Düngemittelqualität enthält typischerweise mehr als 25 Gew.-% Ammoniakstickstoff. Diese Anlagen konzentrieren sich hauptsächlich auf die Produktion von Soda, wobei NH4Cl als Nebenprodukt entsteht.
Liegt das Hauptinteresse jedoch in der NH4Cl-Produktion, kann der Prozess so angepasst werden, dass höhere Reinheiten erzielt werden. Es können Reinheitsgrade von mehr als 99,7 Gew.-% NH4Cl mit weniger als 0,25 Gew.-% NaCl und weniger als 3 ppm Fe erreicht werden, was für die meisten industriellen Zwecke geeignet ist.
Für spezielle Anwendungen, die NH4Cl in Reagenzienqualität erfordern, ist eine Produktion im großen Maßstab mit speziellen Betriebstechniken möglich, ohne dass zusätzliche Verarbeitungsschritte erforderlich sind.
Es kann Ammoniumchlorid in Reagenzienqualität mit weniger als 0,01 Gew.-% NaCl erhalten werden, das der ACS-Spezifikation (American Chemical Society) entspricht. Dieses hochreine NH4Cl eignet sich für Anwendungen, die außergewöhnliche Qualität und Präzision in chemischen Prozessen erfordern.
2.2. Direkte Reaktion zwischen HCl und NH3
Die Synthese von NH4Cl aus HCl und NH3 kann wirtschaftlich vorteilhaft sein, insbesondere wenn HCl als Ausgangsstoff kostengünstig oder kostenlos verfügbar ist.
Das von der brasilianischen Firma Engeclor entwickelte Engeclor-Verfahren führt die Reaktion in einer wässrigen Lösung durch. Ammoniak wird in den konischen Teil eines Sättigers eingeleitet, während mit Luft verdünntes HCl in die NH4Cl-Suspension eingeleitet wird.
Die Reaktion findet bei 353 K unter vermindertem Druck statt, mit einem Überschuss an NH3, um einen pH-Wert von 8 aufrechtzuerhalten. Die resultierende Suspension wird vom Boden des Sättigers abgezogen, mit Hydrozyklonen eingedickt und NH4Cl wird in einer Zentrifuge von der Mischung abgetrennt und dann getrocknet.
Die Mutterlauge wird zum Sättiger zurückgeführt. Um die Emissionen zu kontrollieren, werden die Abgase des Sättigers mit Wasser gewaschen.
Es wurden alternative Schemata vorgeschlagen, bei denen gasförmige Ausgangsstoffe in nichtwässrige Lösungsmittel eingeführt werden. In diesen Fällen wird die Reaktionswärme (-176 kJ/mol) durch Verdampfen der Lösungsmittel abgeführt und anschließend kondensiert.
Zu diesem Zweck wurden auch einige Wirbelschichtverfahren beschrieben. Um die Aerosolbildung zu verhindern, wird in Wirbelschichten Kohlendioxid als Trägergas vorgeschlagen.
Die geschätzte globale Jahresproduktion von NH4Cl durch das HCl-NH3-Verfahren betrug 1997 50.000 Tonnen. Mit dieser Methode hergestelltes NH4Cl enthält weniger als 0,1 Gew.-% NaCl.
Der Metallgehalt, insbesondere der Schwermetallgehalt, kann je nach Pflanze variieren. Im Allgemeinen sind die Metallgehalte in NH4Cl, das durch dieses Verfahren erzeugt wird, höher als diejenigen im modifizierten Solvay-Verfahren.
2.3. Reaktion reziproker Salzpaare
Die Reaktion reziproker Salzpaare bleibt eine interessante Methode. Zu den geeigneten Salzpaaren gehören (NH4)2SO4 – KCl, was zur Bildung von NH4Cl – K2SO4 führt, und (NH4)2SO4 – NaCl, was zur Bildung von NH4Cl – Na2SO4 führt.
Die Herausforderung bei diesen Salzpaaren ist die geringere Reinheit von NH4Cl aufgrund des relativ hohen Sulfatgehalts. NH4Cl und KNO3 können durch die Reaktion von NH4NO3 und KCl erhalten werden. Zur Herstellung von Sprengstoffen kann hochreines KNO3 verwendet werden, als Düngemittel eignet sich NH4Cl mit einer Reinheit von mindestens 96 %.
Darüber hinaus war die Herstellung von NaNO3 und NH4Cl aus NaCl und NH4NO3 Gegenstand von Untersuchungen. Dieses Verfahren untersucht die Möglichkeit, diese beiden Salze aus ihren jeweiligen Vorläufersalzen zu gewinnen.
3. Verwendung von Ammoniumchlorid
Ammoniumchlorid findet umfangreiche landwirtschaftliche und industrielle Anwendungen:
3.1. Landwirtschaftliche Nutzung
In Japan, China und Südostasien wird Ammoniumchlorid häufig als hochwirksamer Stickstoffdünger für Rohr- und Hochlandreis, Weizen und verschiedene andere Nutzpflanzen verwendet.
In Japan wird ein erheblicher Teil der jährlichen NH4Cl-Produktion für hochwertige Mehrnährstoffdünger wie Chlor-Ammoniumphosphat, Chlor-Kalium-Ammoniumphosphat, Magnesia-Chlor-Kalium-Ammoniumphosphat und Stickstoff-Kalium-Mischungen verwendet. Aufgrund seines Säuregehalts und des hohen Chlorgehalts ist seine Verwendung als Düngemittel jedoch begrenzt.
3.2. Industrielle Nutzung
Technisches Ammoniumchlorid wird in verschiedenen industriellen Anwendungen eingesetzt:
- Festelektrolyte: Sie dienen als lebenswichtiger Bestandteil in Trockenbatterien.
- Abbausprengstoffe: Eine feine Form von Ammoniumchlorid wird als Bestandteil von Sprengstoffen für Abbauzwecke verwendet.
- Härter für Klebstoffe: Es dient als Härter in Klebstoffen auf Formaldehydbasis.
- Ätzlösungen: Ammoniumchlorid wird zusammen mit anderen Chemikalien bei der Herstellung von Leiterplatten verwendet.
- Flussmittel beim Galvanisieren: Es ist zusammen mit Zinkchlorid ein Bestandteil von Flussmitteln, die zum Verzinnen und Verzinken verwendet werden.
- Fotografie: Es dient als Schnellfixierzusatz in der Fotografie.
- Reinigerzusätze: Ammoniumchlorid wird als Zusatz in Reinigungsmitteln verwendet.
- Nährstoff in Hefekulturen: Es wird als Nährstoff in Hefekulturen für verschiedene Anwendungen verwendet.
- Gerberei: In der Gerbereiindustrie findet Ammoniumchlorid Anwendung.
- Raffinierung von Edelmetallen: Wird bei der Raffinierung von Edelmetallen verwendet.
- Textildruck und -färben: Ammoniumchlorid wird beim Textildruck und -färben verwendet.
- Gummiindustrie: Es findet Anwendung in der Gummiindustrie.
- Fliesen und Ziegel: Den Fliesen und Ziegeln kann vor dem Brennen Ammoniumchlorid zugesetzt werden, um die Porosität zu kontrollieren und den Brennvorgang zu beschleunigen.
3.3. Hochreine Anwendungen
Hochreines Ammoniumchlorid wird in der Lebensmittel- und Pharmaindustrie sowie bei speziellen chemischen Synthesen eingesetzt.
Bemerkenswert ist, dass der Einsatz von NH4Cl als Härter für formaldehydbasierte Klebstoffe aufgrund der Substitution durch chloridfreie Produkte deutlich zurückgegangen ist.
Verweise
- Ammonium Compounds; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_243
- Process of making ammonium chloride. – https://patents.google.com/patent/US2133513A/en
FAQ
Ammoniumchlorid (NH4Cl) ist eine chemische Verbindung aus Ammoniak (NH3) und Salzsäure (HCl). Es liegt als weißer kristalliner Feststoff mit einem charakteristischen salzigen Geschmack vor und wird allgemein als Salmiak bezeichnet.
Ja, Ammoniumchlorid ist ein Salz. Es entsteht durch die Reaktion einer Säure (HCl) und einer Base (NH3).
NH4Cl ist eine Säure. Es entsteht durch die Reaktion einer starken Säure, nämlich Salzsäure (HCl), mit einer schwachen Base, nämlich Ammoniumhydroxid (NH4OH).
Ammoniumchlorid hat vielfältige Einsatzmöglichkeiten:
- Es dient als wirksamer Stickstoffdünger für verschiedene Nutzpflanzen, darunter Reis, Weizen und mehr.
- Im industriellen Bereich wird es in Trockenbatterien, Sprengstoffen, Klebstoffen, bei der Herstellung von Leiterplatten und in Beschichtungsprozessen eingesetzt.
- Es findet Verwendung in der Fotografie, bei Reinigungszusätzen, Hefekulturen, beim Gerben, bei der Raffinierung von Edelmetallen, beim Textildruck und in der Gummiindustrie.
- Hochreines Ammoniumchlorid wird in Lebensmitteln, Arzneimitteln und spezifischen chemischen Synthesen verwendet.
Ammoniumchlorid kann durch verschiedene Methoden hergestellt werden, darunter die Reaktion von Ammoniakgas (NH3) mit Salzsäure (HCl) in einer wässrigen Lösung. Das resultierende Ammoniumchlorid wird dann abgetrennt und zur Verwendung getrocknet.
Ammoniumchlorid sollte gemäß den örtlichen Vorschriften und Richtlinien für die Entsorgung chemischer Abfälle entsorgt werden. Es ist wichtig, die richtigen Verfahren einzuhalten, um eine Umweltverschmutzung zu vermeiden.
Beim Erhitzen sublimiert Ammoniumchlorid, d. h. es geht direkt vom Feststoff in den gasförmigen Zustand über, ohne zu schmelzen. Es zerfällt in die Gase Ammoniak (NH3) und Chlorwasserstoff (HCl).
Ammoniumchlorid erscheint als weißer kristalliner Feststoff oder Pulver mit körniger Textur. Es ist geruchlos und hat einen ausgeprägten salzigen Geschmack.
