Adipinsäure: Eigenschaften, Herstellung und Verwendung

Adipinsäure, auch Hexandisäure oder 1,4-Butandicarbonsäure genannt, hat die chemische Formel C6H10O4 und eine Molmasse von 146,14 g/mol. Als weit verbreitete aliphatische Dicarbonsäure ist sie von großer Bedeutung.
Während sein Vorkommen in der Natur begrenzt ist, wird es weltweit in großem Maßstab synthetisiert. Die Hauptanwendung dieser Verbindung ist die Herstellung von Nylon 66-Polyamid, das Anfang der 1930er Jahre von W. H. Carothers von DuPont entdeckt wurde.
Seitdem hat sich die Herstellung von Nylon-66-Polyamidfasern weltweit zu einem dominierenden Prozess in der Kunstfaserindustrie entwickelt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Adipinsäure
Adipinsäure wird in Form von farb- und geruchlosen Kristallen mit einem charakteristischen sauren Geschmack gewonnen. Es zeigt eine hohe Löslichkeit in Methanol und Ethanol und ist auch in Wasser und Aceton löslich.
Allerdings ist seine Löslichkeit in Cyclohexan und Benzol recht begrenzt. Bei der Kristallisation bildet Adipinsäure monokline Prismen, wenn Wasser, Ethylacetat oder Aceton/Petrolether als Lösungsmittel verwendet werden.
Hier sind einige seiner physikalischen Eigenschaften:
| Eigenschaft | Wert |
|---|---|
| mp, °C | 152,1 |
| BP, °C bei 101,3 kPa | 337,5 |
| BP, °C bei 13,3 kPa | 265 |
| BP, °C bei 2,67 kPa | 222 |
| BP, °C bei 0,67 kPa | 191 |
| BP, °C bei 0,133 kPa | 159,5 |
| Relative Dichte (170 °C) | 1,085 |
| Schüttdichte, kg/m³ | 600–700 |
| Löslichkeit, g/100 g Wasser bei 15 °C | 1,42 |
| Löslichkeit, g/100 g Wasser bei 40 °C | 4,5 |
| Löslichkeit, g/100 g Wasser bei 60 °C | 18.2 |
| Löslichkeit, g/100 g Wasser bei 80 °C | 73 |
| Löslichkeit, g/100 g Wasser bei 100 °C | 290 |
| Dissoziationskonstanten k1 | 4,6 × 10-5 |
| Dissoziationskonstanten k2 | 3,6 × 10-6 |
| Spezifische Wärme der Flüssigkeit (200 °C), kJ kg⁻¹ K⁻¹ | 2.719 |
| Spezifische Dampfwärme (300 °C), kJ kg⁻¹ K⁻¹ | 1.680 |
| Schmelzwärme, kJ/kg | 115 |
| Verdampfungswärme, kJ/kg | 549 |
| Lösungswärme in Wasser, kJ/kg bei 10 - 20 °C | -214 |
| Lösungswärme in Wasser, kJ/kg bei 90 - 100 °C | -241 |
| Schmelzviskosität, mPa · s bei 160 °C | 4,54 |
| Schmelzviskosität, mPa·s bei 193 °C | 2,64 |
2. Chemische Reaktionen von Adipinsäure
Adipinsäure ist unter atmosphärischen Bedingungen stabil, doch beim Erhitzen der geschmolzenen Säure über 230 – 250 °C kommt es zu einem gewissen Grad an Decarboxylierung, was zur Bildung von Cyclopentanon mit einem Siedepunkt von 131 °C führt.
Diese Reaktion wird insbesondere durch Metallsalze wie Eisen, Kalzium und Barium katalysiert.
Im Vergleich zu Glutar- oder Bernsteinsäure zeigt Adipinsäure eine deutlich geringere Neigung, durch Wasserverlust zyklische Anhydride zu bilden.
Adipinsäure zeigt eine Reaktivität an einer oder beiden Carbonsäuregruppen und beteiligt sich an der Bildung von Salzen, Estern, Amiden, Nitrilen und anderen Verbindungen.
Im Allgemeinen widersteht es der Wirkung der meisten Oxidationsmittel, was durch seine Produktion in Salpetersäure belegt wird. Wenn Adipinsäure jedoch Salpetersäure über 180 °C ausgesetzt wird, erfährt sie einen autokatalytischen Angriff, der Kohlendioxid, Wasser und Stickoxide erzeugt.
3. Produktion von Adipinsäure
In den Anfangsstadien der kommerziellen Adipinsäureproduktion umfasste ein zweistufiger Prozess die Luftoxidation von Cyclohexan. Der erste Schritt war die Oxidation von Cyclohexan zu Cyclohexanol und Cyclohexanon bei geringer Umwandlung, gefolgt von einem Hochumwandlungsprozess, bei dem die Mischung an der Luft oxidiert wurde, um Adipinsäure zu ergeben.
Seit dem Jahr 2000 erfolgt jedoch bei der großtechnischen Herstellung von Adipinsäure die Salpetersäureoxidation von Cyclohexanol, Cyclohexanon oder einer Mischung beider Substanzen, die als Keton-Alkohol-Öl (KA) bekannt ist.
Die Hauptunterschiede zwischen diesen kommerziellen Verfahren liegen in der Methode zur Herstellung des KA-Öls. Typischerweise stammen die sechs Kohlenstoffatome, die das Adipinsäuregerüst bilden, aus Benzol, das zu Cyclohexan hydriert wird, oder aus Phenol, das zu Cyclohexanol hydriert wird.
Anschließend wird Cyclohexan mit Luft oxidiert, um das KA-Öl herzustellen. In den letzten zwei Jahrzehnten gab es einen spürbaren Wandel hin zum kostengünstigeren Verfahren auf Cyclohexanbasis.
3.1. Salpetersäureoxidation von Cyclohexanol
3.1.1. Reaktionsmechanismus
Der zweite Schritt des herkömmlichen Adipinsäure-Produktionsprozesses, der Ende der 1940er Jahre von DuPont entwickelt wurde, umfasst die Oxidation von Cyclohexanol, Cyclohexanon oder einer Mischung aus beiden unter Verwendung von Salpetersäure. Adipinsäure wird mit einer Ausbeute von über 90 % gewonnen.
Bei diesem Prozess entstehen als Hauptnebenprodukte Kohlendioxid, Stickoxide und einige Dicarbonsäuren mit niedrigerem Molekulargewicht. Darüber hinaus werden auch bestimmte Nebenprodukte erkannt, die durch im Ausgangs-KA-Öl vorhandene Verunreinigungen entstehen.
Der chemische Mechanismus dieser Reaktion wurde erstmals 1956 diskutiert, einschließlich Überlegungen zur Kinetik und zum Reaktordesign. Abbildung 1 gibt einen Überblick über die Ergebnisse dieser Untersuchungen.
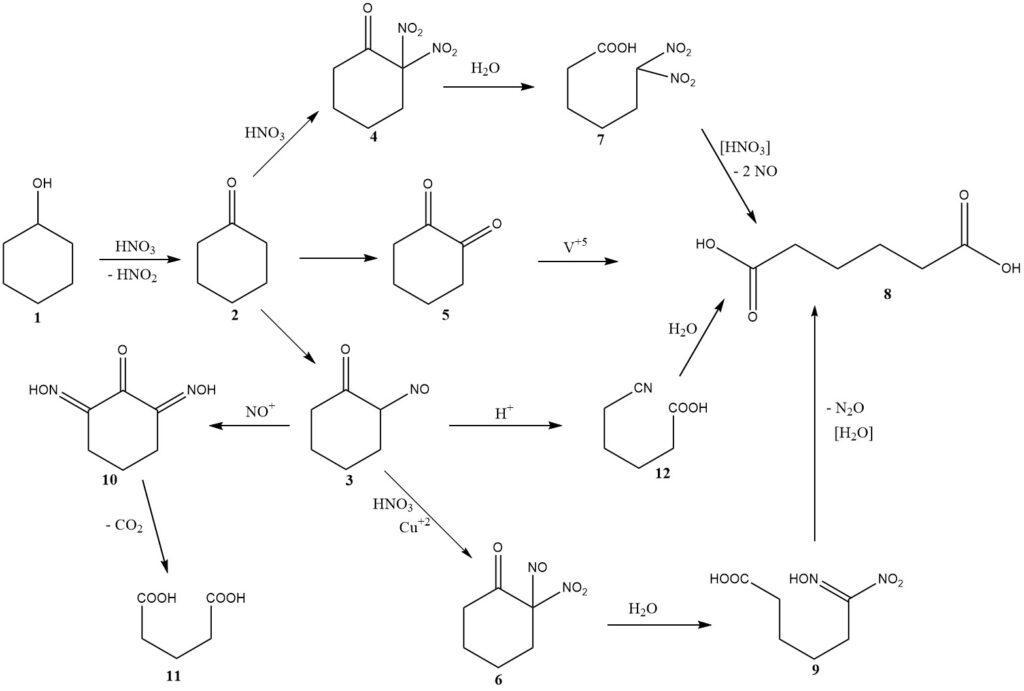
Bei der Oxidation von Cyclohexanol (1) entsteht Cyclohexanon (2) und gleichzeitig salpetrige Säure. Anschließend durchläuft Cyclohexanon einen von drei möglichen Wegen, die zur Bildung von Adipinsäure führen (8).
Der Hauptweg beinhaltet die Nitrosierung zur Bildung von 2-Nitrosocyclohexanon (3), das dann weiter mit Salpetersäure unter Bildung von 2-Nitro-2-nitrosoketon (6) reagiert.
Die hydrolytische Spaltung dieses Zwischenprodukts ergibt 6-Nitro-6-hydroximinohexansäure, auch bekannt als Nitrolsäure (9), die weiter zerfällt, um Adipinsäure und Lachgas zu ergeben, die wichtigsten nicht zurückgewonnenen Salpetersäure-Reduktionsprodukte.
Typischerweise werden für jedes produzierte Mol Adipinsäure 2,0 Mol Salpetersäure in Lachgas umgewandelt.
Bei höheren Temperaturen gewinnt ein zweiter Reaktionsweg an Bedeutung, nämlich die Nitrierung, die zur Bildung von Dinitroketon führt (4).
Frühe Forscher schlugen einen dritten Weg vor, der die intermediäre Bildung von 1,2-Diketon (5) oder seinem Dimer beinhaltet, wobei die Verwendung eines Vanadiumkatalysators erforderlich ist, um eine gute Ausbeute an Adipinsäure zu erzielen. Das Vorhandensein von Vanadium lässt darauf schließen, dass es einen erheblichen Beitrag zur Gesamtausbeute leistet.
Das Zwischenprodukt Nitrosoketon (3) kann zwei wichtige Nebenreaktionen eingehen. Durch mehrfache Nitrosierung entsteht ein Zwischenprodukt (10), das durch anschließende Reaktion mit Salpetersäure Kohlendioxid verliert und Glutarsäure (11) oder Bernsteinsäure erzeugt.
Um diese Reaktionen zu hemmen, wird der Salpetersäure Kupfermetall zugesetzt. Unter bestimmten Bedingungen mit einer relativ hohen stationären Konzentration des Nitrosoketons (3) oder des tautomeren Oximinoketons kommt es zu einer Beckmann-Umlagerung, die zur geringfügigen Bildung von 5-Cyanopentansäure (12) führt, die langsam zu Adipinsäure hydrolysiert wird .
3.1.2. Kommerzielle Salpetersäure-Oxidationsverfahren
Der Salpetersäureoxidationsprozess zur Umwandlung von Cyclohexanol-Cyclohexanon (KA) in Adipinsäure ähnelt weiterhin der frühen Patentliteratur, es wurden jedoch Fortschritte bei der Entfernung von Nebenprodukten, der Katalysator- und Salpetersäurerückgewinnung sowie der Reduzierung der Emissionen von Lachgas, einem Treibhausgas, erzielt wurde traditionell in die Atmosphäre freigesetzt.
Aufgrund der korrosiven Natur von Salpetersäure werden Produktionsanlagen in Bereichen mit hoher Belastung aus Materialien wie Edelstahl (Typ 304L oder besser) oder Titan gebaut.
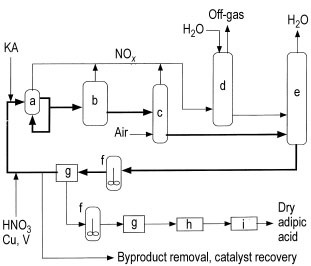
a) Reaktor; b) Reinigungsreaktor; c) NOx-Bleacher; d) Salpetersäureabsorber; e) Konzentrator; f) Kristallisator; g) Filter oder Zentrifuge; h) Trockner; i) Kühler
Der Prozess umfasst typischerweise einen Reaktor (a), der als großer Wärmetauscher fungiert und bei 60–80 °C und einem Druck von 0,1–0,4 MPa arbeitet. Der Reaktor erhält die recycelte Salpetersäure-Mutterlauge (NML), KA-Einsatzmaterial, Zusatzsäure mit 50–60 % Salpetersäure und einen Kupfer-Vanadium-Katalysator.
Die Verweilzeit im Reaktor beträgt weniger als 5 Minuten. Einige Anlagen verwenden einen zweiten Reaktor (b) bei erhöhter Temperatur (110–120 °C), um die Reaktion abzuschließen und Verunreinigungen zu reduzieren, bevor mit der Kristallisation fortgefahren wird.
Die Reaktion ist stark exotherm (6280 kJ/kg) und innovative Reaktordesigns wurden patentiert, um die Reaktionswärme zu kontrollieren und den Energieverbrauch zu minimieren. Um die Reaktion zu kontrollieren und die Ausbeute zu steigern, wird ein Überschuss an recyceltem NML zum KA-Einsatzstrom aufrechterhalten (mindestens 3:1 bis 1000:1).
Der Produktstrom durchläuft mehrere Schritte, einschließlich des Durchlaufens eines Bleichers (c), um überschüssige gelöste Stickoxide zu entfernen, die dann im Absorber (d) als Salpetersäure zurückgewonnen werden.
Das Abgas aus dem Absorber kann zur Einleitung der Oxidation bei niedrigeren Temperaturen genutzt werden, indem es durch den KA-Zufuhrstrom geleitet wird, bevor es dem Oxidationsmittel zugeführt wird. Das dabei entstehende Wasser wird in einer unter Vakuum betriebenen Konzentrationsdestillationsanlage (e) entfernt.
Der konzentrierte Produktstrom wird entweder zum Reaktor zurückgeführt, wobei ein Teil zur Produktrückgewinnung umgeleitet wird, oder direkt zur Produktrückgewinnung geleitet, bevor das NML-Filtrat recycelt wird. Rohe Adipinsäure wird durch Kristallisation (f) aus dem NML-Kreislauf extrahiert und anschließend filtriert oder zentrifugiert (g).
Dieser Abwasserstrom, der höhere Konzentrationen an Glutarsäure, Bernsteinsäure und Nebenprodukten enthält, wird weiterverarbeitet, um die Vanadium- und Kupferkatalysatoren zurückzugewinnen und die Nebenproduktsäuren zu entfernen. Die Metallrückgewinnung erfolgt typischerweise durch Ionenaustausch.
Die rohe Adipinsäure aus dem ersten Kristallisator (g) durchläuft einen oder mehrere Umkristallisationsschritte, bevor sie zu einem Trockner (h) und Kühler (i) gelangt. Wenn keine trockene Adipinsäure erforderlich ist, können die Kristalle aus der Zentrifuge/dem Filter (g) alternativ in Wasser gelöst und zu einer Lösung aus wässrigem 1,6-Hexandiamin gegeben werden, um Nylonsalz herzustellen.
Zusätzliche Verbesserungen des herkömmlichen Verfahrens wurden beschrieben, insbesondere im Hinblick auf die Abtrennung und Rückgewinnung der Nebenprodukte der zweibasischen Säure.
Je nach Verwendungszweck kann die rohe Adipinsäure unterschiedlich stark raffiniert werden, eine gängige Vorgehensweise ist jedoch die Umkristallisation aus Wasser. Es wird behauptet, dass das Rückflussieren der rohen Adipinsäure in 60 %iger Salpetersäure mit gelöstem Vanadium ein qualitativ hochwertiges Produkt ergibt.
3.2. Butadienbasierte Routen
Anfang der 1970er Jahre startete die BASF ein umfangreiches Forschungsprogramm zur Herstellung von Dimethyladipat, einem Diester, der später zu Adipinsäure hydrolysiert werden konnte. Der Prozess umfasste die Carbomethoxylierung von Butadien mit Kohlenmonoxid und Methanol, katalysiert durch Kobalt und Pyridin unter hohem Druck.
Diese Reaktion ergab Methyl-3-pentenoat, das durch Destillation von Nebenprodukten getrennt wurde. Anschließend führte ein zweiter Carbomethoxylierungsschritt bei niedrigerem Druck und einem verringerten Verhältnis von Pyridin zu Kobalt zur Bildung von Dimethyladipat.
Die Hydrolyse des Diesters zu Adipinsäure und Methanol wurde durch einen katalytischen Prozess mit hoher Ausbeute erreicht. Insgesamt ergab das Verfahren eine ungefähre Ausbeute von etwa 70 % an Butadien. Obwohl es im Pilotanlagenmaßstab demonstriert wurde, wurde es noch nicht kommerzialisiert.
Mitte der 1980er Jahre startete DuPont außerdem ein bedeutendes Programm, das einen Butadien-basierten Weg zur Adipinsäure beinhaltete. Im Gegensatz zum Diester-Ansatz von BASF umfasste die Methode von DuPont die direkte Dihydrocarboxylierung von Butadien zu Adipinsäure (wie in Abbildung 3 dargestellt).

Der erste Schritt, katalysiert durch Palladium, Rhodium oder Iridium, führte hauptsächlich zu 3-Pentensäure. Der zweite Schritt, katalysiert durch Rhodium oder Iridium, führte zur Bildung von Adipinsäure (13), 2-Methylglutarsäure (14) und 2-Ethylbernsteinsäure (15).
Der Vorteil dieses Verfahrens war die Möglichkeit, 2-Methylglutarsäure und 2-Ethylbernsteinsäure mit demselben Katalysatorsystem zu Adipinsäure zu isomerisieren. Der Katalysator erforderte einen Halogenid-Promotor wie Jodwasserstoffsäure.
Als Lösungsmittel diente typischerweise Pentansäure, eine gesättigte Carbonsäure und ein Nebenprodukt des Prozesses. Seit den späten 1980er Jahren haben viele große Chemieunternehmen zahlreiche Patente für Variationen dieser Butadien-basierten Routen erhalten.
3.3. Andere Routen
Neben der konventionellen zweistufigen Luft-/Salpetersäure-Oxidation von Cyclohexan und der Carboxylierung/Carbomethoxylierung von Butadien wurden verschiedene andere Verfahren zur Herstellung von Adipinsäure untersucht.
Monsanto führte Forschungen zur Palladiumhalogenid-katalysierten Dicarbonylierung von 1,4-disubstituierten 2-Butenen durch. Bei diesem Verfahren wird Adipinsäure aus 1,4-Dimethoxy-2-buten, Kohlenmonoxid und Palladiumchlorid bei 100 °C hergestellt, gefolgt von der Hydrierung und Hydrolyse des resultierenden ungesättigten Dimethylesters.
Auch die einstufige Oxidation von Cyclohexan mit Salpetersäure, Stickstoffdioxid oder Luft wurde untersucht. Die einstufige All-Air-Oxidation von Cyclohexan ist wirtschaftlich besonders attraktiv und hat umfangreiche Forschungsaufmerksamkeit erhalten.
Frühe Studien wurden von Gulf Research and Development, Asahi Chemical Industries und anderen Gruppen durchgeführt. Beispielsweise kann Cyclohexan in Gegenwart eines Kobaltacetatkatalysators in Essigsäure als Lösungsmittel in einem Schritt mit einer Ausbeute von 70–75 % zu Adipinsäure oxidiert werden.
In jüngster Zeit ist das Interesse an diesem Ansatz erneut gestiegen, was dazu geführt hat, dass mehrere Patente an Unternehmen wie Redox Corporation und Bayer erteilt wurden.
Adipinsäure kann auch durch Ozonolyse von Cyclohexen oder durch Zugabe einer Carbonsäure zu Cyclohexen und anschließende Oxidation des resultierenden Esters mit Salpetersäure hergestellt werden.
Darüber hinaus wurde die Bildung von Adipinsäurederivaten über die elektrolytische Kupplung von Acrylaten beschrieben.
Diese alternativen Verfahren stellen laufende Forschungsanstrengungen zur Entwicklung neuer Methoden für die Adipinsäuresynthese dar.
4. Verwendung von Adipinsäure
Ungefähr 80 % des weltweiten Adipinsäureverbrauchs fließen in die Produktion von Nylon-66-Fasern und -Harzen.
Eine kleinere Menge Adipinsäure wird immer noch in Eigenregie zur Herstellung von Adiponitril verwendet.
Erhebliche Mengen Adipinsäure werden in Ester für verschiedene Anwendungen wie Weichmacher, Schmiermittel und eine Reihe von Polyurethanharzen umgewandelt.
Monomere Ester sind wesentliche Weichmacher für Poly(vinylchlorid) und andere Harze, während Polymerester verwendet werden, wenn außergewöhnlich hohe Weichmachergehalte erforderlich sind.
Polyurethanharze, die Adipinsäure enthalten, werden aus Polyisocyanaten und Polyesterpolyolen (Adipaten) hergestellt und finden in verschiedenen Anwendungen Verwendung.
Adipinsäure dient auch als Säuerungsmittel in Gelatine und Konfitüren und fungiert in anderen Lebensmitteln als Puffer- oder Neutralisierungsmittel.
Darüber hinaus wird es zur Modifizierung der Eigenschaften ungesättigter Polyester für den Einsatz in verstärkten Kunststoffen und Alkydbeschichtungen eingesetzt.
Adipinsäure wird in Polyamid-Epichlorhydrin-Harzen verwendet, um die Nassfestigkeit von Papierprodukten zu verbessern.
Weitere vielfältige Anwendungen umfassen die Verwendung in Klebstoffen, Insektiziden, Gerbereien, Färbereien und in der Textilindustrie. Darüber hinaus werden Adipinsäure und gemischte zweibasische Säuren (DBA) als Puffer bei der Rauchgasentschwefelung in Kraftwerken eingesetzt.
5. Toxikologie und Arbeitsmedizin
Adipinsäure ist leicht reizend und weist eine geringe orale Toxizität auf. Die veröffentlichten tödlichen Dosen (LDLo) betragen 3600 mg/kg (Ratte, oral), LD50 275 mg/kg (Ratte oder Maus, i.p.) und LD50 1900 mg/kg (Maus, oral).
Einige chronische Fütterungstests zeigten eine verzögerte Körpergewichtszunahme, Veränderungen bestimmter Enzyme und Veränderungen der Harnstoff- und Chloridspiegel im Blut. In Studien mit trächtigen Mäusen wurde jedoch keine teratogene Aktivität beobachtet.
Stoffwechselstudien an Ratten, denen 14C-markierte Adipinsäure verabreicht wurde, ergaben das Vorhandensein sowohl unveränderter Adipinsäure als auch normaler Stoffwechselprodukte im Urin.
Der Kontakt mit Adipinsäure kann zu Reizungen der Schleimhäute wie der Augen und der Atemwege führen, während ein längerer Kontakt mit der Haut zu Austrocknung oder Reizungen führen kann.
Im Falle von Verschüttungen oder Lecks sollte das Personal vor Einatmen oder übermäßigem Hautkontakt geschützt werden. Die Staubbildung sollte kontrolliert werden und es sollten Maßnahmen zur Vermeidung statischer Funken ergriffen werden. Wenn etwas verschüttet wird, kann der Bereich mit Wasser gespült werden.
Obwohl es keinen etablierten TLV (Threshold Limit Value) oder MAK (Maximal Concentration Value) gibt, sollte die Exposition gegenüber Adipinsäure in der Luft unter der eines organischen Belästigungsstaubs gehalten werden: ACGIH (1979) empfiehlt einen 8-Stunden-TWA (Time-Weighted Average). ) von 10 mg/m3 für Gesamtstaub und 5 mg/m3 für alveolengängigen Staub. Der OSHA-TLV für Gesamtstaub beträgt 15 mg/m3.
6. Adipinsäure-Derivate
6.1. Adipodinitril
Das Hauptderivat der Adipinsäure ist Adiponitril, auch bekannt als 1,6-Hexandinitril oder 1,4-Dicyanbutan, Mr 108,14, Siedepunkt 298 – 300 ◦C (bei 101,3 kPa), 154 ◦C (bei 1,3 kPa) und Gefrierpunkt 2,4 ◦C.
Adiponitril dient als Zwischenprodukt bei der Herstellung des Hauptbestandteils von Nylon 66, 1,6-Hexandiamin. Die früheren Produktionsmethoden umfassten die Umwandlung von Adipinsäure in Dinitril durch Flüssig- oder Dampfphasendehydratisierung des Ammoniumsalzes unter Verwendung von Phosphorsäure oder einem Bor-Phosphor-Katalysator. Diese Methoden werden jedoch von großen Nylon-66-Herstellern nicht mehr angewendet.
Für die Herstellung von Adiponitril wurden verschiedene Wege genutzt, darunter Verfahren von Celanese, bei denen 1,6-Hexandiamin durch Ammonolyse von 1,6-Hexandiol hergestellt wurde, das durch Hydrierung von Adipinsäure gewonnen wurde.
6.2. Adipinsäuresalze
Adipinsäure bildet wasserlösliche Alkali- und Ammoniumsalze sowie mäßig lösliche Erdalkalisalze.
Ihre Löslichkeiten in 100 g Wasser sind wie folgt: Diammoniumsalz 40 g (14 ◦C), Dinatriumsalz 59 g Halbhydrat (14 ◦C), Dikaliumsalz 65 g (15 ◦C), Calciumsalz 4 g Monohydrat ( 13 ◦C) und 1 g wasserfreies Salz (100 ◦C).
Das am häufigsten vorkommende Salz ist Poly(1,6-hexandiammoniumhexandioat), das durch Reaktion von Adipinsäure mit 1,6-Hexandiamin hergestellt wird. Dieses wasserlösliche Salz, eine Vorstufe von Nylon 66, kann vor der endgültigen Polyamidierung, bei der Wasser entfernt wird, bequem versendet oder gelagert werden.
6.3. Adipinsäureester und Polyester
Ester und Polyester der Adipinsäure bilden den größten Nicht-Polyamid-Markt für Adipinsäure. Ester aus langkettigen Alkoholen werden als Weichmacher und Gleitmittel verwendet, während Ester aus kurzkettigen Alkoholen hauptsächlich als Lösungsmittel dienen.
Erhitzen von Adipinsäure unter Rückfluss mit Methanol in Gegenwart eines Säurekatalysators ergibt Monomethyladipat zusammen mit dem Diester. Durch Elektrolyse des Salzes des Monoesters (Kolbe-Synthese) entsteht Dimethylsebacat, ein weiterer Polyamid-Vorläufer.
Die Ester lösen sich leicht in den meisten organischen Lösungsmitteln, wobei Dimethyladipat das am häufigsten verwendete Lösungsmittel und Di-2-ethylhexyladipat der am häufigsten verwendete Weichmacher ist. Andere einfache Adipat-Weichmacher umfassen n-Octyl-, n-Decyl-, Isodecyl- und Isooctylester.
Komplexere polymere Weichmacher, hergestellt aus Glykolen, machen etwas weniger als die Hälfte der Weichmacher auf Adipinsäurebasis aus. Niedermolekulare Polyesterpolyole mit Hydroxylendgruppen werden mit Polyisocyanaten zur Herstellung von Polyurethanharzen verwendet.
6.4. Adipinsäureanhydride
Das Anhydrid der Adipinsäure wird üblicherweise durch Dehydratisierung von Adipinsäure gewonnen, wobei die lineare, polymere Form entsteht. Durch Destillation des Polymeranhydrids kann die zyklische Monomerform entstehen, die sehr instabil ist und leicht in das lineare Polymeranhydrid zurückfällt.
6.5. Adipinsäureamid
Das Diamid der Adipinsäure hat einen Schmelzpunkt von 228 ◦C und ist in kaltem Wasser praktisch unlöslich. Traditionell wurde es durch Behandeln des Dimethylesters mit konzentriertem Ammoniumhydroxid oder durch Erhitzen des Diammoniumsalzes von Adipinsäure in einem Ammoniakstrom hergestellt. Mit Standard-Synthesemethoden können aus Aminen verschiedene substituierte Amide synthetisiert werden.
Referenz
Adipic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_269
FAQ
Adipinsäure ist eine weiße, kristalline organische Verbindung mit der chemischen Formel C6H10O4. Sie gehört zur Klasse der aliphatischen Dicarbonsäuren und wird oft als Hexandisäure bezeichnet. Adipinsäure ist kommerziell bedeutsam und wird aufgrund ihrer vielseitigen Eigenschaften in verschiedenen Branchen häufig eingesetzt.
Adipinsäure hat branchenübergreifend vielfältige Anwendungen. Seine primäre und wichtigste Verwendung ist die Herstellung von Nylon-66-Polyamid, einem entscheidenden Material für die Herstellung von Fasern und Harzen. Darüber hinaus wird Adipinsäure bei der Herstellung von Estern, Polyurethanharzen, Weichmachern und Schmiermitteln sowie als Säuerungsmittel oder Puffermittel in der Lebensmittelindustrie verwendet. Es wird auch bei der Synthese verschiedener chemischer Derivate eingesetzt.
Adipinsäure kann auf verschiedene Weise hergestellt werden. Die gebräuchlichsten kommerziellen Verfahren umfassen die zweistufige Luft-/Salpetersäure-Oxidation von Cyclohexan oder die direkte Hydrocyanierung von Butadien. Das erstere Verfahren beginnt mit der Oxidation von Cyclohexan zur Herstellung von Cyclohexanol und Cyclohexanon, gefolgt von deren Oxidation mit Salpetersäure zur Gewinnung von Adipinsäure. Die letztere Methode beinhaltet die Hydrocyanierung von Butadien zur Herstellung von Adiponitril, das anschließend hydriert und hydrolysiert wird, um Adipinsäure zu ergeben.
Adipinsäure ist in verschiedenen Lösungsmitteln löslich. Es ist in Methanol, Ethanol, Wasser und Aceton löslich. Allerdings ist seine Löslichkeit in Cyclohexan und Benzol relativ geringer.
Adipinsäure gilt im Allgemeinen als sicher, wenn sie gemäß den empfohlenen Richtlinien und Konzentrationen verwendet wird. Es ist leicht reizend und weist eine geringe orale Toxizität auf. Die tödliche Dosis für Ratten (LDLo) ist relativ hoch (3600 mg/kg), es ist jedoch Vorsicht geboten, um übermäßiges Einatmen oder Hautkontakt zu vermeiden. Es ist nicht bekannt, dass Adipinsäure teratogen ist und ihre Stoffwechselprodukte werden mit dem Urin ausgeschieden.
Die chemische Formel von Adipinsäure lautet C6H10O4.
Adipinsäure ist auch unter der Bezeichnung „Hexandisäure“ bekannt.
