Gallussäure: Eigenschaften, Reaktionen, Herstellung und Verwendung
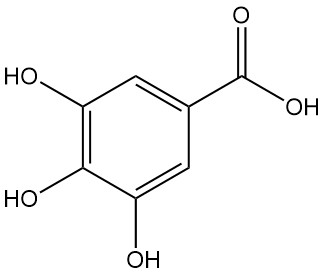
Was ist Gallussäure?
Gallussäure, auch bekannt als 3,4,5-Trihydroxybenzoesäure, ist eine Hydroxyaromatensäure mit der chemischen Formel C7H6O5. Sie ist ein weißer Feststoff, der jedoch aufgrund von Oxidation oft braun erscheint und in Alkohol und polaren Lösungsmitteln löslich ist. Sie wurde 1786 von Carl Wilhelm Scheele entdeckt.
Gallussäure kommt in den Blättern der Bärentraube, in der Wurzelrinde des Granatapfels, Gallnüssen, Hamamelis, Sumach, Teeblättern, Eichenrinde und vielen anderen Pflanzen vor, sowohl in freiem Zustand als auch als Teil des Tanninmoleküls.
Inhaltsverzeichnis
1. Physikalische Eigenschaften der Gallussäure
3,4,5-Trihydroxybenzoesäure, allgemein als Gallussäure bezeichnet, erscheint als weißes bis blassgelbes kristallines Pulver. Die Kristallisation aus wässrigen Lösungen ergibt eine Monohydratform in Form seidenartiger Nadeln, die sich beim Erhitzen auf 258–263 °C in Pyrogallol und Kohlendioxid zersetzt.
Gallussäure ist löslich in warmem Wasser, Ethanol, Diethylether und Aceton und unlöslich in Benzol und Chloroform.
Die physikalischen Eigenschaften der Gallussäure sind in der folgenden Tabelle aufgeführt:
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [149-91-7] |
| Chemische Formel | C7H6O5 |
| Molekularmasse | 170,12 g/mol |
| Schmelzpunkt | 258–263 °C (Zersetzung) |
| Sublimationstemperatur | 210 °C |
| Dichte bei 25 °C | 1,694 g/cm3 |
| pKa1 bei 30 °C | 2,33 |
| pKa2 | 8,85 |
2. Chemische Reaktionen der Gallussäure
Das Gallussäuremolekül enthält zwei funktionelle Gruppen: Hydroxylgruppen (phenolisch) und eine Carbonsäuregruppe. Da beide funktionellen Gruppen saure Wasserstoffe besitzen, können sie reagieren und zahlreiche Ester, Ether und Salze bilden, darunter auch Digallussäure (1).

Gallussäurelösungen, insbesondere solche, die Alkalimetallsalze enthalten, sind anfällig für Oxidation durch Luftsauerstoff, was zu einer Farbveränderung nach Braun wie bei Pyrogallol führt.
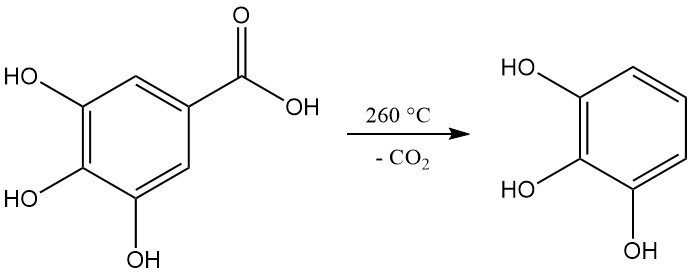
Durch Erhitzen auf über 260 °C wird Gallussäure decarboxyliert und Pyrogallol erzeugt.
Gallussäure ist ein wirksames Reduktionsmittel, das Gold- oder Silbersalze in ihre elementare Form reduzieren kann.
Die Reaktion von Gallussäure mit Eisen(III)-Salzen erzeugt einen intensiven blauen Komplex, der zur Herstellung von Tintenfarbstoffen verwendet wird. Gallustinte, die aus Gallussäure und Eisen(II)-sulfat besteht, wird an der Luft oxidiert, wodurch der blaue Eisen(III)-Gallussäurekomplex entsteht.
Durch Erhitzen von Gallussäure mit konzentrierter Schwefelsäure entsteht durch Kondensationsreaktion Hexahydroxyanthrachinon (2; Rufigallussäure).

Bei der Reaktion mit p-Nitrosodimethylanilinhydrochlorid entstehen Oxazinderivate.
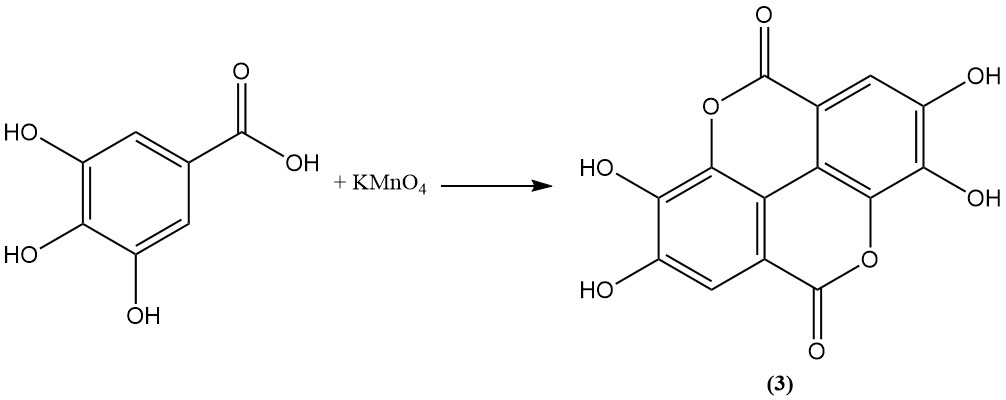
Die Oxidation von Gallussäure mit Arsensäure, Permanganat, Persulfat oder Iod führt zur Bildung von Ellagsäure (3).
Die Carbonsäuregruppe der Gallussäure kann mit Alkoholen durch azeotrope Veresterung oder nach der Fischer-Methode mittels Alkohol mit Salzsäure verestert werden.

Etheresterderivate der Gallussäure können durch Alkylierung mit Dialkylsulfaten oder Alkylhalogeniden in Gegenwart einer Base oder mit Diazomethan hergestellt werden.
Die Hydroxygruppe in Position 4 ist im Vergleich zu den anderen reaktiver. Durch partielle Hydrolyse von 3,4,5-Trimethoxybenzoesäure mit starken Säuren entsteht 4-Hydroxy-3,5-dimethoxybenzoesäure (4) (Spritzensäure).

3. Herstellung von Gallussäure
Gallussäure ist Bestandteil zahlreicher Gerbstoffe und kommt in freier Form oder an Tannine gebunden in natürlichen Quellen wie Divi-Divi, Eichenrinde, Gallnüssen, Granatapfelwurzeln, Sumach und Tee vor.
Gallussäure wird aus tanninreichen wässrigen Gallusnussextrakten durch saure Hydrolyse mit Schwefelsäure bei 110–120 °C oder durch alkalische Behandlung hergestellt.

Es kann auch durch enzymatische Spaltung von Tannin durch Tannase oder durch Fermentation mit Schimmelpilzen wie Penicillium glaucum und Aspergillus niger hergestellt werden.
Festkörper- oder Unterwasserfermentationsprozesse mit freien oder immobilisierten filamentösen Pilzen wie R. oryzae und Aspergillus foetidus wurden entwickelt, um Gerbsäure aus kostengünstigem Tarapulver oder anderen kostengünstigen tanninreichen Rohstoffen zu hydrolysieren.
Gallussäure wird dann mit Diethylether aus der Fermentationslösung extrahiert, was zu hohen Erträgen von etwa 95 % führt. Dieser Biosyntheseprozess verbraucht im Vergleich zur herkömmlichen Säurehydrolyse weniger Energie.
4. Verwendung von Gallussäure
Gallussäure wird bei der Herstellung von Eisengallustinte und verschiedenen Farbstoffen verwendet, darunter Anthragallol, Gallocyanin, Galloflavin und Rufigallussäure.
Gallatester, insbesondere Methylgallat (Gallicin) und Propylgallat, werden als Antioxidantien und Lebensmittelkonservierungsmittel für Fette verwendet.
Gallussäure wird als Reduktionsmittel in Arzneimitteln (Dermatol, Airol und Wismutsalz der Gallussäure) und als Rohstoff für die Herstellung des halluzinogenen Alkaloids Meskalin und Trimethoprim (Breitbandantibiotikum) verwendet.
Gallussäure wird bei der Herstellung von fotografischen Entwicklern verwendet, ebenso wie Pyrogallol, das bei der Sauerstoffabsorption und der Azofarbstoffsynthese verwendet wird.
Aufgrund seiner adstringierenden Eigenschaften wird es auch beim Gerben von Leder sowie als Antioxidans und Konservierungsmittel in Lebensmitteln verwendet.
Zahlreiche Studien untersuchen die potenziellen gesundheitlichen Vorteile von Gallussäure als Antioxidans, antimikrobielles, entzündungshemmendes und krebshemmendes Mittel.
5. Toxikologie der Gallussäure
Toxizitätsstudien zu Gallussäure weisen auf eine geringe akute und subakute Toxizität hin. Die Verbindung verursachte jedoch hämorrhagische Effekte bei Hühnerembryonen, was die Notwendigkeit von Dosisbegrenzungen unterstreicht.
Die gemeldeten LD50-Werte betragen 320 mg/kg (Maus, intravenös), 5000 mg/kg (Kaninchen, oral) und 4300 mg/kg (Maus, intraperitoneal). Die LDL0-Werte betragen 800 mg/kg (Maus, intraperitoneal) und 5 mg/kg (Maus, subkutan, 1 Tag trächtig).
Der Mensch kommt hauptsächlich berufsbedingt und über die Nahrung mit Gallussäure in Kontakt.
Sie wird als mutagen und teratogen eingestuft.
Referenzen
- Hydroxycarboxylic Acids, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_519
- Organic and Fatty Acid Production, Microbial. – https://www.sciencedirect.com/science/article/abs/pii/B9780123739445001565
- Toxicity of natural products. – https://www.sciencedirect.com/science/article/abs/pii/B9780128243152011891
- https://pubchem.ncbi.nlm.nih.gov/compound/Gallic-Acid
