Essigsäureanhydrid: Reaktionen, Produktion und Verwendung
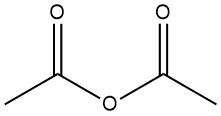
Essigsäureanhydrid ist eine organische Verbindung mit der chemischen Formel (CH3CO)2O. Es ist eine farblose Flüssigkeit mit stechendem Geruch und wird häufig als Acetylierungsmittel und Dehydratisierungsmittel verwendet. Es wurde 1852 durch die Reaktion von Benzoylchlorid und geschmolzenem Kaliumacetat hergestellt.
Seitdem hat sich Essigsäureanhydrid zu einem bedeutenden organischen Zwischenprodukt mit erheblicher Bedeutung für verschiedene Forschungs- und Industrieanwendungen entwickelt. Derzeit wird es häufig sowohl in der akademischen als auch in der industriellen Synthese eingesetzt.
Essigsäureanhydrid kommt in Weintrauben (Vitis vinifera) in Spuren vor, wird aber hauptsächlich industriell hergestellt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Essigsäureanhydrid
Essigsäureanhydrid mit der chemischen Formel C4H6O3 und einer Molmasse von 102,09 g/mol weist bestimmte physikalische Eigenschaften auf, die von Bedeutung sind. Es ist eine farblose Flüssigkeit mit einem stechenden Geruch und starken tränentreibenden Eigenschaften. Die wichtigsten physikalischen Daten von Essigsäureanhydrid sind nachstehend aufgeführt.
| Eigenschaft | Wert |
|---|---|
| Molekülformel | (CH3CO)2O |
| Molekulargewicht | 102,09 g/mol |
| Aussehen | Farblose Flüssigkeit |
| Dichte | 1,08 g/cm3 |
| Siedepunkt | 140,1 °C |
| Schmelzpunkt | -73,1 °C |
| Löslichkeit in Wasser | Reagiert heftig; mischbar |
| Geruch | Stechend |
| Dampfdruck | 13 mmHg bei 25 °C |
| Flammpunkt | 49 °C (geschlossener Becher) |
| Selbstentzündungstemperatur | 485 °C |
| Brechungsindex | 1,392 |
| Viskosität | 1,3 cP bei 25 °C |
| Explosionsgrenzen | 2,3 - 10,6 % (Volumen) |
Bei einer Temperatur von -73,1 °C durchläuft Essigsäureanhydrid einen Phasenübergang von fest zu flüssig (Schmelzpunkt). Andererseits siedet es bei 140 °C unter einem Druck von 101,3 kPa (Siedepunkt).
Essigsäureanhydrid ist mit polaren Lösungsmitteln mischbar und in kaltem Alkohol löslich, wenn auch mit langsamer Zersetzungsgeschwindigkeit. Beim Auflösen in Wasser bei einer Temperatur von 20 °C beträgt die Löslichkeit von Essigsäureanhydrid etwa 2,6 Gew.-%, begleitet von einem allmählichen Zersetzungsprozess.
Umgekehrt beträgt die Löslichkeit von Wasser in Essigsäureanhydrid bei einer Temperatur von 15 °C etwa 10,7 Gew.-%, ebenfalls mit einer allmählichen Zersetzungstendenz.
2. Chemische Reaktionen von Essigsäureanhydrid
Essigsäureanhydrid zeigt ein breites Spektrum chemischer Reaktionen und wurde als aliphatisches Carbonsäureanhydrid ausführlich untersucht.
In den letzten 25 Jahren wurde Essigsäureanhydrid in zahlreichen Veröffentlichungen und Patenten insbesondere für die Acetylierung von Hydroxyl- (OH) oder Aminogruppen (NH) verwendet und diente als primärer Schritt in diesen Reaktionen.
2.1. Acetylierung
2.1.1. O-Acetylierung
Essigsäureanhydrid eignet sich hervorragend für Veresterungsreaktionen mit Alkoholen, die mit Essigsäure oft schwierig oder gar nicht realisierbar sind. Dabei wird Essigsäure freigesetzt. Üblicherweise werden Katalysatoren wie Basen, starke Säuren und Salze wie Natriumacetat eingesetzt.
Bemerkenswerte Beispiele für die Reaktion von Essigsäureanhydrid mit Hydroxylgruppen sind die Bildung von Acetylcellulose, Acetylsalicylsäure (allgemein bekannt als Aspirin) und Glycerintriacetat.
Wenn Essigsäureanhydrid mit Wasserstoffperoxid reagiert, entsteht Peressigsäure oder Diacetylperoxid, wobei das Ergebnis vom Molverhältnis der Reaktanten abhängt:
(CH3CO)2O + 2H2O2 → 2CH3CO3H
(CH3CO)2O + H2O2 → CH3COOH + CH3CO3H
(CH3CO)2O + CH3CO3H → CH3COOOOCOCH3 + CH3COOH
2.1.2. N-Acetylierung
Die Acetylierung von NH-Gruppen enthaltenden Verbindungen ergibt Acetamide nach der allgemeinen Gleichung:
RR’NH + (CH3CO)2O → RR’NCOCH3 + CH3COOH
Hier stehen R und R‘ für Wasserstoff (H) oder Alkylgruppen. Aliphatische Amine reagieren typischerweise ohne Erhitzen. Anilin beispielsweise produziert Acetanilid, das die Oxidation bei der anschließenden Nitrierung verhindert.
N-Acetylierungsreaktionen laufen im Allgemeinen schneller ab als die Acetylierung von OH-Gruppen, was eine teilweise Acetylierung von Verbindungen mit mehreren funktionellen Gruppen ermöglicht. Beispiele hierfür sind die Produktion von N-Acetylaminosäuren wie N-Acetylmethionin-S-oxid (1) und N-Acetylanthranilsäuren (2).

Amide und Carbamide mit freien NH-Gruppen, sowohl aliphatische als auch aromatische, können mit Essigsäureanhydrid acetyliert werden.
Als Katalysator wird üblicherweise Schwefelsäure verwendet. Diese Reaktion findet Anwendung bei der Synthese verschiedener Produkte wie N,N,N‘,N‘-Tetraacetylethylendiamin ((CH3CO)2NCH2CH2N(COCH3)2) und 2,4,6,8-Tetraacetylazabicyclo[3.3.1]nonan-3, 7-Dion.
![2,4,6,8-tetraacetylazabicyclo[3.3.1]nonane-3,7-dione.](https://chemcess.com/wp-content/uploads/2023/07/2468-tetraacetylazabicyclo3.3.1nonane-37-dione.jpg)
2.1.3. C-Acetylierung
Verbindungen mit reaktiven CH-Bindungen können mit Essigsäureanhydrid acetyliert werden, was manchmal einen Katalysator erfordert. Bemerkenswerte Beispiele sind die Herstellung von Ethyl-α-cyanoacetoacetat (CH3COCH(CN)COOC2H5) unter Verwendung von Kaliumcarbonat als Katalysator und die Friedel-Crafts-Reaktion zwischen Essigsäureanhydrid und aromatischen Kohlenwasserstoffen wie Benzol, die zur Bildung von Acetophenon führt.
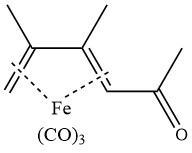
Die Acetylierung von 2,3-Dimethylbutadientricarbonyleisen in Gegenwart von Aluminiumchlorid ergibt den folgenden Komplex:
Die durch Bortrifluorid katalysierte Reaktion von Ketonen mit Essigsäureanhydrid führt zur Bildung von β-Diketonen.
Triacetylmethan kann direkt aus Isopropenylacetat, Essigsäureanhydrid und einem Aluminiumchlorid-Katalysator synthetisiert werden.
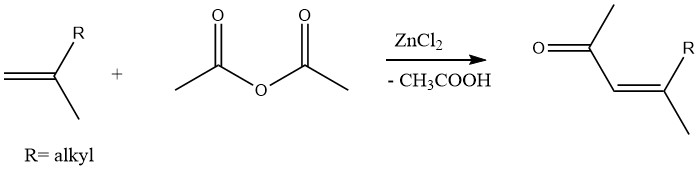
Ebenso können ungesättigte Methylketone durch Acetylierung von Olefinen mit Essigsäureanhydrid in Gegenwart von Zinkchlorid als Katalysator hergestellt werden:
2.1.4. Acetylierung von Mineralsäuren
Die Reaktion von Essigsäureanhydrid mit Salpetersäure führt zur Bildung von Acetylnitrat, das in der organischen Chemie häufig als Nitrierungsmittel eingesetzt wird. Acetylnitrat kann auch aus Distickstoffpentoxid und Essigsäureanhydrid synthetisiert werden.
Andere starke Säuren wie Schwefelsäure, Sulfonsäuren und Salzsäure können mit Essigsäureanhydrid gemischte Anhydride bilden. Durch die Reaktion von Essigsäureanhydrid mit phosphoriger Säure entsteht 1-Hydroxyethan-1,1-diphosphonsäure.

2.1.5. Acetylierung von Oxiden
Antimontrioxid reagiert mit Essigsäureanhydrid unter Bildung von Antimontriacetat (Sb(OCOCH3)3). Eine ähnliche Reaktion mit Chromtrioxid führt zu Chromylacetatlösungen, die häufig bei der Oxidation von Olefinen und Kohlenwasserstoffen eingesetzt werden. Allerdings ist Vorsicht geboten, da sie gelegentlich explosiv sein können.
2.1.6. Acetylierung von Salzen
Verschiedene Salze reagieren mit Carbonsäureanhydriden auf ähnliche Weise wie ihre entsprechenden freien Säuren:
Li−C−CR + (CH3CO)2O → CH3CO−C−CR + CH3COOLi
Mit Essigsäureanhydrid behandeltes Bariumperoxid erzeugt Diacetylperoxid:
BaO2 + (CH3CO)2O → (CH3CO)2O2 + BaO
Ein allgemeines Verfahren zur Herstellung von Vinylketonen beinhaltet die Reaktion von Vinylmagnesiumbromiden mit Essigsäureanhydrid.
2.1.7. Herstellung von Acetoxysilanen
Essigsäureanhydrid reagiert mit Silanen nach der Gleichung:

wobei X = H, Cl, OR, NR2.
2.1.8. Addition an heterocyclische Verbindungen unter Ringspaltung
Diese Reaktionen ähneln konzeptionell den oben beschriebenen. Beispielsweise kann aus Ethylenoxid in Gegenwart stark saurer oder basischer Katalysatoren Ethylenglykoldiacetat hergestellt werden, aus Trioxan können Oxymethylendiacetate gewonnen werden.
2.1.9. Oxidative Addition an Kohlenstoff-Kohlenstoff-Doppelbindungen
Bei oxidativen Additionsreaktionen entstehen entsprechende Diacetate. Beispielsweise ergibt die Addition von Ethylen an Essigsäureanhydrid Ethylenglykoldiacetat. Ebenso kann Butadien durch einen ähnlichen Prozess in 1,4-Diacetoxy-2-buten umgewandelt werden.
2.1.10. Herstellung gemischter Diacylperoxide
Diacylperoxide können durch Reaktion von Sauerstoff mit Mischungen aus aliphatischen Aldehyden und Essigsäureanhydrid in Gegenwart von Natriumacetat synthetisiert werden.
2.1.11. Reaktion mit N-Oxiden
Reaktionen mit N-Oxiden ergeben je nach N-Oxid-Typ verschiedene Produkte. Pyridin-N-oxid beispielsweise erzeugt 2-Acetyloxypyridin, während 4-Picolin-N-oxid eine Mischung aus 4-Acetyloxymethylenpyridin und 3-Acetyloxy-4-methylpyridin bildet. Die Polonovski-Reaktion von N-Oxiden führt zur Bildung von Formaldehyd, ungesättigten Aldehyden und Säureamiden.
2.1.12. Reaktion mit S-Oxiden
Die Reduktion von Sulfoxiden zu Sulfiden mit Essigsäureanhydrid ist als Pummerer-Reaktion bekannt. Beispielsweise reagiert CH3SOR mit (CH3CO)2O zu CH3COOCH2SR und CH3COOH.
Diese Reaktion wird auch zur Oxidation primärer und sekundärer Alkohole, auch sterisch gehinderter, unter Verwendung von Mischungen aus Dimethylsulfoxid oder Tetramethylensulfoxid zusammen mit Essigsäureanhydrid genutzt, was zur Bildung der entsprechenden Carbonylverbindungen führt.
2.1.13. Herstellung von Acylalen und Vinylacetaten
Aldehyde reagieren mit Essigsäureanhydrid in Gegenwart saurer Katalysatoren unter Bildung von Acylalen. Besitzt der Aldehyd ein α-Wasserstoffatom, führt die Abspaltung von Essigsäure zur Bildung des entsprechenden Vinylacetats. Die Zugabe von Zink erleichtert die Abspaltung des Essigsäureanteils. Dieses Verfahren eignet sich besonders für die Synthese von 2,2-Dichlorvinylacetat.
2.1.14. Bortrifluorid
Essigsäureanhydrid und substituierte Essigsäureanhydride können mithilfe eines Bortrifluoridkomplexes, der sich in warmem Wasser zersetzt, in Acetylketone umgewandelt werden.
2.2. Dehydrierung
Essigsäureanhydrid findet als Dehydratisierungsmittel in verschiedenen Branchen Anwendung, unter anderem in der Sprengstoffindustrie. Ein bemerkenswertes Beispiel für seine dehydrierende Eigenschaft ist die Herstellung von Hexogen (1,3,5-Trinitrohexahydro-1,3,5-triazin).

Bei der Synthese des Nitroesters von 1,2,4,5-Tetrahydroxy-3,6-dinitrocyclohexan wird Essigsäureanhydrid wegen seiner wasserbindenden Fähigkeit eingesetzt:

Darüber hinaus wird Essigsäureanhydrid bei der Herstellung von Alkylcyaniden durch Dehydratisierung von Aldoximen verwendet:
RCH=NOH + (CH3CO)2O → RCN + 2CH3COOH
Darüber hinaus dient Essigsäureanhydrid in zahlreichen Cyclisierungsreaktionen als Dehydratisierungsmittel.
2.3. Reaktionen der α-Protonen
Die Perkin-Reaktion ist eine weit verbreitete Methode zur Synthese von α,β-ungesättigten Säuren aus aromatischen Aldehyden, einschließlich Benzaldehyd. Diese Reaktion findet typischerweise in Gegenwart von Kaliumacetat oder Natriumacetat statt. Es wird auch zur Herstellung von Zimtalessigsäure verwendet.
Ähnliche Reaktionen umfassen die oxidative Carboxymethylierung, bei der Essigsäureanhydrid und Oxidationsmittel verwendet werden, sowie die Umwandlung langkettiger Alkene in ihre entsprechenden Carbonsäurederivate.
2.4. Reaktionen einer einzelnen Carbonylgruppe
In bestimmten Fällen ist es möglich, dass nur eine der Carbonylgruppen im Essigsäureanhydrid an einer Reaktion teilnimmt. Wenn beispielsweise Essigsäureanhydrid in Gegenwart einer Base mit Cyanwasserstoff reagiert, bildet es Verbindung (3). In ähnlicher Weise ergibt Essigsäureanhydrid in Gegenwart eines Grignard-Reagens (RMgBr) Verbindung (4).

2.5. Herstellung von Silberketenid
Wenn Silberacetat und Essigsäureanhydrid in Gegenwart von Pyridin bei Raumtemperatur umgesetzt werden, reagieren sie unter Bildung eines Pyridinkomplexes von Silberketenid. Wenn ein Überschuss an Essigsäureanhydrid verwendet wird, kann die resultierende Mischung einer fraktionierten Destillation von Pyridin und Essigsäure unterzogen werden, was zur Isolierung von Silberketenid führt.
3. Herstellung von Essigsäureanhydrid
Historisch gesehen umfasste die älteste Methode zur Herstellung von Essigsäureanhydrid die Umwandlung von Natriumacetat mit einem Überschuss eines anorganischen Chlorids wie Thionylchlorid, Sulfurylchlorid oder Phosphorylchlorid.
Dabei wird die Hälfte des Natriumacetats in Acetylchlorid umgewandelt, das dann mit dem restlichen Natriumacetat zu Essigsäureanhydrid reagiert.
Eine weitere Entwicklung war die Umwandlung von Essigsäure mit Phosgen in Gegenwart von Aluminiumchlorid, was einen kontinuierlichen Betrieb ermöglichte:
2 CH3COOH + COCl2 → (CH3CO)2O + 2 HCl + CO2
Zwei weitere in der Vergangenheit verwendete Methoden umfassten die Spaltung von Ethylidendiacetat zu Acetaldehyd und Essigsäureanhydrid in Gegenwart von Säurekatalysatoren wie Zinkchlorid sowie die Reaktion von Vinylacetat mit Essigsäure an Palladium(II)-Katalysatoren zu Acetaldehyd und Essigsäureanhydrid. Diese Verfahren haben jedoch keine industrielle Bedeutung mehr.
Derzeit erfolgt die Herstellung von Essigsäureanhydrid hauptsächlich durch das Ketenverfahren oder die Oxidation von Acetaldehyd. Eine weitere Methode, die sogenannte Carbonylierung von Methylacetat (Halcon-Verfahren), wurde 1983 eingeführt.
In Westeuropa werden etwa 77 % des Essigsäureanhydrids durch den Ketenprozess hergestellt, während 23 % durch die Oxidation von Acetaldehyd hergestellt werden.
In den Vereinigten Staaten werden seit der Einführung des Halcon-Verfahrens im Werk Tennessee-Eastman 25 % des Essigsäureanhydrids mit dieser Methode hergestellt, während 75 % mit dem Keten-Verfahren hergestellt werden.
3.1. Ketene-Prozess
Der Ketenprozess umfasst zwei Schritte: die thermische Spaltung von Essigsäure unter Bildung von Keten und die anschließende Reaktion von Keten mit Essigsäure unter Bildung von Essigsäureanhydrid. Die Gesamtreaktionen lassen sich wie folgt zusammenfassen:
1. Thermische Spaltung von Essigsäure:
CH3COOH → CH2=C=O + H2O (ΔH = 147 kJ/mol)
2. Reaktion von Keten mit Essigsäure:
CH2=C=O + CH3COOH → (CH3CO)2O (ΔH = -63 kJ/mol)
Die thermische Spaltung von Essigsäure zur Herstellung von Keten und Wasser erfolgt durch Erhitzen von heißem Essigsäuredampf auf eine Temperatur von 700–750 °C in Gegenwart von Spuren eines Phosphorsäurekatalysators.
Der Reaktordruck wird typischerweise reduziert, um die Isolierung von Keten zu ermöglichen, bevor es mit Essigsäure oder Wasser reagiert. Der Spaltungsprozess findet in einem Multicoil-Reaktor mit Spulen aus hochhitzebeständigen Stahllegierungen wie Sicromal statt.
Der Ketenprozess umfasst je nach gewünschter Produktionskapazität mehrere Schritte und Gerätekonfigurationen.
Bei Kleinbetrieben kommen separate Vorwärm- und Spaltöfen zum Einsatz, während Öfen mittlerer Größe häufig als Einkammeröfen mit Gas- oder Ölbeheizung ausgeführt sind.
Großöfen arbeiten effektiv mit Drei- oder Vierkammersystemen und Teilgasströmen. Es können auch mehrere Öfen mit Essigsäure betrieben werden, die über einen Zentralverdampfer zugeführt wird.
Nach der thermischen Spaltung der Essigsäure wird das entstandene Keten dann mit Essigsäure zu Essigsäureanhydrid umgesetzt. Für diese Reaktion werden üblicherweise zwei Verfahren eingesetzt: das Scrubber-Verfahren und das Wacker-Verfahren.
Beim Scrubber-Prozess wird Keten durch zirkulierende Eisessigsäure in mit Raschig-Ringen gefüllten Wäschern absorbiert. Das Keten wird größtenteils im ersten Wäscher absorbiert und die flüssige Mischung, die Rohanhydrid enthält, wird gesammelt und gekühlt.
Beim Wacker-Verfahren wird das Keten durch eine Flüssigkeitsringpumpe gepumpt, wo es bei kontrollierter Temperatur und kontrolliertem Druck mit Essigsäure reagiert. Das Rohanhydrid wird kontinuierlich gesammelt und ein Teil davon zur Reaktionspumpe zurückgeführt.
Das aus der Reaktion erhaltene Rohanhydrid wird durch Destillation weiter gereinigt. Dabei kommen sowohl kontinuierliche als auch diskontinuierliche Destillationsverfahren zum Einsatz.
Bei der diskontinuierlichen Destillation werden drei Fraktionen erhalten: Vorlauf, Mittellauf und reines Anhydrid.
Bei der kontinuierlichen Destillation werden mehrere Kolonnen zur Trennung der verschiedenen Fraktionen eingesetzt. Die Reinheit des Anhydrids liegt bei der diskontinuierlichen Destillation typischerweise bei etwa 99 %, kann jedoch durch Arbeiten unter reduziertem Druck verbessert werden.
Auch bei der Aufarbeitung kommt das Wacker-Verfahren zum Einsatz, das eine Aufbereitung der Abfallsäuren ohne den Einsatz zusätzlicher Materialien ermöglicht. Das Verfahren zeichnet sich durch hohe Zuverlässigkeit und energiesparende Eigenschaften aus.
Für die Herstellung von 100 kg Essigsäureanhydrid werden unter Berücksichtigung der rückkonzentrierten verdünnten Essigsäure ca. 122 kg Essigsäure benötigt. Die Ausbeute des Verfahrens liegt bei über 96 % bei etwa 75 % Spaltung.
3.2. Oxidation von Acetaldehyd
Essigsäureanhydrid kann auch direkt durch Flüssigphasenoxidation von Acetaldehyd gewonnen werden. Bei diesem Prozess reagiert Peressigsäure, die aus Sauerstoff und Acetaldehyd entsteht, mit einem zweiten Molekül Acetaldehyd zu Essigsäureanhydrid und Wasser.
Dabei kommt es auf eine effiziente Kühlung und den Einsatz geeigneter Katalysatoren an. Häufig verwendete Katalysatoren sind Metallsalzkombinationen wie Manganacetat und Kupferacetat, Kobaltacetat und Nickelacetat oder Kobalt- und Kupfersalze höherer Fettsäuren.
Um die Reaktionstemperatur aufrechtzuerhalten und eine schnelle Hydrolyse von Essigsäureanhydrid zu verhindern, wird das Verfahren typischerweise zwischen 40 °C und 60 °C betrieben.
Aufgrund der exothermen Natur der Reaktion ist eine wirksame Kühlung erforderlich, und die Zugabe von niedrigsiedenden Lösungsmitteln wie Methylacetat und Ethylacetat, die mit Wasser azeotrope Gemische bilden, unterstützt die Abtrennung von Wasser aus dem Reaktionsgemisch.
Das Verhältnis von Essigsäureanhydrid zu Essigsäure im Endprodukt hängt vom anfänglichen Verhältnis von Ethylacetat zu Acetaldehyd ab.
In der Praxis wird eine Mischung aus Acetaldehyd und Ethylacetat unter Zugabe von Kobaltacetat- und Kupferacetat-Katalysatoren oxidiert. Die optimierten Reaktionsbedingungen können zu einem höheren Verhältnis von Essigsäureanhydrid zu Essigsäure führen. Als Verdünnungsmittel können im Verfahren verschiedene Lösungsmittel verwendet werden, darunter Methylenchlorid, Diisopropylether, Cyclohexanon und Ethylidendiacetat.
Das Sauerstoff und Acetaldehyd enthaltende Gasgemisch wird in den Reaktor eingeleitet, wo die Oxidation in flüssiger Phase in Gegenwart von Katalysatoren erfolgt. Anschließend wird der Reaktorabstrom durch einen wassergekühlten Kondensator geleitet, der auch als Abscheider für nicht kondensierbare Gase fungiert.
Frischer Acetaldehyd wird in eine Füllkörperkolonne eingeleitet, wo er sich mit dem Abgas aus dem Kondensator verbindet. Die Kondensate aus Kondensator und Kolonne werden destilliert, um das gewünschte Produkt zu erhalten.
Acetaldehyd wird aus dem nicht kondensierbaren Gasstrom zurückgewonnen. Das Abgas kann brennbare Leichtsieder und Lösungsmittel enthalten, die abgefackelt werden können.
Der oben beschriebene Prozess stellt ein Beispiel dar und Variationen der Reaktorkonfigurationen und spezifischen Reaktionsbedingungen können von verschiedenen Herstellern eingesetzt werden.
3.3. Carbonylierung von Methylacetat
Der herkömmliche Prozess zur Herstellung von Essigsäureanhydrid beinhaltet die thermische Zersetzung von Essigsäure zu Keten, was einen erheblichen Energieaufwand erfordert.
Es wurden jedoch alternative Verfahren entwickelt, beispielsweise das Essigsäure-Produktionsverfahren von Monsanto und die Carbonylierung von Methylacetat.
Die Carbonylierung von Methylacetat zu Essigsäureanhydrid wurde 1973 von Halcon patentiert und die erste Anlage nach diesem Verfahren ging 1983 in Betrieb. Bei diesem Verfahren wird Methylacetat in der flüssigen Phase bei Temperaturen zwischen 160 °C und 190 °C carbonyliert C und ein Kohlenmonoxid-Partialdruck von 2-5 MPa.
Für die Carbonylierungsreaktion können verschiedene Katalysatoren verwendet werden, darunter Rhodium- und Nickelverbindungen, die durch Jodide oder andere jodhaltige Substanzen aktiviert werden. Rhodiumkatalysatoren weisen eine höhere Aktivität als Nickelkatalysatoren auf und beide Katalysatoren weisen eine Selektivität von über 95 % auf.
Die Zugabe eines kleinen Prozentsatzes Wasserstoff zum bei der Synthese verwendeten Kohlenmonoxid erhöht die Aktivität und Lebensdauer der Katalysatoren. Zur Verkürzung der Induktionsphase der Reaktion können auch Chromverbindungen eingesetzt werden.
Der Carbonylierungsprozess kann entweder von Methylacetat oder Dimethylether ausgehen, wobei letzterer vor seiner Umwandlung in Essigsäureanhydrid in Methylacetat umgewandelt wird.
Beim Halcon-Verfahren beispielsweise wird getrocknetes Methylacetat kontinuierlich in einen mit Hastelloy ausgekleideten Reaktor eingespeist, wo es bei 175 °C in Gegenwart einer Katalysatormischung carbonyliert wird.

a) Kompressor; b) Carbonylierungsreaktor; c) Verdampfer; d) Adsorber; e) Destillationskolonne; f) Kondensator; g) Wäscher
Die bei der Reaktion entstehende Wärme wird durch Wärmeaustausch abgeführt und zum Vorheizen von Methylacetat und zur Erzeugung von Niederdruckdampf genutzt. Nicht umgesetztes Kohlenmonoxid wird nach der Entfernung kondensierbarer Gase recycelt.
Ein Seitenstrom wird mit reinem Essigsäureanhydrid gewaschen, um die Bildung von Inertgasen zu verhindern. Das flüssige Reaktionsprodukt, das den Reaktor verlässt, wird einer Flash-Destillation unterzogen, um die katalysatorhaltige Flüssigkeit zur Wiederverwertung abzutrennen.
Das Rohanhydrid wird durch Destillation in drei aufeinanderfolgenden Kolonnen weiter gereinigt, wobei die letzte Kolonne Essigsäureanhydrid mit einer Reinheit von 99 % produziert.
Um den Jodidgehalt im reinen Anhydrid zu reduzieren, kann während des Destillationsprozesses eine Lösung von Kaliumacetat in Essigsäureanhydrid zugesetzt werden.
Diese alternativen Verfahren bieten im Hinblick auf den Energieverbrauch und die Rohstoffausnutzung Vorteile gegenüber der herkömmlichen thermischen Zersetzungsroute und ermöglichen die Herstellung von Essigsäureanhydrid aus anderen Quellen als Öl, beispielsweise Kohle.
4. Verwendung von Essigsäureanhydrid
Essigsäureanhydrid wird häufig sowohl als Acetylierungsmittel als auch als Dehydratisierungsmittel eingesetzt. Eine prominente Anwendung ist die großtechnische Acetylierung von Cellulose. Es gibt jedoch noch mehrere andere Bereiche, in denen Essigsäureanhydrid eingesetzt wird:
1. Herstellung von Poly(methylacrylimid)-Hartschaum, der bei der Umwandlung von Amidgruppen in Imidgruppen als Bindemittel für freigesetztes Ammoniak fungiert.
2. Acetylierte Kunststoffhilfsmittel, einschließlich Glycerintriacetat, Acetyltributylcitrat und Acetylricinolat.
3. Herstellung von Sprengstoffen, insbesondere bei der Herstellung von Hexogen.
4. Herstellung bestimmter Arten von Bremsflüssigkeiten
5. Herstellung von Hilfsmitteln für Bohrspülungen
6. Waschmittelindustrie, insbesondere bei der Herstellung von Kaltbleichaktivatoren wie Tetraacetylethylendiamin.
7. Färbereiindustrie, in der Essigsäureanhydrid in Kombination mit Salpetersäure als Nitrierungsmittel verwendet wird und dabei seine lösenden und entwässernden Eigenschaften nutzt.
8. Herstellung verschiedener organischer Zwischenprodukte wie Chloracetylchlorid, Diacetylperoxid, höhere Carbonsäureanhydride, Acetate und der Bortrifluorid-Komplex.
9. Herstellung von Arzneimitteln, darunter Acetylsalicylsäure (Aspirin), p-Acetylaminophenol, Acetanilid, Acetophenacetin, Theophyllin, Acetylcholinchlorid, Sulfonamide, Hormone, Vitamine und das Röntgenkontrastmittel 2,4,6-Triiod-3,5 -Diacetylamidobenzoesäure.
10. Anwendungen in der Lebensmittelindustrie, vor allem bei der Acetylierung von tierischen und pflanzlichen Fetten zur Erzielung gewünschter Löslichkeiten, der Herstellung von Acetostearinen (essbaren Verpackungsmaterialien) und der Klärung von Pflanzenölen.
11. Aromen und Duftstoffe, soweit sie bei der Herstellung von Estern und Cumarin verwendet werden.
12. Herbizide wie Metolachlor (Dual) und Alachlor (Lasso).
Referenz
- Acetic Anhydride and Mixed Fatty Acid Anhydrides; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a01_065
- https://lotus.naturalproducts.net/compound/lotus_id/LTS0216280
Häufig gestellte Fragen zu Essigsäureanhydrid
Essigsäureanhydrid ist eine organische Verbindung mit der chemischen Formel (CH3CO)2O. Es ist eine farblose Flüssigkeit mit stechendem Geruch und wird häufig als Acetylierungsmittel und Dehydratisierungsmittel verwendet.
Essigsäureanhydrid reagiert heftig mit Wasser, Alkoholen und anderen Substanzen, die aktive Wasserstoffatome enthalten. Diese Reaktion kann exotherm sein und zu Brand- oder Explosionsgefahr führen.
Essigsäureanhydrid hat verschiedene Anwendungen, darunter:
– Acetylierung von Cellulose bei der Herstellung von Celluloseacetat, einem Material, das in Fasern, Filmen und Kunststoffen verwendet wird.
– Herstellung von Arzneimitteln wie Acetylsalicylsäure (Aspirin), Paracetamol und bestimmten Hormonen.
– Herstellung von Chemikalien, einschließlich Acetylierungsmitteln, höheren Carbonsäureanhydriden und bestimmten Estern.
– Synthese von Aromen, Duftstoffen und Herbiziden.
– Verwendung als Dehydratisierungsmittel in verschiedenen industriellen Prozessen.
Bei der Arbeit mit Essigsäureanhydrid ist es wichtig, diese Sicherheitsvorkehrungen zu beachten:
– Tragen Sie zum Schutz vor Haut- und Augenkontakt geeignete persönliche Schutzausrüstung (PSA), einschließlich Handschuhe, Schutzbrille und Laborkittel.
– Arbeiten Sie in einem gut belüfteten Bereich oder verwenden Sie Abzugshauben, um das Einatmen von Dämpfen zu verhindern.
– Halten Sie Essigsäureanhydrid von offenen Flammen, Funken oder Zündquellen fern, da es brennbar ist.
– Gehen Sie vorsichtig vor, um den Kontakt mit Wasser oder anderen reaktiven Substanzen zu vermeiden.
– Lagern Sie Essigsäureanhydrid an einem kühlen, trockenen und gut belüfteten Ort, entfernt von inkompatiblen Materialien.
Essigsäureanhydrid ist ein besseres Acylierungsmittel als Essigsäure, da es leicht eine Acetylgruppe (CH3CO) an die Reaktanten abgibt. Essigsäureanhydrid reagiert effizienter, da kein Wasser vorhanden ist, das die Acylierungsreaktion behindern kann. Die Abwesenheit von Wasser in Essigsäureanhydrid ermöglicht höhere Ausbeuten und schnellere Reaktionsgeschwindigkeiten bei Acylierungsreaktionen.
Die Dichte von Essigsäureanhydrid beträgt bei Raumtemperatur etwa 1,08 Gramm pro Kubikzentimeter (g/cm³).
Wenn Salicylsäure mit Essigsäureanhydrid in Gegenwart eines sauren Katalysators wie Schwefelsäure reagiert, kommt es zu einer Acetylierungsreaktion. Das Essigsäureanhydrid gibt eine Acetylgruppe an die Hydroxylgruppe der Salicylsäure ab, was zur Bildung von Acetylsalicylsäure führt, die allgemein als Aspirin bekannt ist.
Essigsäureanhydrid selbst ist nicht von Natur aus explosiv. Allerdings kann es ab bestimmten Konzentrationen mit Luft explosionsfähige Gemische bilden. Essigsäureanhydrid sollte aufgrund seiner Reaktivität und Entflammbarkeit mit Vorsicht gehandhabt werden. Es ist wichtig, Essigsäureanhydrid gemäß den entsprechenden Sicherheitsprotokollen zu lagern und zu handhaben, um das Risiko von Unfällen zu minimieren.
