Cyclohexanon: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist Cyclohexanon?
Cyclohexanon, auch bekannt als Ketohexamethylen oder Pimelinketon, ist eine organische Verbindung mit der chemischen Formel C6H10O. Es ist eine farblose bis blassgelbe Flüssigkeit mit einem Geruch ähnlich dem von Aceton, die in den meisten organischen Lösungsmitteln sehr gut löslich ist.
Es wurde zuerst durch Trockendestillation von Calciumpimelat und später von Bouveault durch katalytische Dehydrierung von Cyclohexanol synthetisiert.
Cyclohexanon wird industriell in großem Maßstab als Rohstoff für die Nylonherstellung hergestellt.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Cyclohexanon
Cyclohexanon ist eine farblose Flüssigkeit mit einem Geruch ähnlich dem von Pfefferminze und Aceton. Es ist sehr gut löslich in Methanol, Ethanol, Aceton, Benzol, n-Hexan, Nitrobenzol, Diethylether, Naphtha, Xylol, Ethylenglykol, Isoamylacetat, Diethylamin und den meisten organischen Lösungsmitteln.
Cyclohexanon kann eine Vielzahl von Produkten lösen, wie z. B. Cellulosenitrat, Celluloseacetat, Celluloseether, Vinylharze, Rohgummi, Wachse, Fette, Schellack, basische Farbstoffe, Öle, Latex, Bitumen, Kaure und Elemi. Es bildet ein Azeotrop mit Wasser, das bei 96,6 °C siedet und dessen Zusammensetzung Wasser:Cyclohexanon 56:44 beträgt.
Die physikalischen Eigenschaften von Cyclohexanon sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | [108-94-1] |
| Chemische Formel | C6H10O |
| Molekulargewicht | 98,15 g/mol |
| Schmelzpunkt | -47 °C |
| Siedepunkt | 156,4 °C |
| Dampfdruck | 0,52 kPa bei 20 °C |
| Dichte | 0,9455 g/cm3 |
| Brechungsindex | 1,4552 |
| Ausdehnungskoeffizient | 9,14 × 10-4 |
| Dynamische Viskosität | 1,803 mPa · s bei 30 °C |
| Spezifische Wärme | 1,811 j/g |
| Oberflächenspannung | 33,51 mN/m bei 30 °C |
| Schmelzwärme | 1,501 kJ/mol |
| Verbrennungswärme | -3,521 MJ/mol |
| Verdampfungswärme | 44,92 kJ/mol |
| Bildungswärme | -272 kJ/mol |
| Blitz Punkt | 54 °C |
| Zündungstemperatur | 420 °C |
| Wasserlöslichkeit bei 20 °C | 9,0 g/100 g Wasser |
2. Reaktionen von Cyclohexanon
Aufgrund der Anwesenheit einer Carbonylgruppe durchläuft Cyclohexanon eine Reihe von Reaktionen, die typisch für aliphatische Ketone sind. Bei Raumtemperatur liegen etwa 0,02 % des Moleküls im Enol-Tautomer vor.
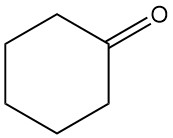
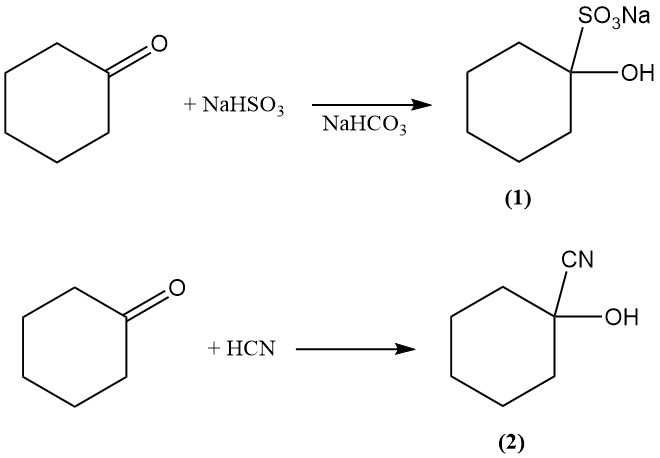
Die Additionsreaktion von Cyclohexanon mit Bisulfit und Cyanwasserstoff erzeugt 1-Hydroxycyclohexan-1-sulfonat (1) bzw. 1-Hydroxycyclohexan-1-carbonitril (2).
Bei der Grignard-Reaktion entstehen nach der Hydrolyse tertiäre Alkohole.
Die katalytische Hydrierung oder Reduktion von Cyclohexanon mit Natriumborhydrid oder Lithiumaluminiumhydrid ergibt Cyclohexanol, während unter strengeren Bedingungen Cyclohexan entsteht.
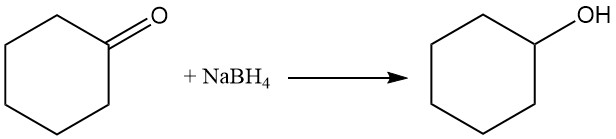
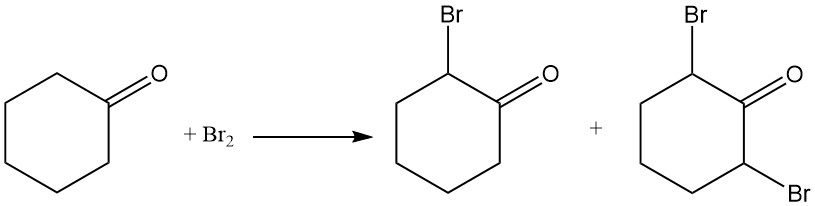
Cyclohexanon reagiert mit Chlor oder Brom und bildet halogenierte Verbindungen an der α-Position oder an den Positionen 2 und 6.
Es kann leicht eine basenkatalysierte Aldolkondensation mit sich selbst oder mit anderen Aldehyden oder Ketonen eingehen.
Cyclohexanon bildet Enamine, wenn es mit sekundären Aminen reagiert.
Industriell wichtige Reaktionen von Cyclohexanon sind die Bildung von Cyclohexanonoxim durch Reaktion mit Hydroxylamin und die Oxidation mit Salpetersäure zu Adipinsäure.
3. Industrielle Produktion von Cyclohexanon
Cyclohexanon wird kommerziell durch die folgenden Hauptprozesse produziert:
- Dehydrierung von Cyclohexanol
- Oxidation von Cyclohexan
- Hydrierung von Phenol
Die meisten Großanlagen verwenden Cyclohexanoxidationstechnologie, um eine Mischung aus Cyclohexanol und Cyclohexanon herzustellen. DSM in Holland und Allied Signal Corp. in den Vereinigten Staaten sind die einzigen verbliebenen Großanlagen, die noch die Hydrierung von Phenol verwenden.
Zur Oxidation von Cyclohexanol zu Cyclohexanon werden katalytische und nichtkatalytische Prozesse verwendet.
3.1. Produktion von Cyclohexanon durch Hydrierung von Phenol
Die Verteilung der Phenolhydrierungsprodukte, einschließlich Cyclohexanol, Cyclohexanon oder deren Mischung, hängt von der Wahl des Katalysators und den Reaktionsbedingungen ab.
Abbildung 1 veranschaulicht die Dampfphasenproduktion von Cyclohexanon aus Phenol.
a) Phenolverdampfer; b) Hydrierungsreaktor; c) Kondensator; d) Kolonne zur Entfernung leichtsiedender Bestandteile; e) Kolonne zur Rückgewinnung von Cyclohexanol/Cyclohexanon
Bei der Hydrierung von Phenol zu Cyclohexanon in der Dampfphase kommen verschiedene trägergestützte Edelmetallkatalysatoren zum Einsatz, darunter Palladium, Platin, Iridium, Ruthenium, Rubidium und Osmium. Die Reaktion findet bei 140–170 °C unter Atmosphärendruck statt und erreicht bei vollständiger Umwandlung eine Ausbeute von 95 %.
Die kommerzielle Flüssigphasenhydrierung von Phenol unter Verwendung von Palladium auf einem Kohlenstoffkatalysator ergibt unter milden Bedingungen >99 % Cyclohexanon bei 90 % Umwandlung.
3.2. Herstellung von Cyclohexanon durch Dehydrierung von Cyclohexanol
Bei der Dehydrierung von Cyclohexanon entsteht Cyclohexanon, ein Vorläufer von Caprolactam.
Die nichtkatalytische Dampfphasendehydrierung von Cyclohexanol wird bei einer Temperatur von 400–450 °C durchgeführt. Die entstehenden Dämpfe werden gekühlt, Wasserstoff wird abgetrennt und das Rohcyclohexanon, das Cyclohexen und Wasser als Nebenprodukte enthält, wird durch Destillation gereinigt. Die resultierende Cyclohexanonreinheit erreicht 98–99 %.
Die katalytische Dehydrierung von Cyclohexanol zu Cyclohexanon unter Verwendung von Katalysatoren wie Chromoxid-Kupfer, Kupferchromat, Nickel, Zinksulfid, Zink-Eisen, Kobaltcarbonat und anderen Metallen erfolgt unter milderen Bedingungen und liefert bessere Erträge.
3.3. Herstellung von Cyclohexanon durch Oxidation von Cyclohexan
Die Flüssigphasen-Luftoxidation von Cyclohexan zu Cyclohexanol und Cyclohexanon wird üblicherweise entweder unkatalysiert oder mit einem löslichen Kobaltkatalysator in einer Reihe von Rührreaktoren oder einem einzelnen Turmoxidator bei einer Temperatur von 140–180 °C und einem Druck von 0,8–2 MPa durchgeführt.
Cyclohexylhydroperoxid ist ein Zwischenprodukt dieser Reaktion und wird von den Oxidationsmitteln in Cyclohexanol, Cyclohexanon und Nebenprodukte umgewandelt.
Wenn dem Luftoxidator Chrom(III) zugesetzt wird, katalysiert es die Dehydratation von Cyclohexylhydroperoxid zu Cyclohexanon und Wasser, was zu einer höheren Selektivität für Cyclohexanon führt.
Eine weitere Methode, das Verhältnis von Cyclohexanon zu Cyclohexanol im Endprodukt zu erhöhen, besteht in der Zersetzung des Cyclohexylhydroperoxids mit einer wässrigen, einige ppm Kobalt enthaltenden Ätzphase.
Ein Flussdiagramm dieses Ätzverfahrens ist in Abbildung 2 dargestellt.
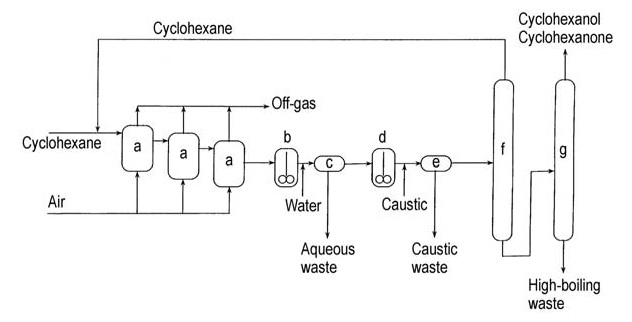
a) Luftoxidationsmittel; b) Wasserwaschdekanter; c) Dekantieren; d) Laugenzersetzungsreaktor; e) Laugendekantieren; f) Cyclohexan-Rückgewinnungssäule; g) Cyclohexanol-/Cyclohexanon-Rückgewinnungssäule
Das Rohprodukt in diesem Verfahren enthält eine Mischung aus Cyclohexanon und Cyclohexanol, die durch Destillation getrennt und durch Dehydrierung in Cyclohexanon umgewandelt werden kann, um die Gesamtausbeute an Cyclohexanon zu erhöhen.
4. Verwendung von Cyclohexanon
Über 97 % des gesamten produzierten Cyclohexanons wird als Rohstoff für die Herstellung von Adipinsäure und Caprolactam verwendet, die bei der industriellen Nylonherstellung eingesetzt werden.
Cyclohexanon wird auch als Lösungsmittel für Lacke, Harze, Polymere und andere Verbindungen verwendet. Weitere Verwendungszwecke sind als Ausgangsstoff bei der Synthese von Insektiziden, Herbiziden und Arzneimitteln.
Cyclohexanon wird bei der Herstellung von Magnet- und Videobändern verwendet.
Die Einhaltung der kalifornischen Regel 66 erlaubt seine Verwendung als Isophoronersatz für Harz- und Polymerlösungsmittelanwendungen.
5. Toxikologie von Cyclohexanon
Cyclohexanon weist bei oraler, dermaler und inhalativer Exposition eine geringe Toxizität auf. Der Kontakt mit Flüssigkeiten oder Dämpfen kann eine vorübergehende Hornhautverletzung verursachen. Längerer oder starker Hautkontakt kann Reizungen und Entfettung verursachen.
Inhalationsexposition verursacht Lungenverstopfung, Ödeme und Blutungen. Hohe Dampfkonzentrationen oder wiederholte Exposition können zu einer Depression des ZNS führen.
Die LD50-Werte lagen in Tierstudien zwischen 0,93 und 1,54 g/kg (ip) und 1,8 und 2,1 g/kg (intragastrisch), wobei Meerschweinchen die höchste Empfindlichkeit zeigten.
Obwohl sowohl positive als auch negative Ergebnisse zur genetischen Aktivität vorliegen, bleiben die Beweise für die Karzinogenität nicht schlüssig. Cyclohexanon zeigte bei Ratten und Mäusen keine Teratogenität.
Inhalationsstudien über zwei Generationen an Ratten zeigten keine nachteiligen Auswirkungen auf Wachstum, Entwicklung oder Fortpflanzung bei 1000 ppm für eine Generation oder 250/500 ppm für zwei Generationen.
Die Exposition der Nachkommen gegenüber 1400 ppm führte zu reversiblen Auswirkungen, darunter Lethargie, verringerte männliche Fruchtbarkeit sowie Überlebens- und Gewichtsabnahme der Nachkommen.
Es wurde ein NOEL von mindestens 500 ppm festgelegt. OSHA PEL und ACGIH TLV für Cyclohexanon betragen 25 ppm (100 mg/m³) mit Angabe der Hautabsorption.
Es gelten die üblichen Vorsichtsmaßnahmen beim Umgang mit flüchtigen Lösungsmitteln, darunter Belüftung, Vermeidung von Einatmen und Hautkontakt, Verhinderung der Einnahme und Augenschutz.
Referenzen
- Cyclohexanol and Cyclohexanone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_217.pub2
- Cyclohexanol and Cyclohexanone. – https://onlinelibrary.wiley.com/doi/full/10.1002/0471238961.0325031206091908.a01
- https://www.sciencedirect.com/science/article/abs/pii/0041008X7990454X
- https://onlinelibrary.wiley.com/doi/10.1002/0471743984.vse2329.pub2
- https://pubchem.ncbi.nlm.nih.gov/compound/Cyclohexanone
