Chlordioxid: Eigenschaften, Herstellung und Verwendung
Chlordioxid ist eine anorganische chemische Verbindung mit der Formel ClO2. Es liegt bei Raumtemperatur als gelbgrünes Gas vor, als rotbraune Flüssigkeit zwischen 11 °C und −59 °C und als leuchtend orangefarbene Kristalle unterhalb von −59 °C °C. Es wird normalerweise als wässrige Lösung gehandhabt und vor Ort für industrielle Anwendungen hergestellt.
Chlordioxid wird hauptsächlich beim Bleichen von chemischem Holzzellstoff verwendet. Historisch gesehen war elementares Chlor das dominierende Bleichmittel. Aufgrund erheblicher Umweltbedenken bei seiner Verwendung ist Chlordioxid jedoch seit Ende der 1980er Jahre zur bevorzugten Alternative geworden.
Inhaltsverzeichnis
1. Eigenschaften von Chlordioxid
Chlordioxid (ClO2) ist eine Chlor-Sauerstoff-Verbindung mit einem Chloratom mit der Wertigkeit vier. Es besitzt ein Molekulargewicht von 67,45 g/mol, einen Schmelzpunkt von -59 °C und einen Siedepunkt von 11 °C.
Diese Eigenschaft macht Chlordioxid bei Raumtemperatur zu einem Gas. Dieses Gas hat einen ausgeprägten Geruch, der dem von Chlor ähnelt, aber einen stechenden Charakter hat. Es ist in geringen Konzentrationen leicht nachweisbar. Das Einatmen mäßiger Konzentrationen kann jedoch gefährlich sein und zu Atemwegsschäden führen.
Aus Sicherheits- und wirtschaftlichen Gründen gibt es kommerziell erhältliches Chlordioxid nicht in reiner gasförmiger, flüssiger oder fester Form. Für kleine Mengen stehen stabilisierte Formen zur Verfügung.
Chlordioxid löst sich leicht in Wasser und weist je nach Konzentration (sowohl in der Gas- als auch in der Lösungsphase) eine Farbe auf, die von blassgelb bis dunkelgrüngelb reicht. Es ist in reinem Wasser gut löslich und erreicht etwa 60 g/L. Die Löslichkeit ist umgekehrt proportional zur Temperatur; sie nimmt mit steigender Temperatur ab. Der Lösungsprozess beinhaltet keine Hydrolyse oder Dimerisierung.
Chlordioxid hat ein Absorptionsmaximum bei 360 nm. Obwohl dieser Peak nicht besonders ausgeprägt ist, kann er zur Messung der Chlordioxidkonzentration in Gasen, wässrigen und sogar organischen Lösungen verwendet werden.
Das Chlordioxidmolekül ist aus thermodynamischer Sicht von Natur aus instabil. Kinetische Einschränkungen ermöglichen die Handhabung in der Gasphase, es bestehen jedoch strenge Einschränkungen. Der Dampfdruck darf 10–12 kPa nicht überschreiten, um eine schnelle Zersetzung mit potenzieller Explosionsgefahr zu verhindern.
Chlordioxid ist relativ stabil, wenn es in wässrigen Lösungen absorbiert wird (aufgrund der Wärme der Lösung), insbesondere unter kühlen und dunklen Bedingungen. Der Dampfdruck über solchen Lösungen erfordert jedoch Konzentrationsbeschränkungen (ca. 1 Gew.-%), um einen gefährlichen Dampfdruckaufbau zu vermeiden. Darüber hinaus kann es zur Bildung von kristallinem ClO2·8 H2O kommen.
Chlordioxid kann auch in verschiedenen anderen Lösungsmitteln gelöst werden.
Die beiden Chlor-Sauerstoff-Bindungen besitzen Doppelbindungscharakter mit einem Bindungswinkel von 117,5°. Mit 19 Valenzelektronen, darunter ein ungepaartes Elektron, weist Chlordioxid ein radikalähnliches Verhalten auf, das vielfältige Reaktionswege ermöglicht.
Wie alle Chloroxide besteht bei thermischem oder physikalischem Schock ein hohes Explosionsrisiko. Eine Kompression der Gasphase ist unbedingt zu vermeiden.
Chlordioxid wirkt als starkes Oxidationsmittel und verursacht eine spontane und manchmal explosionsartige Entzündung organischer Stoffe. In wässrigen Lösungen oxidiert es Kohlenwasserstoffe zu Ketonen und Alkoholen.
2. Industrielle Produktion von Chlordioxid
Chlordioxid (ClO2) wird entweder aus Natriumchlorit (NaClO2) oder Natriumchlorat (NaClO3) hergestellt. Beide Ausgangsstoffe sind trotz ihres Oxidationspotentials relativ stabil.
Zu den Produktionsmethoden gehört entweder die Reduktion von Chlorat oder die Oxidation von Chlorit. Allerdings bleibt die Chloratreduktion aufgrund ihrer Kosteneffizienz die vorherrschende Methode, insbesondere bei großtechnischen Anwendungen mit mehr als 2.000 kg ClO2 pro Tag. Kleinere Betriebe können entweder Chlorit oder Chlorat verwenden.
Die Hauptreaktion zur Chloratreduktion ist:
ClO3– + Reduktionsmittel + Säure → ClO2 + Nebenprodukte
Dieser Prozess findet in einem starken Elektrolytmedium statt, das eine starke Säure (Schwefelsäure oder Salzsäure) enthält ein Reduktionsmittel (normalerweise Methanol). Das Reduktionsmittel reduziert selektiv die Wertigkeit des Chloratoms um eine Einheit. Die Aufrechterhaltung eines stöchiometrischen Überschusses an Säure und Reduktionsmittel optimiert die Wirtschaftlichkeit, da Chlorat der teuerste Rohstoff ist.
Kosteneffizienz ist ein entscheidender Faktor bei der Prozessauswahl. Ebenso wichtig sind jedoch die Zugänglichkeit und Sicherheit der ClO2-Versorgung. Effektive Chlordioxid-Produktionsprozesse minimieren die Umweltbelastung und halten die Sicherheitsvorschriften ein.
Heutzutage gibt es zwei wesentliche Verfahrensanordnungen zur Reduzierung von Chlorat:
- Vakuumprozesse bieten einen komplexeren Ansatz, bieten aber insgesamt eine bessere Produktionsökonomie für Großbetriebe. Diese Prozesse halten die Rohstoffe im Reaktor zurück, während Nebenproduktsalze kristallisiert und abgetrennt werden.
- Atmosphärische Prozesse nutzen eine Reaktorreihe, um eine vollständige Reaktion zu erreichen. Der verbrauchte Säureabfluss aus diesen Systemen enthält Nebenprodukte, restliches Chlorat und erhebliche Mengen an Säure.
Der Produktionsprozess ist nicht so einfach, wie es scheint; Es kann mehrere konkurrierende und parallele Reaktionen geben, die oft 10–20 Einzelschritte umfassen.
Um optimale Erträge und Generatorwirkungsgrade zu erzielen, ist eine sorgfältige Kontrolle der Reaktantenkonzentrationen und der Reinheit unerlässlich. Prozessanpassungen können ohne nennenswerte Investitionen vorgenommen werden, um spezifische Produktionskapazitäten und minimale Anforderungen an die Bildung von Nebenprodukten zu erfüllen.
2.1. Herstellung von Chlordioxid aus Chlorat mit Methanol als Reduktionsmittel
Die Reaktion zwischen Natriumchlorat, Methanol und Schwefelsäure stellt den führenden industriellen Weg zur Chlordioxidproduktion dar:
9 NaClO3 + 2 CH3OH + 6 H2SO4 → 9 ClO2 + 3 Na3H(SO4)2 + 0,5 CO2 + 1,5 HCOOH + 7 H2O
Diese Gleichung scheint einfach, beinhaltet jedoch zahlreiche konkurrierende Reaktionsschritte. Dennoch bleibt dieses Verfahren die kostengünstigste und zuverlässigste Methode und macht etwa 75 % der weltweiten ClO2-Produktion aus. Es bietet mehrere Vorteile:
- Wirtschaftliche Effizienz: Der Prozess hat niedrige Betriebskosten.
- Zuverlässigkeit: Eine konsistente und zuverlässige Produktion ist erreichbar.
- Minimale Chlorbildung: Die Bildung von elementarem Chlor ist minimal, typischerweise unter 0,1 g/L in 10 g/L ClO2 Lösung.
- Nebenproduktkompatibilität: Die erzeugte Ameisensäure (HCOOH) hemmt nicht nachgeschaltete Bleichprozesse.
Die wichtigsten Prozesse, die diese Methodik anwenden, sind SVP-LITE (Eka Chemicals) und das zugehörige R8 (ERCO Worldwide).
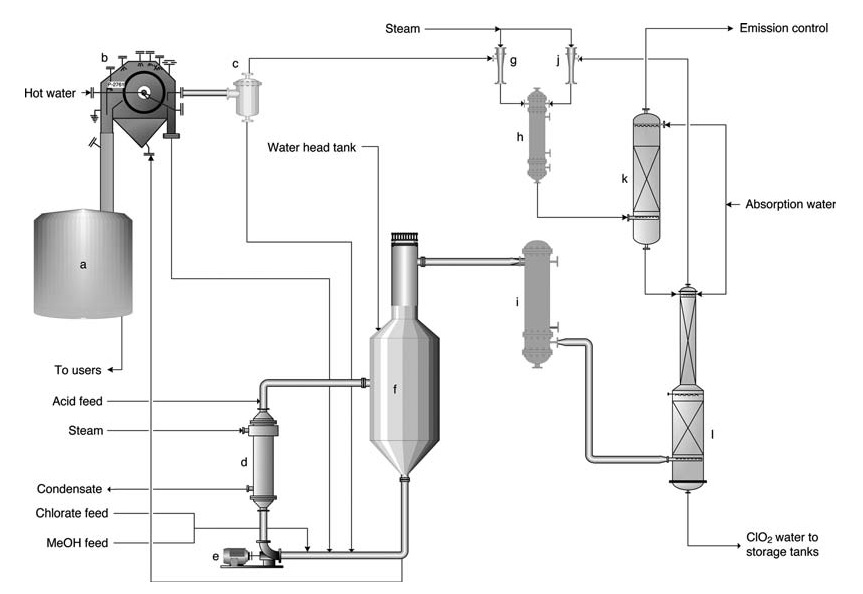
a) Salzkuchen-Auflösungstank; b) Salzkuchenfilter; c) Filtrataufnahmetank; d) Reboiler; e) Generatorumwälzpumpe; f) SVP-Generator; g) Ejektor für Filtervakuum; h) Ejektor-Dampfkondensator; i) Hauptinjektor für Prozessvakuum; j) Gaskühler; k) Belüftungswäscher; l) Absorptionsturm
Der SVP-LITE-Prozess (Abbildung 1) verwendet ein Zirkulationssystem in einem unter Vakuum gehaltenen Hauptreaktorbehälter. Reaktanten (Chlorat, Methanol und Schwefelsäure) werden in den Reaktor eingeführt, wo sie unter Bildung von ClO2 und der Ausfällung von Nebenproduktsalzen reagieren.
Wärme wird durch einen Reboiler und aus der Verdünnungswärme der Schwefelsäure bereitgestellt. Chlordioxid verlässt den Reaktor zusammen mit verdampftem Wasser und wird anschließend in einem Absorptionsturm im Wasser absorbiert.
Die resultierende ClO2-Lösung wird dann in den Speicher gepumpt. Das Abgas des Absorbers wird einer weiteren Wäsche unterzogen, um die Emissionen zu minimieren. Ein Teil der Reaktorlösung wird zur Entfernung von Nebenproduktsalzen zu einem Filter umgeleitet, bevor er wieder in den Reaktor zurückgeführt wird.
Zur Vereinfachung des Betriebs wird das feste Salz normalerweise erneut aufgelöst und dem chemischen System der Mühle zugeführt.
Die Produktionsraten liegen im Allgemeinen zwischen 5 und 60 Tonnen pro Tag. Das Endprodukt enthält 9–10 g/L ClO2 und ist praktisch frei von elementarem Chlor (Cl2-Gehalt liegt typischerweise unter 0,1 g/L, aber garantiert unter 0,2). g/L).
Das unverarbeitete Nebenproduktsalz aus dem Generator ist typischerweise ein saures Sulfatsalz, bekannt als Natriumsesquisulfat (Na3H(SO4)2). Der Prozess kann jedoch modifiziert werden, um neutrales Natriumsulfat (Na2SO4) zu erhalten.
Diese Umwandlung wird durch die Umwandlung von Natriumsesquisulfat in einer speziellen Anlageneinheit erreicht (was zu den Prozessnamen SVP-SCW bzw. R10 führt).
Der Sesquisulfatstrom aus dem Reaktorsystem wird in einen Misch-/Metathesetank geleitet, wo er teilweise in Natriumsulfat umgewandelt wird, das dann durch Umkristallisation und Filtration abgetrennt wird. Die saure Lösung wird dann in den ClO2-Reaktor zurückgeführt.
Die Umwandlung des sauren Salzes in eine neutrale Form bietet erhebliche Vorteile, wie z. B. einen geringeren Säureverbrauch und ein geringeres Salzkuchenvolumen.
2.2. Herstellung von Chlordioxid aus Chlorat unter Verwendung von Wasserstoffperoxid als Reduktionsmittel
Wasserstoffperoxid (H2O2) kann auch als Reduktionsmittel auf Chloratbasis verwendet werden ClO2 Produktion. Bei diesem Prozess entsteht als Nebenprodukt Sauerstoff (O2), der an die Atmosphäre abgegeben wird:
NaClO3 + 0,5 H2O2 + 0,5 H2SO4 → ClO2 + 0,5 Na2SO4 + 0,5 O2 + H2O
Trotz ihrer scheinbaren Einfachheit ist die tatsächliche Reaktion komplexer. Das Nebenproduktsalz unter Vakuumbedingungen kann je nach Säuregehalt des Reaktors entweder Natriumsulfat oder Natriumsesquisulfat sein. Obwohl der Betrieb bei höherem Säuregehalt die Produktion von Natriumsesquisulfat ermöglicht, geht dies jedoch mit einem erhöhten Säureverbrauch und der Bildung von Salzkuchen einher.
Die Vorteile von Wasserstoffperoxid sind wie folgt:
- Erhöhte Kapazität: Die schnellere Reaktionskinetik von Wasserstoffperoxid ermöglicht eine höhere Produktionskapazität in bestehenden ClO2-Anlagen mit minimalem Kapitalaufwand Investition.
- Sichereres Reduktionsmittel: Wasserstoffperoxid bietet eine sicherere Alternative im Vergleich zu anderen Reduktionsmitteln wie Methanol, Schwefeldioxid oder Chlorid.
- Potenzial für neutralen Salzkuchen: Prozessmodifikationen können zu einem neutralen Salzkuchen führen und so die Umweltbelastung reduzieren.
- Reineres Chlordioxid: Die Verwendung von Wasserstoffperoxid kann zu einem reineren ClO2-Produkt beitragen.
Ähnlich wie Methanol-basierte Vakuumprozesse (Abbildung 1) verwenden Vakuumprozesse die Handelsnamen SVP-HP oder R11 (letzteres verwendet einen Katalysator).
Der gebräuchlichste Prozess unter atmosphärischen Bedingungen ist der HP-A-Prozess von Eka Chemicals (Abbildung 2), der auch auf Solvay-, Mathieson- und R2-Prozesse anwendbar ist. Dieser Prozess wird aufgrund seines ähnlichen Designs typischerweise als Upgrade für ältere Installationen implementiert.
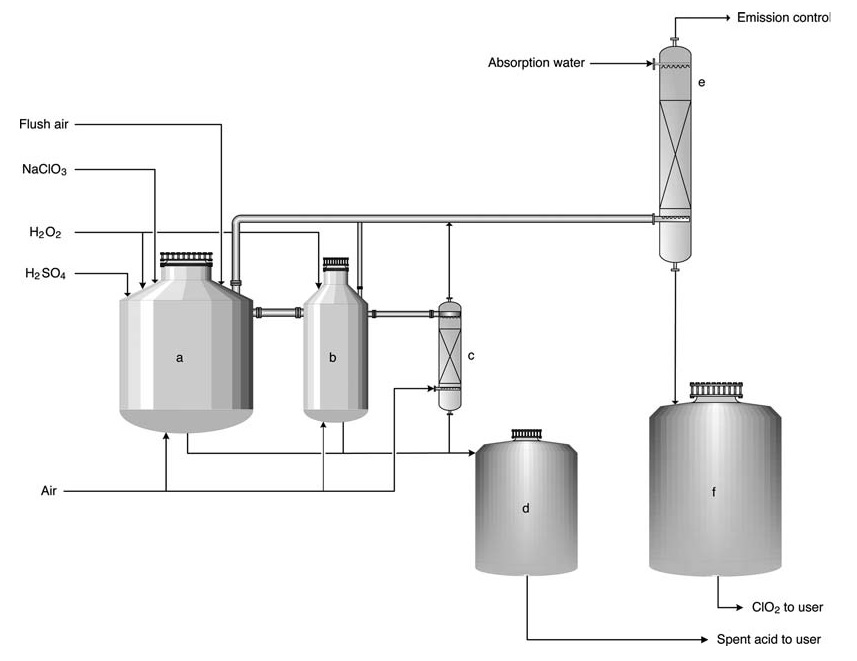
a) Primärreaktor; b) Sekundärreaktor; c) Stripper; d) Tank für verbrauchte Säure; e) Absorptionsturm; f) Lagertank für ClO2-Lösung
Im HP-A-Prozess werden Reaktanten in eine Reihe (normalerweise 2-3) offener Reaktoren eingespeist. Der Prozess ist im Wesentlichen adiabatisch und beruht auf der Verdünnungswärme der Schwefelsäure, um die Reaktionstemperatur (typischerweise 58 °C) und einen leichten Unterdruck aufrechtzuerhalten. Der Großteil der Chloratumwandlung zu Chlordioxid findet im ersten Reaktor statt.
Das Nebenprodukt Salz bleibt in Lösung, während große Luftmengen eingeführt werden, um ClO2 zu desorbieren und die Gaskonzentrationen unter der Explosionsgrenze zu halten (10 –12 Vol.-%). Das Gas wird dann zur ClO2-Wasserproduktion in einen Absorptionsturm geleitet.
Abgenutzte Säure kann zur Ansäuerung der Mühle oder zur Ergänzung im Rückgewinnungskesselsystem verwendet werden. Das Produkt enthält 8 g/L Chlordioxid und ist nahezu frei von elementarem Chlor (Cl2-Konzentration < 0,2 g/L).
Für kleinere Anwendungen wie Wasseraufbereitung oder Biozidproduktion eignet sich der SVP-Pure-Prozess von Eka Chemicals (Abbildung 3) bietet eine kostengünstige und einfache Lösung. Bei diesem Verfahren wird eine vorgemischte Chlorat- und Wasserstoffperoxidlösung zusammen mit Schwefelsäure verwendet.
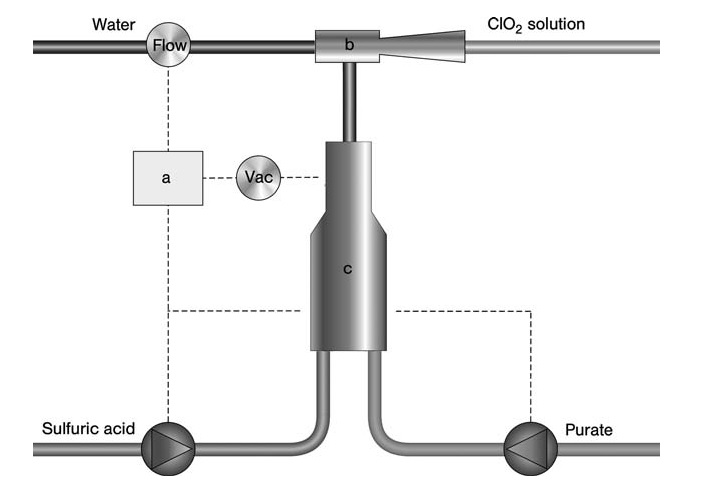
a) Controller; b) Ausbilder; c) Reaktor
Alle Reaktanten werden mithilfe eines Eduktors, der von einem Wasserstrom angetrieben wird, gleichzeitig in einen Unteratmosphärenreaktor eingespeist. Dieser Wasserstrom absorbiert das erzeugte ClO2 und Nebenprodukte und bildet das Endprodukt (Chlordioxid in Wasser).
Das gesamte System ist kompakt und wird von einem Mikroprozessor gesteuert, was eine bedarfsgerechte Produktion mit direkter Anwendung des Produkts ermöglicht. Der ClO2-Gehalt in diesem Prozess liegt typischerweise zwischen 1 und 1,5 g/L, wobei Varianten für Bleichanwendungen bis zu 7 g/L erreichen.
2.3. Herstellung von Chlordioxid aus Chlorat unter Verwendung von Schwefeldioxid als Reduktionsmittel
Schwefeldioxid (SO2) kann als Reduktionsmittel in chloratbasierten Prozessen eingesetzt werden. Diese Integration bot wirtschaftliche und betriebliche Vorteile und trug zur Popularität des Mathieson-Verfahrens in den 1950er Jahren bei.
Das Mathieson-Verfahren spielte zusammen mit den Solvay- und R2-Verfahren eine wichtige Rolle bei der Herstellung von Chlordioxid für Zellstoffbleichanwendungen. Allerdings hat seine Bedeutung in letzter Zeit abgenommen.
Der Mathieson-Prozess folgt einer leicht exothermen Reaktion, wie durch die Gleichung dargestellt:
2 NaClO3 + H2SO4 + SO2 → 2 ClO2 + 2 NaHSO4
Während eine konkurrierende Reaktion zur Chlorbildung führen kann, kann diese unterdrückt werden und der Großteil des erzeugten Chlors reagiert weiter. Allerdings ist die Reaktionskinetik relativ langsam, was zu einer unvollständigen Chloratumwandlung führt.
Die Zugabe von 1–10 Gew.-% Natriumchlorid im Verhältnis zu Chlorat ist eine gängige Praxis, um die Reaktionsgeschwindigkeit zu erhöhen. Dieser Zusatz erhöht jedoch auch die Bildung von Chlor als Nebenprodukt, was bei bestimmten Anwendungen unerwünscht sein kann.
Das Mathieson-Prozesslayout ähnelt stark dem HP-A-Prozess (Abbildung 2). Der Hauptunterschied liegt im Fehlen von Wasserstoffperoxid-Einlässen. Stattdessen wird Schwefeldioxid durch die Einblasluft eingeführt.
2.4. Herstellung von Chlordioxid aus Natriumchlorit
Natriumchlorit (NaClO2) kann auch als Rohstoff für die Chlordioxiderzeugung verwendet werden, vor allem für Anwendungen im kleinen Maßstab. Einige Trinkwasseraufbereitungsanlagen verwenden diese Methode jedoch möglicherweise für die Produktion in größerem Maßstab (bis zu mehreren Tonnen pro Tag). Es gibt zwei Hauptmethoden:
- Durch Aktivierung mit einer Säure
Dabei reagiert Chlorit mit einer Säure (Salzsäure, HCl), wie in der folgenden Gleichung dargestellt:
5 NaClO2 + 4 HCl → 4 ClO2 + 5 NaCl + H2O
Schwefelsäure kann ein Ersatz sein, führt jedoch aufgrund der fehlenden Chloridkatalyse zu geringeren Produktionsraten. Diese Methode ist zwar teurer und verursacht 25 % höhere Produktionskosten, liefert aber ein chlorfreies ClO2-Produkt.
- Durch Aktivierung mit Chlor
Bei dieser Methode wird elementares Chlor entweder in der Gasphase oder in Wasser gelöst verwendet (wo es zu hypochloriger Säure und Salzsäure hydrolysiert). Die Gesamtreaktion wird in der Gleichung dargestellt:
2 NaClO2 + Cl2 → 2 ClO2 + 2 NaCl
Das mit Chlorgas aktivierte Verfahren ist seit langem der Industriestandard. Dieses System mit zwei Zuführungen nutzt die schnelle Reaktion zwischen molekularem Chlor und Chloritionen.
Bei der Rio-Linda-Methode werden Natriumchloritlösung und gasförmiges Chlor getrennt zugeführt, sodass sie reagieren können, bevor sie von einem Wasserstrom über einen Eduktor in die Anwendung gesaugt werden, der den erforderlichen Unterdruck erzeugt.
2.5. Herstellung von Chlordioxid durch elektrochemische Prozesse
Chlordioxid kann durch elektrochemische Methoden aus Natriumchlorit hergestellt werden, normalerweise begleitet von Natriumhydroxid-Produktion. Die Elektrochemie ermöglicht eine genaue Kontrolle der ClO2-Produktion; Allerdings sind Elektroden und Membranen anfällig für Verunreinigungen, sodass für einen optimalen Betrieb entionisiertes Wasser erforderlich ist.
Die Chloritoxidation zu Chlordioxid findet an der Anode statt, und Natriumionen wandern durch eine Membran zur Kathodenseite, wo durch Wasserelektrolyse Wasserstoffgas und Hydroxidionen entstehen.
Elektrolyse kann auch zur Erzeugung der Säure genutzt werden, die für die Aktivierung von Chlorit im Natriumchloritprozess benötigt wird.
Das erzeugte Chlordioxid wird vor der Verwendung durch Luftstrippung von der Chloritlösung getrennt.
Elektrochemie kann auch eingesetzt werden, um die Bildung von Salzkuchen in großtechnischen Prozessen auf Chloratbasis zu minimieren. Diese Methode reduziert den Schwefelsäureverbrauch durch die Verwendung elektrochemisch erzeugter Protonen und die Entfernung von Natriumionen durch gleichzeitig erzeugte Natronlauge.
Obwohl diese elektrochemischen Prozesse umweltfreundlich sind, erfordern sie hohe Kapitalinvestitionen und einen erheblichen Stromverbrauch.
2.6. Stabilisierte Chlordioxidprodukte
Verschiedene kommerzielle Anbieter bieten stabilisierte Chlordioxidprodukte an. Bei diesen Produkten handelt es sich ausschließlich um gepufferte Lösungen, die Chlorit- (oder Chlorationen) enthalten und zur Freisetzung von Chlordioxid aktiviert werden müssen.
Diese Produkte gibt es in zwei Formen:
- Wässrige Lösungen sind gepufferte Lösungen mit Chlorit oder Chlorat, die zur Freisetzung von Chlordioxid eine Säurezugabe erfordern.
- Feststoffe enthalten Chlorit oder Chlorat, eingearbeitet in feste Matrizen (Gele oder Absorptionsmittel), in denen Chlordioxid gebunden ist. Die Aktivierung erfolgt durch Erhitzen oder Auswaschen des Chlordioxids.
Stabilisierte Chlordioxidprodukte werden in verschiedenen kleinen Anwendungen (weniger als 5 kg/Tag) verwendet, wie z. B. Geruchskontrolle, Luftaufbereitung, Biozidanwendungen, Desinfektion, und Wasserreinigung.
3. Verwendung von Chlordioxid
Chlordioxid wird in verschiedenen Branchen eingesetzt, wobei die Zellstoffbleiche die dominierende Anwendung ist. Allerdings bleibt die Wirtschaftlichkeit aufgrund der Natur des Marketings und der Fachpressestatistiken oft unbemerkt.
Aufgrund seiner instabilen Natur kann ClO2 nicht gespeichert werden und muss am Ort der Verwendung erzeugt werden. Trotz dieser Einschränkung bleibt es die kommerziell wertvollste Chloroxid- oder Chlorsauerstoffsäure.
3.1. Verwendung beim Bleichen von Zellstoff
Über 90 % der weltweiten Kraftzellstoffproduktion (Hart- und Weichholz) verwendet Chlordioxid in Bleichsequenzen ohne elementares Chlor (ECF). Dies liegt daran, dass ClO2 Lignin selektiv oxidiert, was die Zellstoffausbeute steigert und die mechanischen Eigenschaften beibehält.
Während das Bleichpotenzial von Chlordioxid seit über 150 Jahren bekannt ist, fand seine breite Anwendung erst in den 1980er Jahren statt. Sichere und zuverlässige Großproduktionsprozesse, die in den 1940er Jahren aufkamen, trugen zu den modernen kontinuierlichen Prozessen bei, die heute verwendet werden.
Der Hauptgrund für die Einführung von ClO2 beim Bleichen von Zellstoff war die Milderung der Umweltauswirkungen chlorierter organischer Verbindungen, die beim Bleichen von elementarem Chlor entstehen. Seit Ende der 1980er Jahre hat ClO2 elementares Chlor weitgehend ersetzt.
Im Gegensatz zu elementarem Chlor (einem starken universellen Chlorierungsmittel) führt Chlordioxid beim Bleichen keine Chloratome in aromatische Ringe ein. Dadurch wird die Bildung giftiger, stark chlorierter organischer Stoffe wie Dioxine und polychlorierte Phenole verhindert.
Während einige adsorbierbare organische Halogenide (AOX) auch mit reinem ClO2 immer noch erzeugt werden, sind sie leichter biologisch abbaubar, was zu einem geringeren CO2-Ausstoß führt Umweltauswirkungen durch Abwässer der Zellstofffabrik.
Sowohl ECF- als auch TCF-Bleiche (Total Chlorine-Free) gelten bei Einhaltung bewährter Verfahren als umweltverträglich. Modernes Bleichen erfordert eine Kombination von Chemikalien und Verfahren, um Kosteneffizienz, hohe Zellstoffqualität und geringe Umweltbelastung zu erreichen.
Hochleistungsfabriken können das Bleichen mit 8–16 kg Chlordioxid pro Tonne Zellstoff erreichen.
3.2. Andere Anwendungen
Über die Zellstoffbleiche hinaus wird Chlordioxid auch in anderen Sektoren eingesetzt, oft in kleinerem Maßstab.
- Bleichen von Textilfasern: Ähnlich wie beim Bleichen von Zellstoff ermöglicht Chlordioxid das Bleichen von Naturfasern (Wolle, Baumwolle) mit spezifischen Eigenschaften.
- Wasseraufbereitung: Chlordioxid wird aufgrund seiner Wirksamkeit und Selektivität im Vergleich zu Alternativen wie elementarem Chlor in Tausenden von Trinkwasseraufbereitungsanlagen eingesetzt. Hypochlorit, Ozon und UV-Licht. Es bietet eine hervorragende Bakterien-, Geruchs- und Geschmackskontrolle und erzeugt keine Trihalomethane wie Chlor und Hypochlorit.
- Lebensmittelindustrie: ClO2 findet Anwendung bei der mikrobiellen Kontrolle in der Lebensmittelindustrie.
- Chlordioxid wird zur Abwasserdesinfektion und Schleimbekämpfung in Papiermaschinen eingesetzt.
- Chlordioxid wird auf Ölfeldern zur Entfernung von Biofilmen und zur Neutralisierung von Schwefelwasserstoff und Eisensulfid verwendet, die in Bohrlöchern einen Gegendruck verursachen können. Darüber hinaus wird es zur Geruchskontrolle in der Ölindustrie eingesetzt.
- Eine neue Anwendung von ClO2 ist die Reduzierung nitroser Gase aus Verbrennungsprozessen (Kohlekessel, Müllverbrennungsanlagen und Rückgewinnungskessel). Diese Anwendung bietet hohe Entfernungseffizienzen (über 90 %) für NOx und Quecksilber bei guter Wirtschaftlichkeit.
4. Toxikologie von Chlordioxid

Chlordioxid birgt besondere Gefahren für die menschliche Gesundheit und potenzielle Explosionen. In diesem Abschnitt werden die wichtigsten Sicherheitsaspekte beim Umgang mit ClO2 dargelegt.
Auswirkungen und Grenzen der Exposition
- Die Freisetzung von Chlordioxidgas oder -flüssigkeit ist aufgrund seines stechenden Geruchs, der dem von Chlor ähnelt, leicht erkennbar.
- Geringe Konzentrationen reizen die Atemwege und Augen.
- Höhere Konzentrationen können zu starkem Husten, Lungenödem (Flüssigkeitsansammlung in der Lunge) und sogar zum Tod führen.
- Es liegen keine menschlichen Daten zur Karzinogenität oder Genotoxizität von Chlordioxid vor.
- Die Grenzwerte für die berufsbedingte Exposition sind:
- Zeitgewichteter 8-Stunden-Durchschnitt (TWA): 0,1 ppm
- Short-Term Exposure Limit (STEL): 0,3 ppm
Sichere Handhabungspraktiken
- Handhabung und Lagerung in gut belüfteten Bereichen durchführen.
- Achten Sie auf kühle Lagertemperaturen und verwenden Sie nur minimale Lösungsmengen.
- Implementieren Sie Prozesssicherheitsmanagementpraktiken.
- Stellen Sie Schulungen und geeignete Sicherheitsausrüstung bereit (Atemschutz, Chemikalienschutzbrille, Handschuhe und Stiefel).
- Rüsten Sie ClO2-Anlagen und Anwendungspunkte mit Alarmen zur Gasleckerkennung aus, die auf 0,1 ppm (TWA-Grenzwert) eingestellt sind.
Explosionsgefahr
- Gasförmiges Chlordioxid ist bei Konzentrationen über 10 % in der Luft (10 kPa Partialdruck) explosiv.
- Die Zersetzung zu Chlor und Sauerstoff ist exotherm und erhöht das Gasvolumen, was zu einem Druckanstieg und einer möglichen Schockwelle führt.
- Zersetzung kann durch Metalloxidverunreinigungen, heiße Oberflächen, schnelle Säureverdünnung, Druckstöße, Hitze oder Sonnenlicht ausgelöst werden.
Referenzen
- Chlorine Oxides and Chlorine Oxygen Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_483.pub2
- Halogens; Descriptive Inorganic Chemistry. – https://www.sciencedirect.com/science/article/abs/pii/B9780128046975000178
- The Chemistry of Chlorine Dioxide. – https://onlinelibrary.wiley.com/doi/10.1002/9780470166161.ch3
