Benzol: Eigenschaften, Reaktionen und Verwendungen
Benzol (C6H6) ist eine farblose, brennbare Flüssigkeit mit süßem Geruch. Es handelt sich um eine einringige aromatische Verbindung, das heißt, ihre Kohlenstoffatome sind in einem Ring mit abwechselnden Einfach- und Doppelbindungen angeordnet. Benzol ist thermisch stabil und chemisch reaktiv, was es zu einem wertvollen Vorläufer vieler anderer Chemikalien macht.
Benzol wird hauptsächlich zur Herstellung von Styrol, Phenol und Cyclohexan verwendet, die bei der Herstellung von Kunststoffen, Harzen und anderen Produkten verwendet werden. Es wird auch als Lösungsmittel verwendet, seine Verwendung ist jedoch aufgrund seiner hohen Toxizität zurückgegangen. Benzol ist auch Bestandteil von Benzin und dient dort zur Erhöhung der Oktanzahl.
Benzol wurde erstmals 1825 von Michael Faraday isoliert und kommerzielle Produktionsverfahren wurden Mitte des 19. Jahrhunderts entwickelt. Benzol wird heute hauptsächlich aus Erdöl gewonnen.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Benzol
Die Kekulé-Struktur von Benzol, ein Ring aus sechs Kohlenstoffatomen mit abwechselnden Einfach- und Doppelbindungen, kann seine Eigenschaften nicht erklären. Benzol ist stabiler als erwartet, sein NMR-Spektrum ist ungewöhnlich und seine Bindungslängen liegen zwischen Einfach- und Doppelbindungen. Es ist außerdem reaktiver als einfache Kohlenwasserstoffe.
Diese Eigenschaften legen nahe, dass Benzol eine Hybridstruktur mit delokalisierten Elektronen aufweist.
Tabelle 1 gibt wichtige physikalische Eigenschaften für Benzol an:
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht | 78,11 g/mol |
| Geruch | Süß |
| Farbe | Farblos |
| Dichte bei 20 °C | 0,879 g/cm³ |
| Schmelzpunkt | 5,53 °C |
| Siedepunkt | 80,01 °C |
| Brechungsindex bei 20 °C | 1,501 |
| Kritische Dichte | 0,309 g/cm³ |
| Kritischer Druck | 48,9 bar |
| Kritische Temperatur | 288,9 °C |
| Flammpunkt | -11 °C |
| Zündtemperatur | 595 °C |
| Explosionsgrenzen in Luft (Vol.-%) | 1,4–6,7 |
| Viskosität bei 20 °C | 0,654 mPa·s |
| Löslichkeit in Wasser | Schwer löslich |
| Löslichkeit in organischen Lösungsmitteln | Mischbar mit den meisten organischen Lösungsmitteln |
2. Chemische Eigenschaften von Benzol
Benzol ist als Grundeinheit aromatischer Verbindungen eine wichtige Industriechemikalie mit einem breiten Anwendungsspektrum. Es ist thermisch stabil und unterliegt einer Vielzahl von Reaktionen, einschließlich Substitution, Addition und Dehydrierung, um eine Vielzahl nützlicher Produkte zu erzeugen.
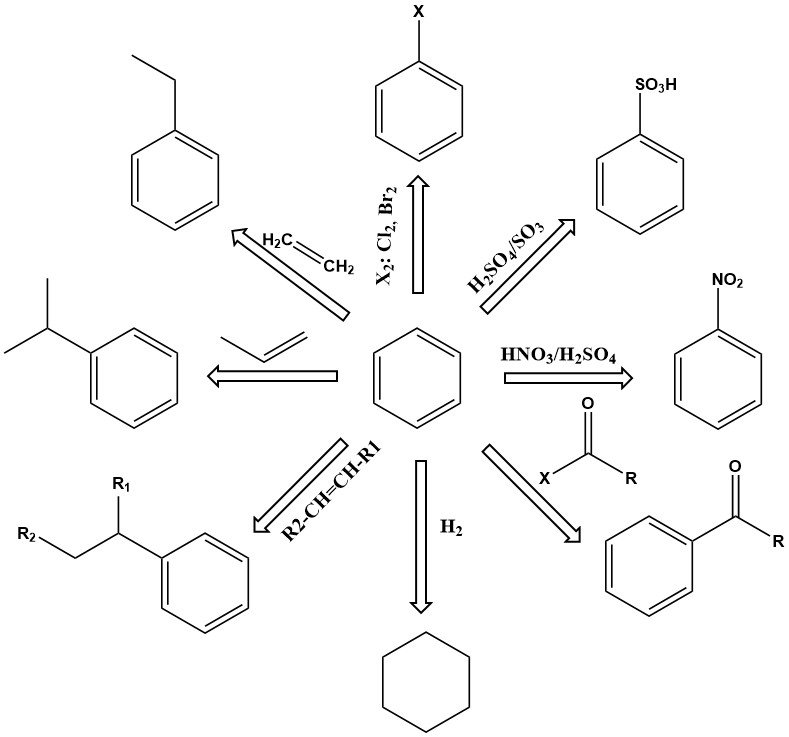
Von vorrangiger Bedeutung sind Substitutionsreaktionen von Benzol. Abhängig von den Reaktionsbedingungen können ein oder mehrere der Wasserstoffatome im Benzolring gegen Nitro, Sulfonsäure, Amin, Hydroxyl, Chlor, Brom oder andere Gruppen ausgetauscht werden. Zu den Produkten gehören Phenol, Nitrobenzol, Chlorbenzol, Benzolsulfonsäure und viele andere.
Weitere wichtige Reaktionen von Benzol sind Additionen wie Alkylierung und Hydrierung. Diese Reaktionen finden im Allgemeinen bei erhöhter Temperatur und erhöhtem Druck statt und erfordern manchmal aktive Katalysatoren.
Beispielsweise wird Ethylbenzol durch die Alkylierung von Benzol mit Ethylen in Gegenwart eines Aluminiumchloridkatalysators hergestellt.
Cumol ist ein weiteres wichtiges primäres Additionsprodukt von Benzol, das durch katalytische Dampfphasen-Alkylierung von Benzol mit Propen an Phosphorsäure- oder Kieselgur-Katalysatoren bei 200–250 °C und einem Überdruck von 2,7–4,2 MPa entsteht.
Auch die Hydrierung ist eine Additionsreaktion. Eine der wichtigsten ist die Hydrierung von Benzol zur Herstellung von Cyclohexan.
Die Dehydrierung von Ethylbenzol zu Styrol ist eine wichtige kommerzielle Reaktion. Diese endotherme Reaktion erfordert eine hohe Temperatur, um kinetisch und thermodynamisch abzulaufen.
Benzol ist ein wesentlicher Rohstoff für die Herstellung vieler anderer wichtiger Chemikalien, darunter Kunststoffe, Harze, Reinigungsmittel und Pharmazeutika. Die meisten der in diesem Kapitel besprochenen Reaktionen sind Primärreaktionen von Benzol. Unzählige Reaktionen und Produkte basieren entweder direkt oder indirekt auf Benzol als Quelle.
3. Rohstoffe für Benzol
Benzol und seine Homologen wie Toluol und Xylole kommen in Rohöl in geringen Mengen vor, was eine physikalische Trennung und Rückgewinnung unpraktisch macht. Rohölfraktionen aus Saudi-Arabien und dem Vereinigten Königreich haben niedrige Gehalte an Benzol, Toluol und Xylol (BTX), aber höhere Gehalte an Naphthen.
Schwerere Rohöle und synthetische Rohöle aus Teersanden können in der leichten Naphtha-Fraktion einen höheren Aromatengehalt aufweisen. Eine Analyse der C5-150 °C-Naphthafraktion aus einem konventionellen Rohöl und einem synthetischen Naphtha aus Athabasca-Teersanden zeigt, dass das synthetische Naphtha geringere Aromaten- und Naphthengehalte aufweist als die konventionelle Rohölfraktion.
Allerdings weist die höhere Naphthafraktion aus dem synthetischen Rohöl einen deutlich höheren Aromatengehalt auf (32 gegenüber 19 %), obwohl der Naphthengehalt geringer ist. Dies ist wahrscheinlich auf eine Dealkylierung oder Ringöffnung der höhermolekularen Aromaten im Bitumen zurückzuführen.
- Besuchen Sie den Link für einen ausführlichen Artikel über die Herstellung von Benzol →
4. Verwendung von Benzol
Benzol wird zur Herstellung von Ethylbenzol, Cumol und Cyclohexan verwendet, die 75–80 % des Verbrauchs als chemischer Rohstoff ausmachen.
Ethylbenzol wird zu Styrol dehydriert, dem Monomer für wichtige Polymere wie Acryl-Butadien-Styrol-Harze und Styrol-Butadien-Kautschuk.
Cumol wird zur Herstellung von Phenol und Aceton verwendet. Phenol wird hauptsächlich für Phenolharze verwendet.
Cyclohexan wird zur Herstellung von Adipinsäure verwendet, die zur Herstellung von Nylons verwendet wird.
Etwa 5 % des Benzols werden zu Nitrobenzol nitriert, das dann zu Anilin hydriert wird.
Benzol kann auch zu Maleinsäureanhydrid oxidiert werden, einem Vorläufer für Polyesterharze.
Weitere Benzolprodukte sind halogenierte Benzole und lineare Alkylbenzole, die zur Herstellung von Waschmitteln verwendet werden.
5. Toxikologie und Arbeitsmedizin von Benzol
Benzol ist eine giftige Verbindung, die akute und chronische Auswirkungen haben kann. Die Aufnahme erfolgt durch Einatmen, Verschlucken oder Hautabsorption. Eine akute Vergiftung kann zu Kopfschmerzen, Verwirrtheit, Verlust der Muskelkontrolle und Reizungen der Atemwege und des Magen-Darm-Trakts führen. Höhere Konzentrationen können zur Bewusstlosigkeit oder zum Tod führen. Chronische Exposition kann zu Anämie und Leukämie führen.
Das Einatmen ist die Hauptquelle einer Benzolvergiftung. Beim Verschlucken kann es zu Reizungen im Mund, der Speiseröhre und dem Magen kommen. Die Aufnahme über die Haut stellt keine nennenswerte Vergiftungsquelle dar.
Mehrere Studien haben die Toxizität von Benzol untersucht. Es wird selektiv von der Lunge aufgenommen und in verschiedenen Körpergeweben gespeichert. Benzol wird langsam verstoffwechselt und bildet toxische Zwischenprodukte. Die individuelle Anfälligkeit für Vergiftungen ist unterschiedlich.
Die Exposition gegenüber Benzol wurde mit Leukämie, Panzytopenie und aplastischer Anämie in Verbindung gebracht. Weitere Untersuchungen sind erforderlich, um den genauen Kausalzusammenhang zu ermitteln.
Benzolemissionen stammen aus Motorbenzin, Kohlekarbonisierung und in der Vergangenheit aus benzolhaltigen Lösungsmitteln.
Zur Vorbeugung einer Benzolvergiftung gehören gute Labor- und Anlagenpraktiken, die Minimierung der Konzentrationen in Arbeitsbereichen und die Anwendung von Schutzmaßnahmen.
Aufsichtsbehörden haben Expositionsgrenzwerte für Benzol festgelegt und es als potenziell krebserregenden Stoff eingestuft.
Aktuelle Vorschriften zielen darauf ab, die Emissionen flüchtiger organischer Verbindungen, einschließlich Benzol, aus Erdölraffinerien und Chemiefabriken zu reduzieren.
Laufende Studien und Regulierungsbemühungen spiegeln das aktive Engagement beim Verständnis und der Kontrolle der Toxizität von Benzol wider.
Um die mit der Benzolexposition verbundenen Risiken zu mindern, sind kontinuierliche Forschung und strenge Maßnahmen erforderlich.
Referenz
- Benzene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_475
