Benzalchlorid
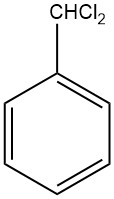
Benzalchlorid (C6H5CHCl2) ist eine farblose Flüssigkeit, die durch Chlorierung der Seitenkette von Toluol synthetisiert wird. Es ist auch als Dichlormethylbenzol, α,α-Dichlortoluol oder Benzylidenchlorid bekannt. Die erste Synthese von Benzalchlorid wurde 1848 von A. Cahours beschrieben, der Benzaldehyd mit Phosphorpentachlorid (PCl5) umsetzte.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Benzalchlorid
Benzalchlorid (C6H5CHCl2) ist eine farblose Flüssigkeit mit stechendem Geruch. Bei Kontakt mit feuchter Luft entwickelt es Dämpfe und kann zu starken Reizungen der Schleimhäute und Augen führen. Seine physikalischen Eigenschaften sind wie folgt:
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht | 161,03 g/mol |
| Schmelzpunkt | -16,2°C |
| Siedepunkt | 205,2°C |
| Dichte bei 20°C | 1,2536 g/cm³ |
| Dampfdruck bei 20°C | 0,6 kPa |
| Brechungsindex (n20D) | 1,5503 |
| Oberflächenspannung (σ) bei 20°C | 40,1 mN/m |
| Dynamische Viskosität (η) bei 20°C | 2,104 mPa·s |
| Spezifische Wärme bei 25°C | 222 J mol⁻¹ K⁻¹ |
| Verdampfungswärme bei 72°C | 50,4 kJ/mol |
| Eigenschaft | 0°C | 20°C | 30°C | 57°C | 79°C | 135°C |
|---|---|---|---|---|---|---|
| Dichte | 1,2691 | 1,2536 | 1,2417 | 1.2122 | 1.1877 | 1.1257 |
| Dampfdruck | 0,0 | 0,6 | 0,8 | 1.3 | 1,9 | 4.0 |
| Brechungsindex (n20D) | 1,5499 | 1,5503 | 1.5506 | 1,5513 | 1,5523 | 1,5542 |
| Oberflächenspannung (σ) | 40,4 | 40,1 | 39,8 | 38,9 | 38,2 | 36,4 |
| Dynamische Viskosität (η) | 2.12 | 2.104 | 2.089 | 2.058 | 2.023 | 1,948 |
Benzalchlorid kann mehrere azeotrope Gemische bilden, Beispiele sind in Tabelle 2 aufgeführt.
| Komponente | BP, °C | Benzalchlorid, Gew.-% |
|---|---|---|
| Isoamyllactat | 201 | 45 |
| n-Octanol | 195 | ca. 10 |
| Kampfer | 210 | 25 |
| Acetamid | 191 | 85 |
| Capronsäure | 199 | 64 |
Benzalchlorid ist in Ethanol, Diethylether, Chloroform und Tetrachlorkohlenstoff löslich, seine Löslichkeit in Wasser ist jedoch begrenzt (0,05 g/L bei 5 °C und 0,25 g/L bei 39 °C).
In ethanolischen und wässrigen Lösungen kann es zu Alkoholyse- oder Hydrolysereaktionen kommen.
Die Löslichkeit von Chlor in 100 g Benzalchlorid variiert mit der Temperatur und beträgt 6,2 g bei 30 °C, 4,3 g bei 50 °C und 1,5 g bei 100 °C.
2. Chemische Reaktionen von Benzalchlorid
Benzalchlorid kann durch Chlorierungsmittel in Benzotrichlorid umgewandelt werden.
In Gegenwart von Lewis-Säuren entstehen durch Chlorierung des aromatischen Rings Chlorbenzalchloride, bei denen es sich um isomere Verbindungen handelt.
Benzaldehyd entsteht, wenn Benzalchlorid unter sauren oder alkalischen Bedingungen hydrolysiert wird.
Benzalchlorid kann in Gegenwart von Verbindungen wie AlCl3 und FeCl3 polymerisiert werden.
Natriummetall kann Benzalchlorid in Stilben umwandeln.
3. Herstellung von Benzalchlorid
Benzalchlorid entsteht durch Chlorierung der Seitenkette von Toluol. Zur Herstellung von Benzylchlorid und Benzotrichlorid werden der gleiche Prozess und die gleiche Anlagenkonfiguration verwendet.
Um optimale Ausbeuten zu erzielen, muss jedoch das molare Chlor-Toluol-Verhältnis angepasst werden. Die hochsiedende Nebenproduktfraktion, die bei der Benzylchloridproduktion anfällt, besteht hauptsächlich aus Benzalchlorid und Benzylchlorid.
Diese Nebenproduktfraktion kann in der Synthese von Benzalchlorid recycelt werden. Daher sind die Produktion von Benzalchlorid und Benzylchlorid eng miteinander verflochten und werden häufig gleichzeitig in derselben Produktionsanlage durchgeführt.
4. Verwendung von Benzalchlorid
Benzalchlorid wird hauptsächlich zur Herstellung von Benzaldehyd und Zimtsäure verwendet. Es kann in Gegenwart von Wasser bei Temperaturen über 100 °C mit alkalischen oder sauren Mitteln hydrolysiert werden. Friedel-Crafts-Katalysatoren sind wirksame Katalysatoren für diese Reaktion.
Sie können auch für Mischungen verwendet werden, die sowohl Benzylchlorid als auch Benzalchlorid enthalten. In diesen Fällen soll das Benzylchlorid unverändert bleiben und nur Benzaldehyd entstehen.
Aufgrund der nahezu identischen Siedepunkte von Benzylchlorid und Benzaldehyd ist dieses Verfahren jedoch möglicherweise nicht kommerziell realisierbar. Die Trennung dieser beiden Verbindungen durch fraktionierte Destillation wäre unerschwinglich teuer.
5. Toxikologie von Benzalchlorid
Benzalchlorid ist eine farblose Flüssigkeit mit stechendem Geruch. Es gibt Dämpfe ab, wenn es feuchter Luft ausgesetzt wird, und kann Reizungen der Augen, der Haut und der Schleimhäute verursachen.
Die verfügbaren Daten zur Toxizität von Benzalchlorid deuten darauf hin, dass es weniger toxisch ist als Benzylchlorid. Die akute orale Toxizität (LD50) von Benzalchlorid bei Ratten und Mäusen beträgt 3250 mg/kg bzw. 2460 mg/kg.
Auch die Inhalationstoxizität von Benzalchlorid ist geringer als die von Benzylchlorid, mit einer LC50 (2-stündige Exposition) von 400 mg/m³ bei Ratten und 210 mg/m³ bei Mäusen.
Benzalchlorid ist bekanntermaßen mutagen und wurde mit der Entwicklung von Hauttumoren und Lungenadenomen bei Mäusen in Verbindung gebracht. Es liegen jedoch keine gesonderten Studien zur krebserzeugenden Wirkung von Benzalchlorid beim Menschen vor.
Daher wird es von der Internationalen Agentur für Krebsforschung (IARC) als Karzinogen der Gruppe 2B (Nachweis der Suffizienz bei Tieren, unzureichende Daten beim Menschen) und von der Deutschen Forschungsgemeinschaft (DFG) als Karzinogen der Kategorie 2 eingestuft.
Referenz
- Benzyl Chloride and Other Side-Chain-Chlorinated Aromatic Hydrocarbons; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.o04_o01.pub2
