Acetamid: Eigenschaften, Herstellung und Anwendungen

Was ist Acetamid?
Acetamid, auch bekannt als Ethanamid oder Essigsäureamid, ist eine organische Verbindung mit der chemischen Formel C2H5NO. Es ist ein weißer, geruchloser, hygroskopischer Feststoff aus Essigsäure und Ammoniak. Acetamid kommt in der Natur in den Wurzeln von Zuckerrüben und in Abraumhalden von Kohlebergwerken als Nebenprodukt des Abbaus organischer Stoffe vor.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Acetamid
Reines Acetamid schmeckt bitter und ist geruchlos. Ein charakteristischer, mausartiger Geruch wird auf Spuren von Verunreinigungen, möglicherweise von Acetonitril, zurückgeführt. Acetamid kommt in zwei kristallinen Formen vor: einer stabilen trigonalen Form und einer metastabilen orthorhombischen Modifikation. Es ist sehr gut löslich in Wasser, Ethanol, Chloroform, Glycerin und heißem Benzol sowie schwer löslich in Diethylether.
Tabelle 1 listet die wichtigsten physikalischen Eigenschaften von Acetamid auf.
| Eigenschaft | Wert |
|---|---|
| CAS-Registrierungsnummer | 60-35-5 |
| Molekularformel | C2H5NO |
| Molmasse | 59,07 g·mol−1 |
| Schmelzpunkt | 81–82 °C |
| Schmelzpunkt (trigonal) | 80,0–80,1 °C |
| Tripelpunkt | 353,33 K |
| Siedepunkt (1 atm) | ≈221 °C |
| Dichte (20 °C) | ≈1,16 g/cm3 |
| Schmelzdichte bei 85 °C | 0,9986 g·mL−1 |
| Schmelzwärme (ΔHm) | 264 kJ·kg−1 |
| Dielektrizitätskonstante | 59 |
| Dipolmoment | 12,41 × 10−30 C·m |
| Dampfdruck bei 272 K | 10 kPa |
| Dampfdruck bei 278 K | 20 kPa |
| Dampfdruck bei 281 K | 30 kPa |
| Dampfdruck bei 284 K | 40 kPa |
| Dampfdruck bei 285 K | 50 kPa |
| Dampfdruck bei 287 K | 60 kPa |
| Dampfdruck bei 288 K | 70 kPa |
| Dampfdruck bei 290 K | 80 kPa |
| Dampfdruck bei 291 K | 90 kPa |
| Dampfdruck bei 292 K | 100 kPa |
2. Chemische Eigenschaften von Acetamid
Acetamid ist ein einfaches aliphatisches Amid und weist charakteristische Eigenschaften der Amidgruppe auf.
Acetamid zeigt in Wasser gelöst amphoteres Verhalten. Die Hydrolyse in neutralem Wasser erfolgt nur langsam, reagiert jedoch in Gegenwart starker Säuren oder Basen sofort zu Essigsäure und Ammoniak.
Die Autodissoziationskonstante von Acetamid beträgt etwa 3,2 × 10-11 bei 94 °C, was auf eine geringe Tendenz zur Selbstionisation unter thermischen Bedingungen hindeutet.
Acetamid reagiert mit Mineralsäuren zu festen Komplexen. Salze von Bromwasserstoff, Chlorwasserstoff und Salpetersäure mit Acetamid wurden isoliert und charakterisiert.
Die geschmolzene Phase von Acetamid wird zum Lösen von Metallsalzen verwendet, deren Leitfähigkeit, Stabilität und Eignung für die galvanische Abscheidung geprüft wurden.
3. Herstellung von Acetamid
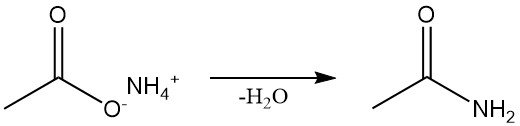
Acetamid wird auf verschiedenen Synthesewegen gewonnen. Die industrielle Herstellung erfolgt durch kontinuierliche Dehydratation von Ammoniumacetat, was auch die Standardmethode im Labor ist.
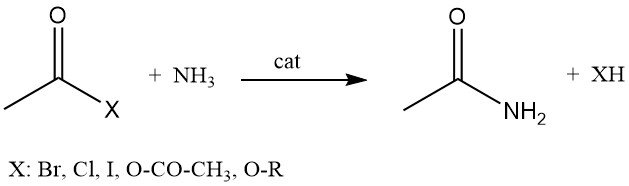
Acetamid kann auch durch die Reaktion von Acetylhalogeniden, Essigsäureanhydrid oder Alkylacetaten mit Ammoniak hergestellt werden.
Eine alternative Methode zur Herstellung von Acetamid ist die Hydratisierung von Acetonitril in Gegenwart von Säure- oder Basenkatalysatoren. Dieses Verfahren ist weit verbreitet, da Acetonitril als Nebenprodukt bei der Herstellung von Acrylnitril entsteht.
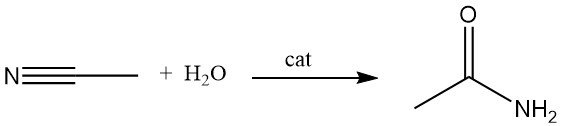
Die kupferkatalysierte Hydratisierung von Acetonitril kann Umwandlungseffizienzen von bis zu 83 % erreichen. Bestimmte Mikroorganismen können diese Reaktion auch bei Raumtemperatur katalysieren.
4. Verwendung von Acetamid
Acetamid wird als Lösungsmittel und Weichmacher verwendet. Es hat ein breites Anwendungsspektrum in verschiedenen Branchen.
Acetamid hemmt die Säurebildung in Druckfarben, Lacken, Sprengstoffen und Parfümen. Es wird als mildes Feuchtigkeitsmittel und als Weichmacher für Leder, Textilien, Papier und bestimmte Kunststoffe verwendet.
Acetamid wird auch als Zwischenprodukt bei der Synthese von Pharmazeutika, Pestiziden und Kunststoff-Antioxidantien eingesetzt. Derivate von Acetamid, darunter substituierte Acetamid-haltige Thioharnstoffe, wurden auf ihre antivirale Wirkung gegen Herpesviren untersucht.
Acetamid wird als Weichmacher und Stabilisator in der Polymerproduktion eingesetzt. Es wurde als Kryoprotektivum sowie als Bestandteil von Schmiermitteln und Feuerschutzmitteln untersucht.
Bestimmte Acetamidderivate werden in landwirtschaftlichen Studien zur Modifizierung des Fressverhaltens eingesetzt.
In der Laborforschung wird Acetamid häufig als Modellverbindung zur Untersuchung der Struktur- und Wasserstoffbrückeneigenschaften von Amiden verwendet.
5. Toxikologie von Acetamid
Acetamid wurde als Quelle für nicht-proteinhaltigen Stickstoff bei Wiederkäuern wie Schafen und Milchkühen eingesetzt. Futtermengen von etwa 2–3 % scheinen ungiftig zu sein. Die Pufferung des Futters mit zweibasigen Säuren ermöglicht eine höhere Aufnahme durch die Abfangung des bei der Verdauung freigesetzten Ammoniaks.
Die Internationale Agentur für Krebsforschung (IARC) stuft Acetamid als mögliches menschliches Karzinogen (Gruppe 2B) ein.
Chronische orale Exposition bei Ratten zeigte Leberkarzinogenität: Die einjährige Verabreichung von 2,36 % Acetamid im Futter führte zu Leberkrebs. Weitere Studien zeigten hepatotoxische und hämatopoetische Effekte.
Der genaue Mechanismus der Acetamid-Toxizität ist noch unklar. Sein Toxizitätsprofil unterscheidet sich von dem von Dimethylacetamid und scheint mit der Bildung von Hydroxylamin aus seinem primären Metaboliten Acetohydroxamsäure zusammenzuhängen.
Acetamid zeigt keine Entwicklungstoxizität. Reproduktionsstudien an Nagetieren ergaben keine Hinweise auf eine veränderte Spermatogenese, hormonelle Veränderungen oder Schäden an den akzessorischen Geschlechtsorganen.
Bei Mäusen führte die orale Gabe von Acetamid zu gutartigen und bösartigen Lebertumoren. Männliche Mäuse zeigten zudem eine erhöhte Inzidenz maligner Lymphome. Insgesamt stützen diese Ergebnisse die Einstufung von Acetamid als Leberkarzinogen bei Nagetieren mit möglichem karzinogenem Potenzial beim Menschen.
Referenzen
1. Wagner, F.S., Jr. (2002). Acetamide. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.0103052023010714.a02.pub2
2. Le Berre, C., Serp, P., Kalck, P. and Torrence, G.P. (2014). Acetic Acid. In Ullmann’s Encyclopedia of Industrial Chemistry, (Ed.). https://doi.org/10.1002/14356007.a01_045.pub3
3. Mohammadi, S.; Foroumadi, A. Acetamide. In *Encyclopedia of Toxicology*, 4th ed.; Wexler, P., Ed.; Academic Press, 2024; pp 39–42. DOI: 10.1016/B978-0-12-824315-2.01089-7
