1-Propanol: Eigenschaften, Reaktionen, Herstellung und Verwendung
Was ist 1-Propanol?
1-Propanol, auch n-Propylalkohol oder Propan-1-ol genannt, ist ein primärer Alkohol mit der chemischen Formel CH3CH2CH2OH. Es ist eine klare, farblose Flüssigkeit mit charakteristischem alkoholischem Geruch und mischbar mit Wasser, Ethanol und Ether.
1-Propanol ist ein Strukturisomer von Isopropylalkohol, letzterer hat jedoch aufgrund seiner weit verbreiteten Verwendung als Lösungs- und Desinfektionsmittel eine größere industrielle Bedeutung.
In der Natur kommt 1-Propanol in Fuselölen vor und entsteht als Nebenprodukt der Fermentation und beim Verderben oder Zersetzen pflanzlicher Stoffe.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von 1-Propanol
1-Propanol ist eine klare, farblose Flüssigkeit mit charakteristischem alkoholischem Geruch. Es ist vollständig mit Wasser mischbar und in vielen organischen Lösungsmitteln, darunter Ethern, Estern, Säuren, Ketonen und anderen Alkoholen, gut löslich.
Die physikalischen Eigenschaften von n-Propanol sind in Tabelle 1 zusammengefasst.
| Eigenschaft | Wert |
|---|---|
| CAS-Registrierungsnummer | 71-23-8 |
| Chemische Formel | C3H8O |
| Molmasse, g/mol | 60,09 |
| Gefrierpunkt, °C | −126,2 |
| Siedepunkt, °C | 97,20 |
| Dampfdruck, kPa | bei 20 °C: 1,987 bei 40 °C: 6,986 bei 60 °C: 20,292 bei 80 °C: 50,756 |
| Antoine-Gleichung (2–120 °C, t in °C) | log P(kPa) = 6,97257 − 1499,21 / (204,64 − t) |
| Dampfdichte (Luft = 1) | 2,07 |
| Dichte bei 20 °C, g/cm3 | 0,80375 |
| Francis-Gleichung (−21 bis 180 °C, t in °C) | Dichte = 0,8813 + (5,448 × 10-4 t) − 21,536 / (313,09 − t) |
| Brechungsindex, nD20 | 1,38556 |
| Viskosität bei 20 °C, mPa·s | 2,256 |
| Oberflächenspannung bei 20 °C, mN/m | 23,75 |
| Kritische Temperatur, °C | 263,65 |
| Kritischer Druck, kPa | 5169,60 |
| Kritische Dichte, g/cm3 | 0,275 |
| Wärmekapazität (Flüssigkeit, 25 °C), J/(mol·K) | 141 |
| Verdampfungswärme, kJ/mol | bei 25 °C: 47,53 bei 97,20 °C: 41,78 |
| Verbrennungswärme (Flüssigkeit, 25 °C), kJ/mol | 2033 |
| Bildungswärme (Dampf, 25 °C), kJ/mol | −254,7 |
| Flammpunkt (Tag offener Tiegel), °C | 28,9 |
| Zündungstemperatur, °C | 371,1 |
| Explosionsgrenzen in Luft, Vol.-% | Untere: 2,2 Obere: 14,0 |
| Elektrische Leitfähigkeit bei 25 °C, S | 2 × 10-8 |
2. Chemische Reaktionen von 1-Propanol
Die Chemie von 1-Propanol ist typisch für niedermolekulare primäre Alkohole. Es unterliegt einer Vielzahl von Reaktionen, die für die Hydroxylgruppe charakteristisch sind, darunter Oxidation, Veresterung, Aminierung, Dehydratation und Veretherung. In biologischen Systemen wird 1-Propanol leicht abgebaut und gilt als einer der am leichtesten biologisch abbaubaren Alkohole.
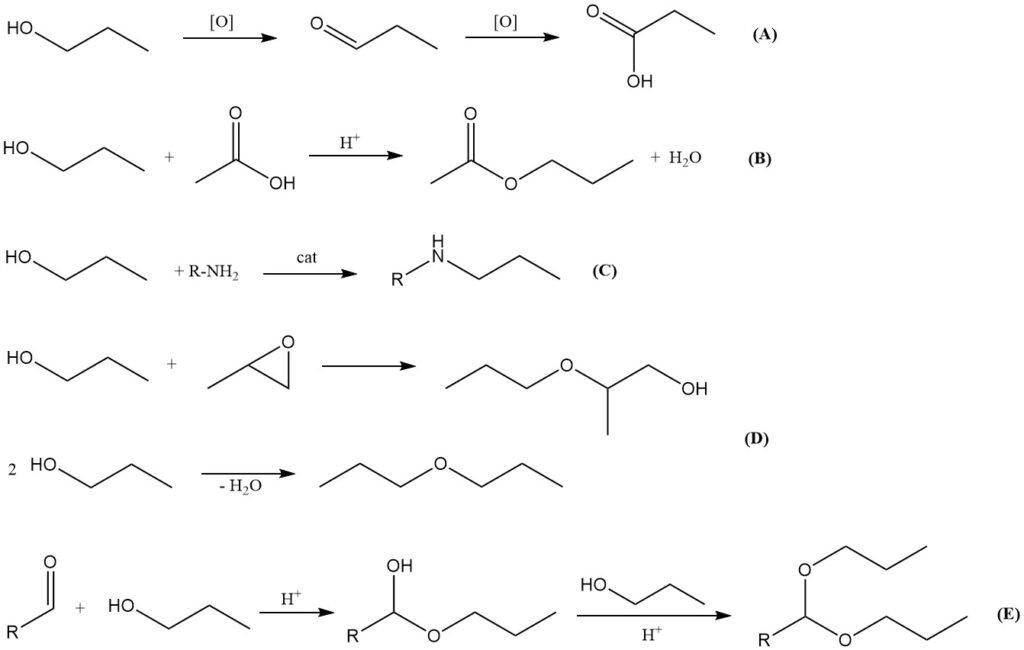
Oxidation (A)
Die Oxidation von 1-Propanol verläuft zunächst zum entsprechenden Aldehyd Propanal und anschließend zu Propionsäure. Eine partielle Oxidation kann mit Luft in Gegenwart von Metallkatalysatoren wie Kupferchromit, Chrom(VI)-oxiden oder Pyridiniumsalzen erreicht werden.
Veresterung (B)
Wie andere Alkohole reagiert 1-Propanol mit organischen und anorganischen Säuren zu Estern. Die Reaktion mit Essigsäure in Gegenwart von starken Säurekatalysatoren (z. B. Schwefelsäure, p-Toluolsulfonsäure, Methansulfonsäure oder Ionenaustauscherharzen) ergibt n-Propylacetat, ein wichtiges Lösungsmittel für Beschichtungen, Tinten und die Duftstoffindustrie.
Die Umesterung mit Methyl- oder Ethylacetat kann ebenfalls zur Herstellung von n-Propylacetat genutzt werden.
Aminierung (C)
1-Propanol kann mit Ammoniak oder Aminen bei erhöhter Temperatur und erhöhtem Druck in Gegenwart von Übergangsmetallkatalysatoren wie Nickel, Kobalt oder Molybdän reduktiv aminiert werden. Dabei entstehen Propylaminderivate, die jedoch im Vergleich zu den entsprechenden Isopropylaminderivaten von geringerer industrieller Bedeutung sind.
Veretherung und Dehydratisierung (D)
Die Reaktion von 1-Propanol mit Alkylenoxiden (z. B. Ethylenoxid, Propylenoxid) führt zu Glykolethern, die häufig als Lösungsmittel eingesetzt werden. Durch Dehydratisierung von 1-Propanol kann mithilfe fester Säurekatalysatoren Di-n-propylether erzeugt werden. Die Dehydratisierung zu Propen ist ebenfalls möglich, hat aber keine praktische industrielle Bedeutung.
Acetalbildung (E)
Wie andere primäre Alkohole reagiert 1-Propanol mit Aldehyden zu Halbacetalen, die in Gegenwart saurer Katalysatoren unter dehydratisierenden Bedingungen weiter zu Acetalen umgesetzt werden können. Aus 1-Propanol gewonnene Acetale dienen als Zwischenprodukte in der pharmazeutischen Synthese.
3. Industrielle Herstellung von 1-Propanol
1-Propanol wird industriell hauptsächlich durch die Hydroformylierung (Oxo-Verfahren) von Ethylen zu Propanal (Propionaldehyd) und anschließende katalytische Hydrierung zum Alkohol hergestellt.
Einst wurde ein Dampfphasenoxidationsverfahren von Propan von Celanese in Bishop, Texas, eingesetzt, das jedoch 1973 eingestellt wurde. Seitdem ist die OXO-Technologie in den USA und Europa die vorherrschende Methode.
In Südafrika produziert Sasol 1-Propanol durch Fischer-Tropsch-Synthese. Versuche zur Herstellung von 1-Propanol durch Anti-Markownikow-Hydratation von Propylen wurden untersucht, haben jedoch keine kommerzielle Anwendung gefunden.
3.1. Herstellung von 1-Propanol durch Hydroformylierung und Hydrierung
Die kommerzielle Herstellung von 1-Propanol durch Hydroformylierung (Oxo-Verfahren) erfolgt in zwei Schritten. Ethylen wird zunächst durch Hydroformylierung mit Synthesegas zu Propanal umgewandelt (1), anschließend erfolgt die katalytische Hydrierung von Propanal zu 1-Propanol (2).
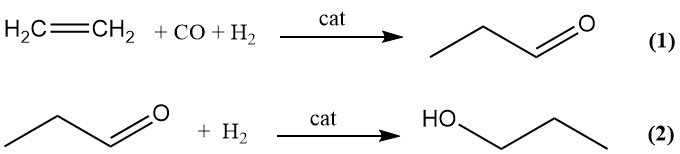
Zu den Nebenprodukten der Hydroformylierung zählen Propan, 1-Propanol und durch Aldolkondensation gebildete Nachläufer. Übergangsmetall-Carbonylkomplexe von Kobalt, Eisen, Nickel, Rhodium und Iridium können die Oxo-Reaktion katalysieren, kommerziell werden jedoch nur Kobalt und Rhodium eingesetzt.
In den USA wird 1-Propanol mittels Oxo-Technologie bei Texas Eastman, Union Carbide und Hoechst Celanese hergestellt. Texas Eastman arbeitete ursprünglich mit kobaltbasierten HCo(CO)4-Katalysatoren und führte 1989 ein phosphinmodifiziertes Rhodiumsystem ein. In Europa wird die Produktion von der Hoechst AG und der BASF AG durchgeführt.
Der Rhodium-Triphenylphosphin-Katalysator hat Kobaltkatalysatoren aufgrund höherer Reaktionsgeschwindigkeiten, verbesserter Stabilität, geringerer Betriebsdrücke und weniger Nebenprodukte weitgehend ersetzt. Rhodiumcarbonyle eignen sich für Anlagen, die ursprünglich für Kobaltkatalysatoren ausgelegt waren.
Obwohl Rhodium höhere Drücke benötigt, ist seine Aktivität höher und es entstehen weniger hochsiedende Fraktionen. Bei der Hoechst AG in Deutschland (Werk Ruhrchemie) werden Rhodiumcarbonyle zur Synthese von Propanal eingesetzt, das anschließend zu 1-Propanol hydriert wird. Rhodiumcarbonyle sind 100- bis 1000-mal reaktiver als Kobaltanaloga.
Die Ethylenhydroformylierung mit Rhodiumkatalysatoren erfolgt bei 90–120 °C, 2,17–3,55 MPa, H2:CO-Verhältnissen von 1:1–3:1, Rhodiumkonzentrationen von 1–10 mM und Triphenylphosphinkonzentrationen von 0,1–0,4 M. Unter diesen Bedingungen erreicht die Propanalausbeute 98–99 %, bei einer Umwandlung von 0,5–1,0 % in Ethan und Nachlauf.
Die Katalysatoraktivität wird durch halogenhaltige Rhodiumquellen unterdrückt, da halogenierte Komplexe eine schlechte Hydroformylierungsleistung aufweisen. Die aktivste Katalysatorvorstufe ist Hydridocarbonyltris(triphenylphosphin)rhodium, HRhCO_[P(C6H5)3]3, das durch Dissoziation eines Triphenylphosphinliganden aktive Spezies erzeugt.
Überschüssiges Triphenylphosphin unterdrückt die Katalysatordesaktivierung durch Phenylwanderung vom Phosphor zum Rhodium, die andernfalls zur Bildung inaktiver Rhodiumphosphidcluster führt.
Die Hydrierung von Propanal zu 1-Propanol ist ein etabliertes Verfahren. Häufig werden nickelbasierte Katalysatoren wie Raney-Nickel oder geträgertes Nickel sowie Kupfer-Chromoxid-Katalysatoren verwendet. Sowohl Dampfphasen- als auch Flüssigphasenhydrierungsverfahren kommen zum Einsatz.
Der Flüssigphasenbetrieb erfolgt bei 2,17–4,24 MPa und 100–170 °C. Die Dampfphasenhydrierung erfolgt typischerweise unter 790 kPa. Es kommen Festbett-, Suspensions- oder Rieselbettreaktoren zum Einsatz. Es werden Ausbeuten an 1-Propanol von über 95 % erreicht.
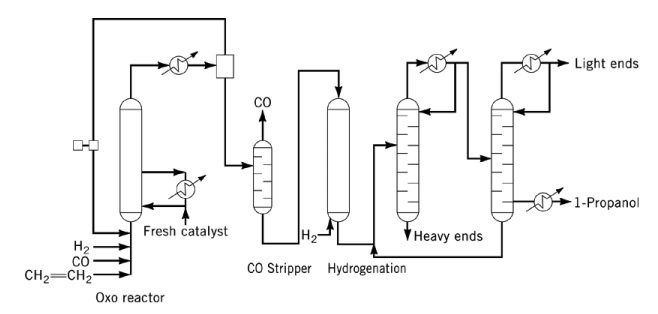
Zu den Nebenprodukten zählen Acetale, Ether, Ester und Diole. Sowohl CO als auch Triphenylphosphin wirken als Katalysatorgifte und müssen vor der Hydrierung aus dem Einsatzmaterial entfernt werden.
Im industriellen Betrieb wird Propanoldampf mit überschüssigem Synthesegas aus dem Oxoreaktor-Ablauf gestrippt, anschließend kondensiert und CO vor der Hydrierung entfernt. Das resultierende Roh-1-Propanol wird in einem Zweisäulen-Destillationssystem gereinigt.
Bei Verwendung von Kobaltcarbonyl- oder Rhodiumcarbonylkatalysatoren ist aufgrund höherer Reaktordrücke eine Flüssigentnahme des Propanals erforderlich, und es sind zusätzliche Vorkehrungen für die Katalysatorrückgewinnung und -handhabung erforderlich.
3.2. Herstellung von 1-Propanol nach dem Sasol-Fischer-Tropsch-Verfahren
Sasol produziert 1-Propanol als Nebenprodukt der Fischer-Tropsch-Synthese. Bei diesem Verfahren wird Kohle in Lurgi-Festbettreaktoren vergast, um Synthesegas (CO und H2) zu erzeugen. Der Gasstrom wird von kondensierbaren Bestandteilen getrennt, gereinigt und in die Sasol Synthol-Anlage eingeleitet.
In Wirbelschichtreaktoren wird das Gas mit einem fein verteilten Eisenkatalysator in Kontakt gebracht, wobei die stark exotherme Fischer-Tropsch-Reaktion ein Gemisch aus Kohlenwasserstoffen und sauerstoffhaltigen Verbindungen erzeugt.
Die Kondensate aus den Reaktoren trennen sich in eine Kohlenwasserstofffraktion und eine wässrige Phase. Der wässrige Strom enthält ein Gemisch aus Alkoholen und Ketonen. Die meisten Alkohole werden zu hochoktanigem Benzin gemischt, während ausgewählte Alkoholfraktionen zur Gewinnung reiner Produkte destilliert werden.
Aus diesen Prozessen werden 1-Propanol und Ethanol in einem mehrstufigen Trennsystem mit einer Gesamtjahreskapazität von ca. 25.000–30.000 t isoliert.
4. Verwendung von 1-Propanol
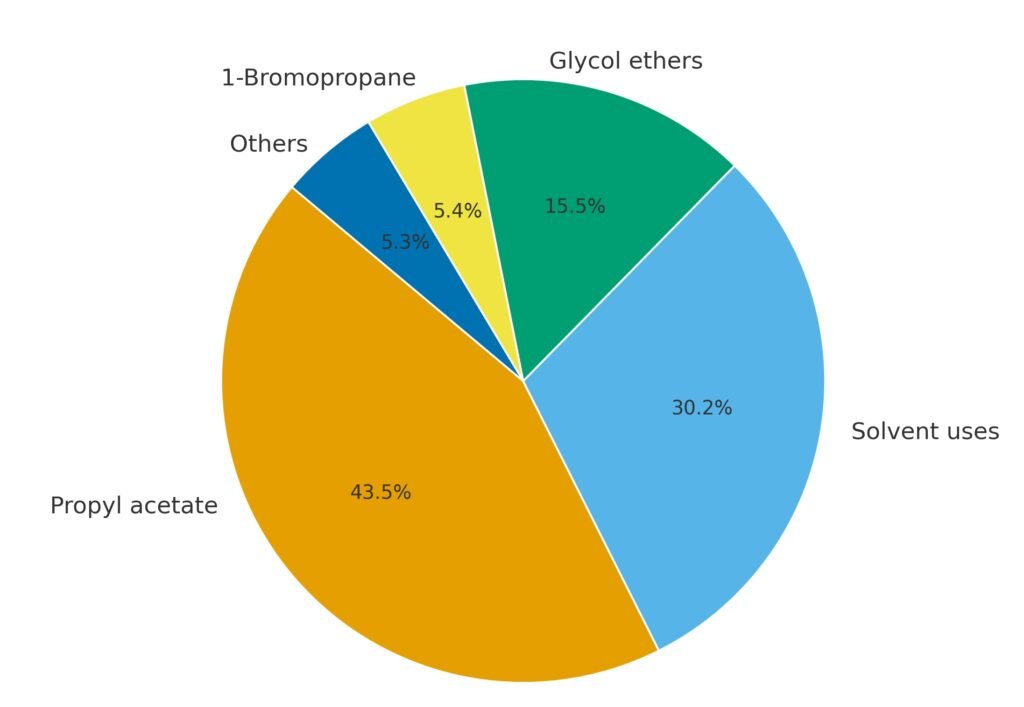
1-Propanol wird hauptsächlich als Lösungsmittel und chemisches Zwischenprodukt verwendet. Das wichtigste Derivat ist n-Propylacetat, das den größten Anteil am weltweiten Verbrauch ausmacht.
1-Propanol wird häufig als Lösungsmittel in Flexo- und Tiefdruckfarben verwendet, insbesondere für den Druck auf Polyolefin- und Polyamidfolien. Im Vergleich zu Ethanol und 2-Propanol bietet es Vorteile hinsichtlich Druckqualität und Trocknungsverhalten. Es wird auch als Lösungsmittel in Farben, Beschichtungen, Kosmetika, Pestiziden und Insektiziden eingesetzt.
In Europa gewinnt 1-Propanol aufgrund seiner hohen bioziden Wirkung gegen Bakterien, Pilze und Viren zunehmend an Bedeutung als Bestandteil von Hand- und Oberflächendesinfektionsmitteln.
Ein Großteil des 1-Propanols wird zu n-Propylacetat umgewandelt, das als Lösungsmittel in Farben, Lacken, Cellulosederivaten, Wachsen und Insektizidformulierungen verwendet wird. Andere Ester, wie n-Propylpropionat, werden in Beschichtungen verwendet und gelten aufgrund ihrer verbesserten Geruchseigenschaften als Ersatz für n-Butylacetat.
1-Propanol ist ein Ausgangsstoff für die Herstellung von Glykolethern wie Ethylenglykolmonopropylether, Diethylenglykolmonopropylether, Propylenglykolmonopropylether und Dipropylenglykolmonopropylether. Diese Lösungsmittel vereinen hohe Lösekraft mit Wasserverträglichkeit und werden in Beschichtungen und Reinigungsmitteln eingesetzt.
In Europa wird ein erheblicher Teil von 1-Propanol zu Propylaminen umgewandelt, die als Zwischenprodukte bei der Herstellung von Herbiziden und Pharmazeutika dienen.
1-Propanol ist eine Vorstufe von 1-Brompropan, einem Lösungsmittel, das als Ersatz für Methylenchlorid und ozonschädigende Verbindungen verwendet wird. Zu den kleineren Anwendungen zählen die Verwendung als Geschmacks- und Duftstoff, als Cosolvens in Pestizidformulierungen und als Futtermittelzusatz.
5. Toxikologie von 1-Propanol
1-Propanol ist als entzündbare Flüssigkeit mit einem Flammpunkt unter 38 °C eingestuft. Es wird von der Arbeitsschutzbehörde (OSHA) gemäß 29 CFR 1910.1200 als Gefahrstoff eingestuft.
Toxizitätsstudien zeigen, dass 1-Propanol für Tiere nur leicht toxisch ist (Tabelle 2). Es liefert negative Ergebnisse im Ames-Test und im Mouse Lymphoma Forward Mutation Assay und weist somit kein mutagenes Potenzial auf.
| Verabreichungsmethode / Parameter | Wert |
|---|---|
| Orale Dosis, Ratten, LD50 | 1,9 g/kg |
| Dermal, Kaninchen, LD50 | 5,4 g/kg |
| Inhalation, Ratten, LC50 | 24.000 ppm |
| ACGIH TLV, TWA | 200 ppm |
| Gefahreneinstufungen (NFPA: Gesundheit, Entzündbarkeit, Reaktivität) | 1, 3, 0 |
| Gefahreneinstufungen (HMIS: Gesundheit, Entzündbarkeit, Reaktivität) | 2, 3, 0 |
| Hinweise: LD50 = mittlere letale Dosis. LC50 = mittlere letale Konzentration. TLV = Schwellenwert, TWA = zeitgewichteter Durchschnitt. | |
Das Nationale Toxikologieprogramm (NTP) und die Internationale Agentur für Krebsforschung (IARC) stufen 1-Propanol nicht als krebserregend ein. Akute Exposition kann Augenreizungen oder Verbrennungen verursachen, während wiederholter Hautkontakt zu Dermatitis führen kann. Das Einatmen übermäßiger Dampfkonzentrationen kann Augen und Atemwege reizen, und sehr hohe Konzentrationen können narkotische Wirkungen haben.
In den Vereinigten Staaten ist 1-Propanol im Comprehensive Environmental Response, Compensation, and Liability Act (CERCLA) mit einer meldepflichtigen Freisetzungsmenge von 45,4 kg pro Tag aufgeführt.
Es ist außerdem in den Luftemissionsnormen gemäß 40 CFR 60.489 aufgeführt, die eine Kontrolle der Emissionen flüchtiger organischer Verbindungen aus Produktionsanlagen vorschreiben. Mehrere US-Bundesstaaten führen 1-Propanol im Rahmen der Informationspflichten.
In den Lebensmittel- und Pestizidvorschriften ist 1-Propanol gemäß 21 CFR 172.515 als Aromastoff und Adjuvans zugelassen und unterliegt bei Verwendung als Lösungsmittel oder Co-Lösungsmittel in Pestizidformulierungen nicht den Toleranzanforderungen.
Referenzen
1. Unruh, J.D. and Pearson, D. (2000). n-Propyl Alcohol. In Kirk-Othmer Encyclopedia of Chemical Technology, (Ed.). https://doi.org/10.1002/0471238961.1618151621141821.a01
2. Klabunde, J., Bischoff, C. and Papa, A.J. (2025). Propanols. In Ullmann’s Encyclopedia of Industrial Chemistry. https://doi.org/10.1002/14356007.a22_173.pub3
