Salicylsäure: Eigenschaften, Herstellung, Verwendung und Derivate
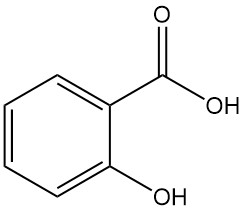
Salicylsäure, auch bekannt als 2-Hydroxybenzoesäure oder o-Hydroxybenzoesäure, ist eine aromatische Verbindung mit der Formel C7H6O3. Es ist ein farbloser, geruchloser, kristalliner Feststoff, der natürlicherweise in vielen Pflanzen vorkommt, hauptsächlich als Ester.
Hinweise auf seine medizinische Verwendung reichen bis ins antike Griechenland zurück. Vor etwa 2400 Jahren verordnete Hippokrates Abkochungen aus Weidenrinde zur Behandlung von Fieber und Schmerzen. Diese therapeutische Wirkung ist auf Salicylsäure, den Wirkstoff der Weidenrinde, zurückzuführen.
Die Biosynthese von Salicylsäure in Pflanzen erfolgt durch Desaminierung von Phenylalanin zu Trans-Zimtsäure, die am Beta-Kohlenstoff weiter hydrolysiert und oxidiert wird, um Salicylsäure zu ergeben.
Salicylatester kommen in verschiedenen Pflanzengattungen reichlich vor, darunter Salix (Weide), Spiraea (Mädesüß) und Gaultheria (Wintergrün). Beispielsweise kommt Methylsalicylat, ein Derivat der Salicylsäure, in hohen Konzentrationen als Glucosid in Birkenrinde, bestimmten Spiraea-Arten und wintergrünen Blättern vor.
Salicylsäure wurde erstmals 1838 von R. Piria isoliert, indem er Salicylaldehyd (aus Mädesüß gewonnen) mit Kaliumhydroxid behandelte. Sechs Jahre später gewann C. Cahours, ein französischer Chemiker, Salicylsäure durch Hydrolyse von Methylsalicylat.
Die Herstellung von Salicylsäure gelang 1874 dem deutschen Chemiker H. Kolbe durch Carboxylierung von Natriumphenolat, ein Verfahren, das auch heute noch angewendet wird.
Salicylsäure und ihre Derivate sind in verschiedenen Branchen wichtig. Sie dienen vor allem als Vorstufen für die Synthese von Pharmazeutika, Farbstoffen, Agrochemikalien und Parfümerieprodukten.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Salicylsäure
Salicylsäure ist eine aromatische o-Hydroxycarbonsäure, die intramolekulare Wasserstoffbrückenbindungen aufweist. Dies erhöht im Gegensatz zu seinen Meta- und Para-Isomeren seine Dampfflüchtigkeit und Sublimationstendenz. Darüber hinaus ist der Säuregehalt von Salicylsäure im Vergleich zu 3-Hydroxybenzoesäure (Meta-Isomer) und 4-Hydroxybenzoesäure (Para-Isomer) deutlich höher.
Die wichtigen physikalischen Eigenschaften von Salicylsäure sind in Tabelle 1 aufgeführt.
| Eigenschaft | Wert |
|---|---|
| CAS-Nummer | 69-72-7 |
| Formel | C7H6O3 |
| Molmasse | 138,12 g/mol |
| Kristallstruktur | Farblose Nadeln (Wasser) oder monokline Prismen (Ethanol) |
| Schmelzpunkt | 159 °C |
| Sublimation | Beginnt bei 76 °C |
| Flammpunkt (geschlossener Tiegel) | 157 °C |
| Sublimationswärme | 81,8 kJ/mol |
| Dichte | 1,443 |
| Dissoziationskonstanten | K₁ = 1,05 × 10-3 K₂ = 4,0 × 10-14 (19 °C) |
| Dampfdruck | 1,66 mbar (110 °C) 19,3 mbar (150 °C) |
| Löslichkeit | |
| Lösungsmittel | Löslichkeit |
| Methanol | 38,46 g/100 g (21 °C) |
| Ethanol | 34,87 g/100 g (21 °C) |
| Chloroform | 1,55 g/100 g (30 °C) |
| Benzol | 1,00 g/100 g (30 °C) |
| Diethylether | 23,4 g/100 ml (17 °C) |
| Aceton | 31,3 g/100 ml (23 °C) |
| Ammoniak | Extrem löslich |
| Flüssiges Schwefeldioxid | Unlöslich |
Die Löslichkeit von Salicylsäure in Wasser hängt von der Temperatur ab, wie in Tabelle 2 gezeigt.
| Temperatur (°C) | Löslichkeit (g/L) |
|---|---|
| 0 | 0,8 |
| 10 | 1.2 |
| 20 | 1,8 |
| 40 | 3.7 |
| 60 | 8.2 |
| 80 | 20,5 |
2. Chemische Reaktionen von Salicylsäure
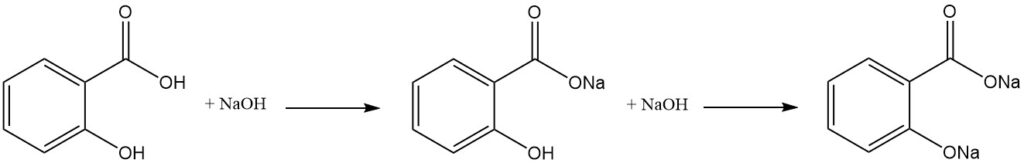
Salicylsäure ist ein difunktionelles Molekül, das sowohl für Phenole als auch für aromatische Carbonsäuren charakteristische Eigenschaften aufweist. Aufgrund des unterschiedlichen Säuregehalts zwischen den Hydroxyl- und Carboxylgruppen neutralisiert ein Äquivalent einer starken Base selektiv die Carboxylgruppe.
Die Bildung des Dialkalisalzes erfordert einen Überschuss an Base, während die anschließende Einwirkung von Kohlendioxid zur Neubildung der freien Hydroxylgruppe führt.
Durch Chelatbildung mit bestimmten Metallionen wie Fe(III) entstehen violett gefärbte Komplexe. Diese Eigenschaft ermöglicht die Verwendung von Salicylsäure als Indikator bei EDTA-Titrationen für Fe(III).
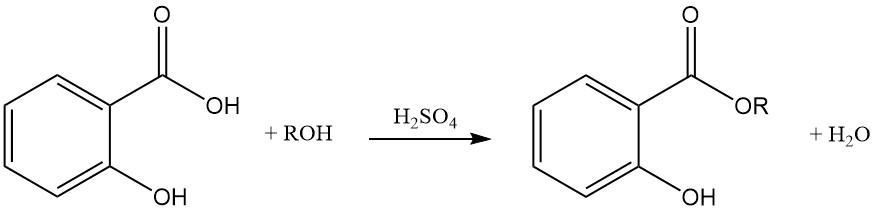
Bei der Reaktion von Salicylsäure mit Alkoholen unter Verwendung starker Säuren als Katalysator entstehen Ester mit minimaler Etherbildung als Nebenprodukt. Die Veresterung kann auch mit Acylhalogeniden oder Säureanhydriden erreicht werden.
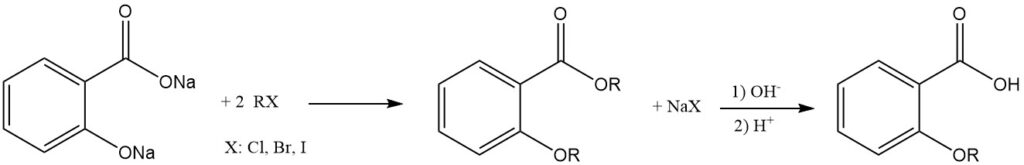
Dialkalisalicylat reagiert mit Alkylhalogeniden zu kombinierten Etherestern. Die Behandlung dieser Produkte mit einer Base hydrolysiert sie zu den entsprechenden Alkoxybenzoesäuren.
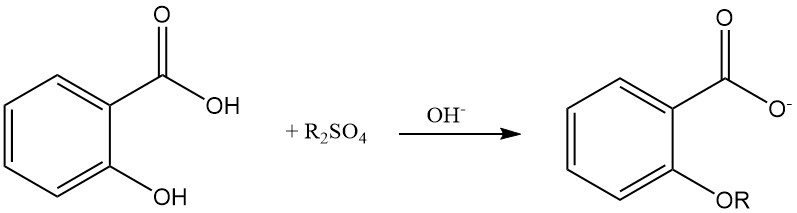
Die Veretherung der phenolischen Hydroxylgruppe der Salicylsäure ist mit Dialkylsulfat in einer alkalischen wässrigen Lösung möglich.
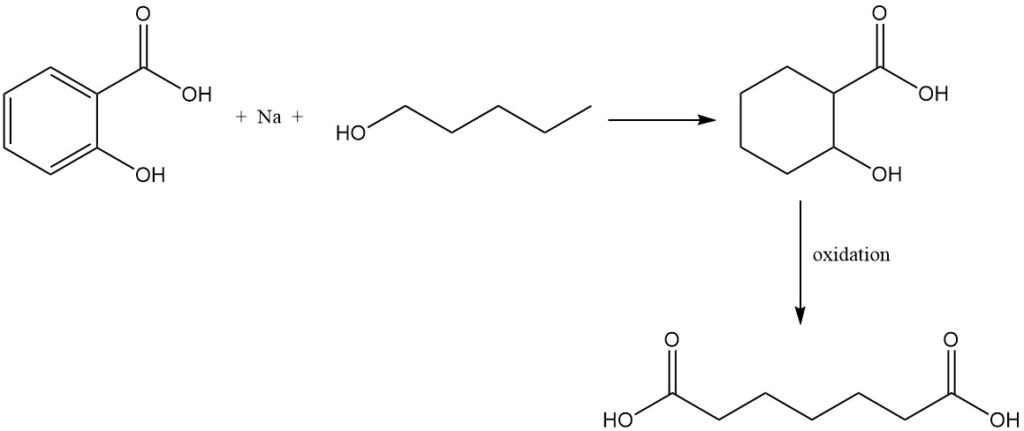
Durch die Reduktion von Salicylsäure mit Natrium und Amylalkohol entsteht Tetrahydrosalicylsäure, die bei Oxidation Pimelinsäure ergibt.
Durch die katalytische Hydrierung von Salicylsäureestern mit Raney-Nickel entstehen Ester der cis-trans-2-Hydroxycyclohexancarbonsäure.
Elektrophile Substitutionsreaktionen begünstigen die weniger gehinderte 5-Position des aromatischen Rings. Diese Regioselektivität ermöglicht die direkte Synthese von entweder 5-substituierten oder 3,5-disubstituierten Salicylsäurederivaten.
Beispiele für die elektrophile Substitution von Salicylsäure umfassen Nitrierung, Sulfonierung, Halogenierung, Alkylierung, Acylierung und Kupplung mit Diazoniumsalzen, die typischerweise 5-substituierte Produkte erzeugt.
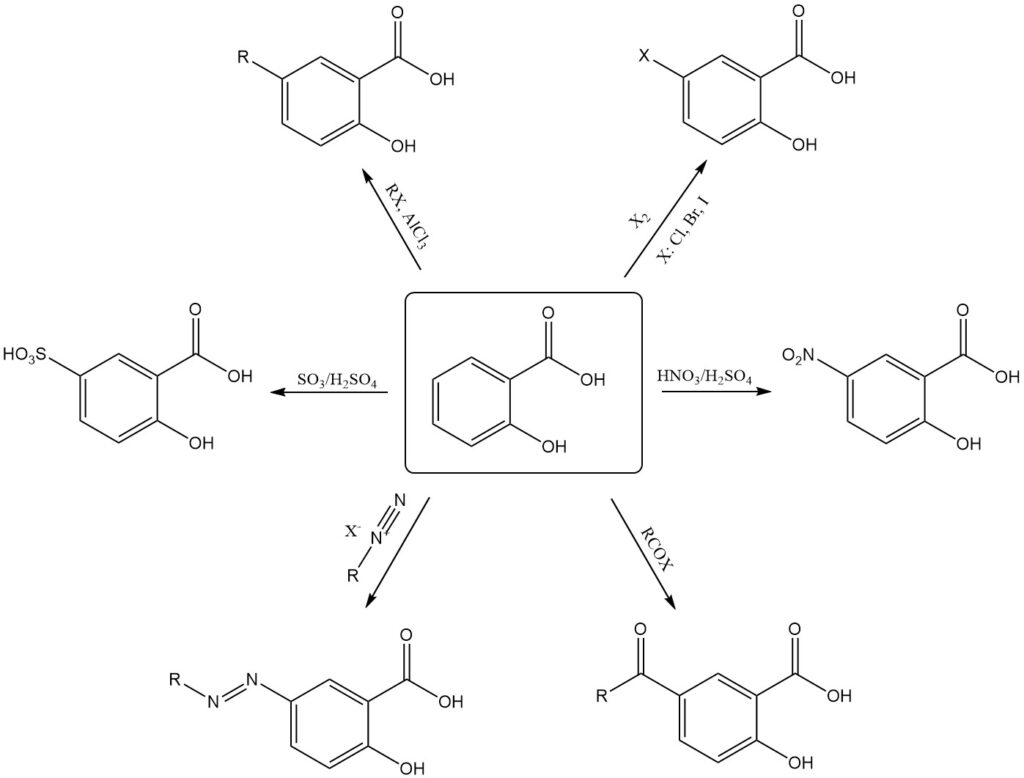
Substituierte Salicylderivate an der 3-Position erfordern indirekte Methoden wie die Substitution von Sulfosalicylsäure an der 5-Position, gefolgt von der Eliminierung der Sulfonsäuregruppe. Härtere Reaktionsbedingungen können jedoch zu einer Decarboxylierung führen.
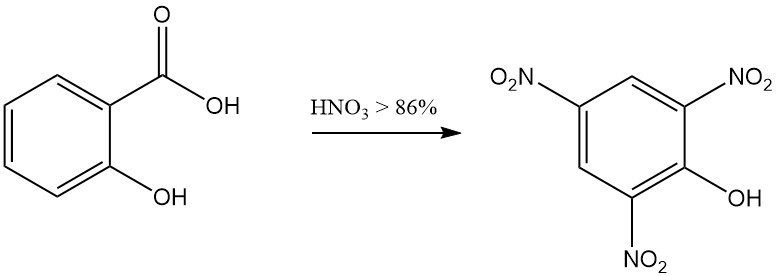
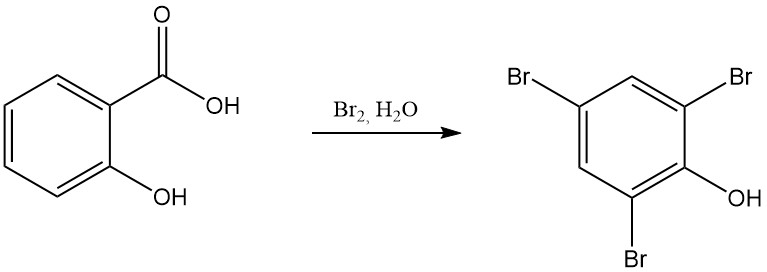
Beispielsweise führt die Reaktion von Salicylsäure mit rauchender Salpetersäure zur Bildung von 2,4,6-Trinitrophenol (Pikrinsäure) und die Reaktion mit Brom in Gegenwart von Wasser ergibt Tribromphenol.
Die thermische Zersetzung von Salicylsäure bei oder über ihrem Schmelzpunkt ergibt Phenol und Kohlendioxid. Unter einer Kohlendioxidatmosphäre bei 230 °C entsteht als Hauptprodukt Phenylsalicylat. Bei höheren Temperaturen (250 °C) entsteht neben Phenol auch Xanthon.
3. Herstellung von Salicylsäure
3.1. Herstellung von Salicylsäure durch Kolbe-Schmitt-Synthese
Salicylsäure wird kommerziell über die Kolbe-Schmitt-Reaktion hergestellt. Bei diesem Verfahren wird trockenes Natriumphenolat mit Kohlendioxid unter Druck (5 bar) und bei Temperaturen zwischen 150 und 160 °C umgesetzt.
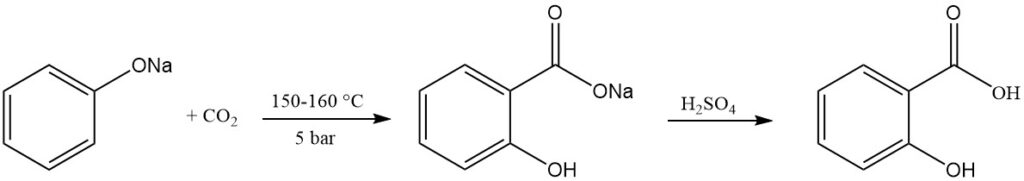
Im Jahr 1884 stellte Schmitt fest, dass die Anwendung von Druck die Ausbeute auf etwa 90 % verbesserte, verglichen mit der ursprünglichen Reaktion von Kolbe aus dem Jahr 1874, die bei Normaldruck nur etwa 50 % Ausbeute lieferte. Ohne Druck bilden sich Dinatriumsalicylat und Phenol in gleichen Mengen.
Der genaue Mechanismus der Kolbe-Schmitt-Reaktion bleibt ein Diskussionsthema. In der Literatur wurden viele Vorschläge gemacht, wie zum Beispiel:
- 4-Hydroxyisophthalsäure kann als Zwischenprodukt fungieren und CO2 freisetzen oder eine Carboxylierung von Phenolat unter Bildung von Salicylsäure eingehen.
- Komplexbildung zwischen Phenol, CO2 und einem Alkalimetall könnte die elektrophile Substitution am Phenoxid erleichtern.
Die Temperatur, die Art des verwendeten Alkalimetalls und der CO2-Druck haben alle einen erheblichen Einfluss auf die Reaktivität und Selektivität des Phenoxidanions.
Eine vereinfachte Übersicht über die industrielle Salicylsäuresynthese ist in Abbildung 1 dargestellt.
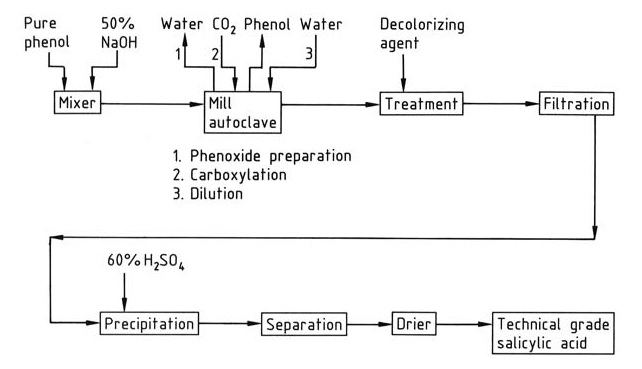
Die Carboxylierung erfolgt in Autoklaven, die mit Rührern oder Mahlgeräten ausgestattet sind. Um eine optimale Ausbeute zu gewährleisten, muss die Reaktionsmischung fein gemahlen und unbedingt wasserfrei sein. Wasser verringert den Ertrag, indem es Phenoxid in Phenol umwandelt und die Bildung von Carbonat fördert.
Zur Herstellung von Natriumphenoxid wird ein leichter molarer Überschuss (1–2 %) Natriumhydroxid verwendet. Größere Mengen Natronlauge führen zur Wasserbildung. Das wasserfreie Natriumphenoxid wird durch Verdampfen einer wässrigen Natriumphenoxidlösung im Autoklavenmischer selbst, durch Anlegen eines Vakuums nach Erreichen des Normaldrucks oder durch Verwendung spezieller Trocknungsgeräte hergestellt.
Das bei der Reaktion verwendete Kohlendioxid muss einen minimalen Sauerstoffgehalt (<0,1 %) haben, um Verfärbungen und Teerbildung zu verhindern.
Die exotherme Carboxylierungsreaktion wandelt Natriumphenoxid in Salicylsäure um. Das resultierende rohe Natriumsalicylat wird in Wasser gelöst, mit einem Entfärbungsmittel (z. B. Aktivkohle, Aluminium- oder Zinkpulver) behandelt und dann mit Schwefelsäure ausgefällt.
Nicht umgesetztes Phenol wird aus der rohen Natriumsalicylatmischung durch Destillation zurückgewonnen.
Alternativ verwendet das kontinuierliche Verfahren eine Lösung von wasserfreiem Phenoxid in einem geeigneten Lösungsmittel, beispielsweise Phenol selbst, höheren Alkoholen, Dialkylketonen oder Nitrobenzol.
3.2. Herstellung von Salicylsäure durch andere Verfahren
Andere alternative Methoden zur Herstellung von Salicylsäure wurden untersucht:
- Luftoxidation von o-Kresolat bei 230 °C mit einem Katalysator auf Kupferbasis oder Kupferbenzoat bei 175–215 °C.
- Durch direktes Erhitzen von alkalischem Kupferbenzoat kann Salicylat entstehen.
- Die Hydrolyse von 2-Benzoyloxybenzoesäure, einem Zwischenprodukt im Dow-Verfahren zur Phenolproduktion, führt zur Bildung von Salicylsäure.
- Durch die Fermentation polyzyklischer aromatischer Verbindungen wie Naphthalin durch bestimmte Mikroorganismen kann Salicylsäure entstehen.
4. Verwendung von Salicylsäure
Salicylsäure wird hauptsächlich als Vorstufe für Acetylsalicylsäure (Aspirin) verwendet, das weltweit am häufigsten abgegebene Arzneimittel. Darüber hinaus sind Salicylsäureester, -amide und -salze Ausgangsstoffe für andere pharmazeutische Produkte.
Salicylsäure technischer Qualität wird als Zwischenprodukt bei der Herstellung von Agrochemikalien, Farbstoffen, Gummiprodukten und Phenolharzen verwendet.
Salicylsäure selbst besitzt therapeutische Wirkungen bei der Behandlung rheumatischer Erkrankungen. Zu diesem Zweck wird es typischerweise in der gut löslichen Natriumsalzform verabreicht.
Aufgrund ihrer keratolytischen Eigenschaften (Fähigkeit, Keratin abzubauen) wird Salicylsäure in verschiedenen Hautpflegeprodukten zur Reinigung und Entfernung von Schuppen eingesetzt.
Salicylsäure ist ein Bakterizid, das in einigen Desinfektions- oder Konservierungsmitteln verwendet wird. Die Verwendung in Lebensmitteln ist jedoch verboten.
In jüngster Zeit wird es als Regulator des Pflanzenwachstums und der Blüte sowie gegen verschiedene abiotische und biotische Stressfaktoren eingesetzt.
Acetylsalicylsäure macht etwa 55 % des gesamten Salicylsäuremarktes aus, gefolgt von Estern und Salzen (18 %), Harzen (10 %) sowie Farbstoffen und Farbstoffen (10 %).
Die Einführung neuer Analgetika, die direkt mit Aspirin konkurrieren, hat Auswirkungen auf den Salicylsäuremarkt und zu einem Rückgang des Aspirinkonsums geführt. Allerdings könnte die potenzielle Entdeckung neuer Anwendungen für Salicylsäure den Markt in Zukunft stabilisieren.
5. Salicylsäure-Derivate
Salicylsäure bildet bei Reaktion mit Metallcarbonaten leicht Salze. Um Verfärbungen vorzubeugen, wird empfohlen, wässrige Salzlösungen leicht sauer zu halten. Salze werden als Feststoffe durch Aufkonzentrieren ihrer Lösungen gewonnen.
5.1. Natriumsalicylat
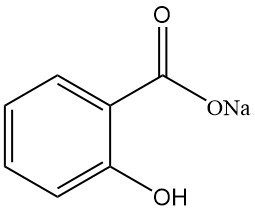
- Formel: NaC7H5O3
- CAS-Nummer: 54-21-7
- Molmasse: 160,11 g/mol
- Aussehen: Weiße, geruchlose, glänzende kristalline Flocken
- Löslichkeit:
- Wasser: 125 g/100 ml (25 °C)
- Ethanol: 17 g/100 ml (15 °C)
Natriumsalicylat in technischer Qualität wird durch Verdampfen einer Natriumsalicylatlösung hergestellt, und Natriumsalicylat in pharmazeutischer Qualität wird durch Doppelkristallisation von Natriumsalicylathexahydrat aus einer 45 %igen wässrigen Lösung bei 10 °C hergestellt.
Es wird als Analgetikum, Antipyretikum und Antineuralgikum eingesetzt.
Es gibt zahlreiche andere Salicylatsalze, darunter die von Ammonium, Magnesium, Calcium und Aluminium sowie Morpholinsalicylat. Viele dieser Salze sind unter verschiedenen Handelsnamen erhältlich.
5.2. Methylsalicylat
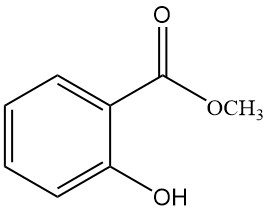
- Formel: C8H8O3
- CAS-Nummer: 119-36-8
- Molmasse: 152,15 g/mol
- Aussehen: Farblose, ölige Flüssigkeit mit charakteristischem Geruch
- Schmelzpunkt: -9 °C
- Siedepunkt: 222 °C
- Dichte: 1,184 g/ml
Methylsalicylat wird durch Erhitzen einer Mischung aus Salicylsäure und Methanol mit Schwefelsäure hergestellt.
Es wird zur Behandlung von Neuralgien und Rheuma, zur Anregung der kapillaren Durchblutung, als Insektizid, Sonnenschutzmittel, als Duftstoff und synthetisches Zwischenprodukt eingesetzt.
5.3. Benzylsalicylat
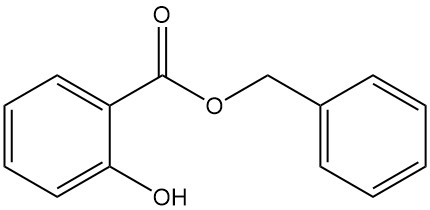
- Formel: C14H12O3
- CAS-Nummer: 118-58-1
- Molmasse: 228,25 g/mol
- Aussehen: Klare Flüssigkeit oder farblose bis undurchsichtige kristalline Masse mit charakteristischem Geruch
- Schmelzpunkt: 24 °C
- Siedepunkt: 318 °C
- Dichte: 1,180 g/ml (bei 15 °C)
Benzylsalicylat wird durch die Reaktion zwischen Natriumsalicylat und Benzylchlorid oder durch die Umesterung von Methylsalicylat mit Benzylalkohol hergestellt.
Es kommt in Ylang-Ylang- und Nelkenölen vor und wird als Zusatz in Seifen, Waschmitteln und Parfüms verwendet.
5.4. Isoamylsalicylat
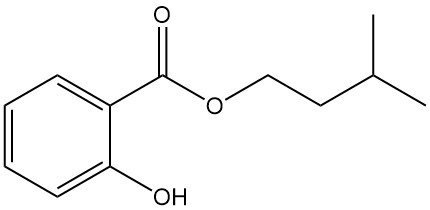
- Formel: C12H16O3
- CAS-Nummer: 87-20-7
- Molmasse: 208,26 g/mol
- Aussehen: Farblose Flüssigkeit mit dem Duft von Orchideen
- Siedepunkt: 270 °C
- Dichte: 1,050 g/ml (bei 20 °C)
Isoamylsalicylat wird als Duftstabilisator in der Parfümerie und als topisches Antirheumatikum verwendet.
5.5. Phenylsalicylat
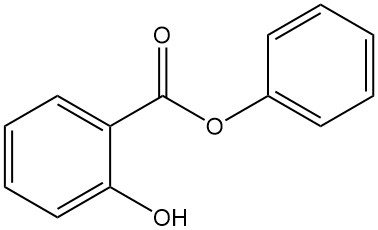
- Formel: C13H10O3
- CAS-Nummer: 118-55-8
- Molmasse: 241,22 g/mol
- Aussehen: Farbloses, kristallines Pulver
- Schmelzpunkt: 43 °C
- Siedepunkt: 172 °C (bei 16 mbar)
Phenylsalicylat wird durch die Reaktion zwischen Salicylsäure und Phenol mit Schwefelsäure oder durch Umesterung von Methylsalicylat mit Natriumphenoxid hergestellt.
Es wird als Antiseptikum, Konservierungsmittel, in Sonnenschutzmitteln, als allgemeines Lichtschutzmittel für synthetische Produkte und als Weichmacher verwendet.
5.6. Acetylsalicylsäure (Aspirin)
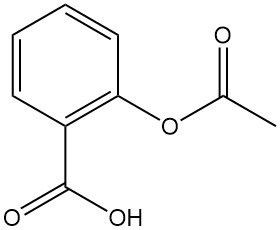
Acetylsalicylsäure, auch weithin unter dem Markennamen Aspirin bekannt, ist ein wichtiges Derivat der Salicylsäure. Hier ist eine Aufschlüsselung seiner Eigenschaften und Anwendungen:
Physikalische Eigenschaften:
- Formel: C9H8O4
- Molmasse: 180,15 g/mol
- Aussehen: Farblose Nadeln oder kristallines Pulver (je nach Kristallisationslösungsmittel)
- Schmelzpunkt: 143–144 °C
- Löslichkeit: Gering in Wasser (0,25 g/100 ml bei 15 °C), aber besser löslich in Ethanol (20 g/100 ml bei 25 °C)
- Dissoziationskonstante (K): 2,8 x 10-4 (bei 25 °C)
Acetylsalicylsäure wird durch Reaktion von Essigsäureanhydrid mit Salicylsäure bei Temperaturen unter 90 °C synthetisiert. Dabei können verschiedene Lösungsmittel und Katalysatoren (Säuren oder tertiäre Amine) eingesetzt werden.
Acetylsalicylsäure ist ein bekanntes fiebersenkendes (fiebersenkendes), schmerzstillendes, entzündungshemmendes und antirheumatisches Mittel. Es besitzt auch antithrombotische und gerinnungshemmende Eigenschaften, die die Bildung von Blutgerinnseln reduzieren.
6. Toxikologie von Salicylsäure
Salicylsäure und ihre Derivate werden leicht über die Haut und Schleimhäute aufgenommen. Esterformen der Salicylsäure werden im Körper durch die Wirkung von Enzymen, sogenannten Esterasen, hydrolysiert.
Der Eliminationsweg für Salicylsäure hängt vom pH-Wert des Urins ab:
- Saurer Urin: Salicylsäure wird zu Gentisinsäure oxidiert.
- Alkalischer Urin: Salicylsäure wird von den Nieren als Salicyluretinsäure oder Glucuronidsalicylat ausgeschieden.
Da die Absorption schneller erfolgen kann als die Ausscheidung, kann es unter bestimmten Bedingungen zu einer Ansammlung von Salicylsäure im Körper kommen.
Biologische Auswirkungen
Salicylsäure hat eine keratolytische Aktivität, d. h. sie fördert die Ablösung der äußersten Hautschicht. Es kann auch das Hautgewebe reizen, insbesondere im Magen, wo es die schleimproduzierenden Zellen beeinträchtigt. Die langfristige Einnahme von Salicylaten kann die Blutgerinnung verlangsamen, indem sie die Blutplättchenaggregation verringert.
Salicylsäure und ihre Derivate hemmen die Prostaglandinsynthese und tragen so zu ihren entzündungshemmenden Eigenschaften bei. Diese Verbindungen weisen analgetische und fiebersenkende Wirkungen auf.
Salicylsäure und ihre Derivate können als Fungizide und bakteriostatische Mittel wirken.
Haut- und Lungenüberempfindlichkeitsreaktionen auf Salicylate sind bekannt, wenn auch nicht immer echte Allergien. Möglicherweise ist eine verminderte Prostaglandinsynthese beteiligt. Es wurde eine Kreuzsensibilisierung zwischen verschiedenen Salicylatformen wie Methylsalicylat und Aspirin beobachtet.
Toxizität
Einzeldosen von mehr als 10 Gramm Salicylsäure können tödlich sein. Die Hauptsorge besteht in einer Störung des Säure-Basen-Gleichgewichts des Körpers. Zu den Symptomen gehören Delirium, Zittern, Atemprobleme, Schwitzen, Dehydration, Fieber und Koma.
Eine weniger schwere Vergiftung äußert sich in Hyperventilation, Ohrensausen, Übelkeit, Erbrechen, Seh- oder Hörproblemen, Schwindel und Störungen des Nervensystems.
Chronischer Konsum kann zu Verdauungsproblemen, Magen- und Darmschmerzen und manchmal zu schweren, versteckten Blutungen führen. Es kann auch eine Salicylat-induzierte Anämie auftreten, die auf einen Eisenmangel aufgrund versteckter Blutungen zurückzuführen ist. Bei älteren Patienten kann sich eine chronische Vergiftung in Verwirrung und Unruhe äußern.
Trotz möglicher Gewebeschäden wurde die chronische Verabreichung von reiner Salicylsäure nicht mit Leber- oder Nierenproblemen in Verbindung gebracht.
Tierstudien deuten darauf hin, dass hohe Dosen von Salicylsäure und ihren Derivaten ein Risiko für Geburtsfehler darstellen können. Beim Menschen konnte dies jedoch nicht bestätigt werden und man geht davon aus, dass geeignete Hygiene- und Arbeitsbedingungen diese Bedenken verringern.
Referenzen
- Salicylic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a23_477
- Analgesics (N02); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/9783527306732.a02_269.pub4
- Salicylic Acid: A Regulator of Plant Growth and Development
- Salicylic Acid. – https://www.sciencedirect.com/science/article/abs/pii/B9780080552323625759
