Diméthylamine
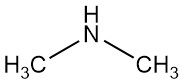
La diméthylamine est un composé organique de formule (CH3)2NH. C’est un gaz incolore et inflammable avec une odeur semblable à celle de l’ammoniac, bien qu’à de faibles concentrations, il puisse sentir le poisson et son odeur est plus puissante que celle du méthylamine et moins que la triméthylamine. La diméthylamine est couramment rencontrée dans le commerce sous forme de solution dans l’eau à des concentrations allant jusqu’à environ 40 %.
Table des matières
1. Propriétés physiques de la diméthylamine
La diméthylamine est un gaz ou un liquide comprimé nocif et incolore, hautement inflammable et dégageant de très fortes odeurs de poisson ou d’ammoniac. Il est soluble dans l’eau et est vendu sous forme de solutions aqueuses ou sous forme pure.
Lors du refroidissement des solutions aqueuses de diméthylamine, l’hydrate cristallin (CH3)2NH·7 H2O se forme. La diméthylamine est soluble dans divers solvants organiques.
Les solutions aqueuses de diméthylamine sont de bons solvants pour de nombreux composés inorganiques et organiques ; cependant, la réactivité potentielle du soluté avec la diméthylamine doit être prise en compte.
Le Tableau 1 répertorie les propriétés physiques de la diméthylamine.
| Propriété | Valeur |
|---|---|
| Poids moléculaire, g/mol | 45.08 |
| Point d'ébullition (101,33 kPa), °C | 6.8 |
| Point de fusion, °C | -92,2 |
| Densité à 25 °C (liquide), g/cm3 | 0,6556 |
| pKa (à 25 °C) | 10.77 |
| Indice de réfraction à 17 °C | 1.350 |
| Tension superficielle (25 °C), 10-3 N/m | 16h33 |
| Chaleur de vaporisation à 25°C, kJ/mol | 23,663 |
| Chaleur de fusion, kJ/mol | 5,945 |
| Chaleur standard de formation, kJ/mol à 25 °C (liquide) | -43,96 |
| Chaleur standard de formation, kJ/mol à 25 °C (gaz) | -18.46 |
| Chaleur de combustion, état standard à 25°C, liquide, kJ/mol | -1744.63 |
| Capacité thermique, gaz parfait (25°C), J K-1 mol-1 | 70,7 |
| Température critique, °C | 164,5 |
| Pression critique, MPa | 5.31 |
| Constante diélectrique (25°C), liquide | 5.26 |
| Moment dipolaire dans le benzène (25°C), D | 1.18 |
| Point d'éclair (coupelle fermée), °C | -57 |
| Température d'inflammation dans l'air, °C | 400 |
| Limite inférieure d'explosivité dans l'air, % vol | 2.8 |
| Limite supérieure d'explosivité dans l'air, % vol | 14.4 |
2. Réactions chimiques de la diméthylamine
La diméthylamine est basique et, par conséquent, elle réagit avec l’eau et les acides pour former des composés diméthylammonium. En raison de la présence de groupes méthyles donneurs d’électrons, la diméthylamine possède une plus grande basicité que l’ammoniac.
Ces groupes méthyle stabilisent la charge positive formée lors de la protonation. Cependant, sa basicité reste plus faible que celle des ions hydroxyde et alcoxyde.
La diméthylamine se comporte comme un nucléophile en raison de la présence d’une paire d’électrons non partagés sur l’atome d’azote. La diméthylamine réagit facilement avec une variété de substrats, notamment les acides carboxyliques, les halogénures d’acyle, les anhydrides, les esters, les lactones, les isocyanates, les nitriles et esters α,β-insaturés, les époxydes, les halogénures d’alkyle, le dioxyde de carbone et le disulfure de carbone.
La réaction de la diméthylamine avec un acide organique ou l’ester d’un acide organique conduit à la formation d’un amide diméthyl-substitué.
La diméthylamine et le phosgène réagissent pour produire de la tétraméthylurée. La réaction avec l’urée conduit à la N,N-diméthylurée attendue.
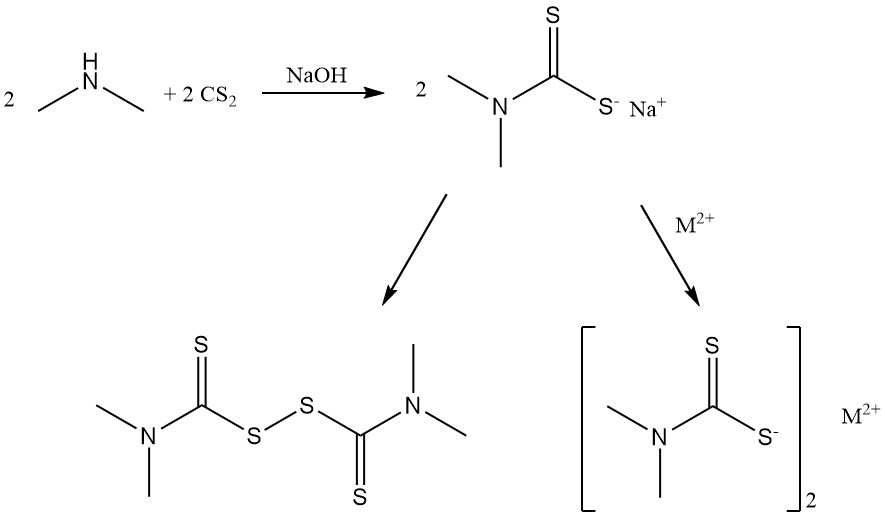
La réaction de la diméthylamine avec le disulfure de carbone produit des sels de diméthyldithiocarbamate et du bis(diméthyldithiocarbamoyl) disulfure utilisés comme accélérateurs de caoutchouc.
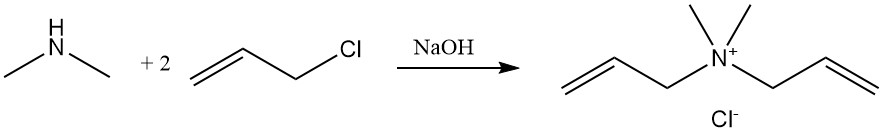
La réaction de la diméthylamine avec le chlorure d’allyle produit du chlorure de diallyldiméthylammonium, un monomère polymérisé et utilisé comme floculant dans les applications de traitement de l’eau.
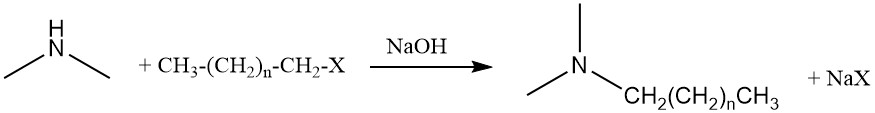
La diméthylamine peut également subir une autre réaction d’amination avec des alcools gras ou des halogénures gras pour produire des alkyldiméthylamines, qui sont des précurseurs des tensioactifs d’oxyde d’amine.
L’acide nitreux et le chlorure de nitrosyle convertissent la diméthylamine en nitrosamine correspondante.
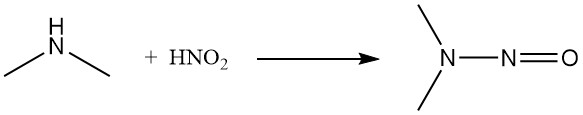
L’oxyde d’éthylène réagit avec la diméthylamine pour donner de la diméthyléthanolamine.

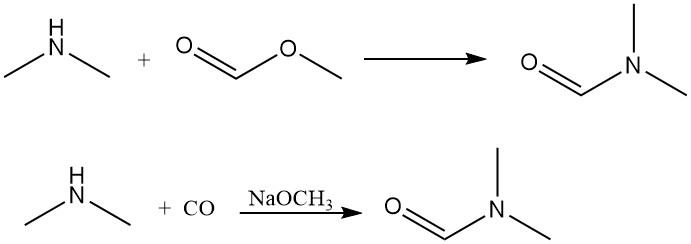
La diméthylamine réagit avec le formiate de méthyle pour générer du diméthylformamide, un solvant aprotique dipolaire. Cette réaction peut également être réalisée efficacement par addition directe de monoxyde de carbone avec une base comme catalyseur.
La diméthylamine réagit avec le dioxyde de carbone pour former des carbamates de diméthylamine dans des conditions anhydres et des carbonates de diméthylamine en présence d’eau.
La diméthylamine est corrosive pour l’aluminium, le cuivre, les alliages de cuivre, le métal galvanisé, le magnésium, le zinc et les alliages de zinc. La diméthylamine anhydre et ses solutions aqueuses peuvent être manipulées en utilisant des matériaux en acier.
3. Production de diméthylamine
Commercialement, la diméthylamine est produite par amination du méthanol avec de l’ammoniac. Ce processus se produit en phase vapeur (300 à 500 °C et 790 à 3 550 kPa) dans des réacteurs à lit fixe, produisant un mélange de mono-, di- et triméthylamine.

Méthode 1 : Amination du méthanol catalysée par un acide (procédé Leonard)
Cette méthode traditionnelle utilise un catalyseur acide solide, généralement de la silice-alumine amorphe, pour favoriser la conversion du méthanol à haute température. La réaction atteint l’équilibre, favorisant la formation de triméthylamine à des rapports ammoniac/méthanol plus faibles. Cependant, les demandes du marché donnent la priorité à la diméthylamine, suivie de la méthylamine et de la triméthylamine.
Méthode 2 : Amination du méthanol catalysée par un acide sélective en forme
Cette méthode répond aux défis de sélectivité de la méthode 1 en utilisant des catalyseurs zéolitiques sélectifs de forme (par exemple, mordénites modifiées, RHO et chabazite). Ces catalyseurs limitent la formation de molécules volumineuses de triméthylamine dans leurs pores, conduisant à un mélange de produits enrichi en diméthylamine.
L’amination du méthanol implique des réactions de substitution séquentielles, transformant le méthanol en amines primaires, secondaires et tertiaires. De plus, des réactions de dismutation se produisent, établissant un équilibre entre les différents produits méthylamine.
Méthode 1 fonctionne généralement avec une conversion élevée du méthanol et repose sur des réactions de dismutation rapides. Il en résulte un mélange à l’équilibre régi par le rapport ammoniac/méthanol. Pour obtenir la distribution de produit souhaitée, les excès de méthylamine et de triméthylamine n’ayant pas réagi sont souvent recyclés, ce qui est gourmand en énergie.
L’avènement des catalyseurs zéolitiques à forme sélective a offert une solution pour optimiser la sélectivité des produits. En raison de la taille limitée de leurs pores, ces catalyseurs limitent la formation et la diffusion de molécules de triméthylamine, favorisant la production de diméthylamine.
Exemples de processus commerciaux :
- Procédé Mitsubishi Rayon : ce procédé à deux réacteurs utilise un catalyseur non sélectif pour la dismutation initiale de la triméthylamine, suivi d’une zéolite sélective de forme. lit de catalyseur pour un ajustement ultérieur du produit.
- Procédé chimique Mitsui : Ce procédé recycle en continu la triméthylamine sous forme de mélange azéotropique avec de l’ammoniac, favorisant sa dismutation et sa conversion ultérieure en diméthylamine souhaitée en utilisant un catalyseur de mordénite silylée à forme sélective.
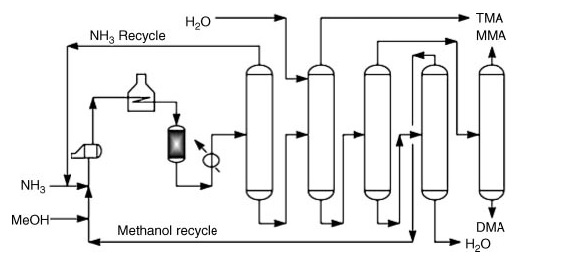
*MMA : méthylamine ; DMA : diméthylamine et TMA : triméthylamine
Après les étapes de réaction, la récupération du produit pur implique une série d’étapes de distillation :
- Séparation et recyclage de l’ammoniac.
- Récupération de triméthylamine à l’aide d’eau pour une volatilité accrue.
- Séparation de la méthylamine et de la diméthylamine de l’eau et du méthanol n’ayant pas réagi.
- Récupération individuelle de méthylamine et diméthylamine purifiées.
- Séparation du méthanol n’ayant pas réagi de l’eau.
4. Utilisations de la diméthylamine
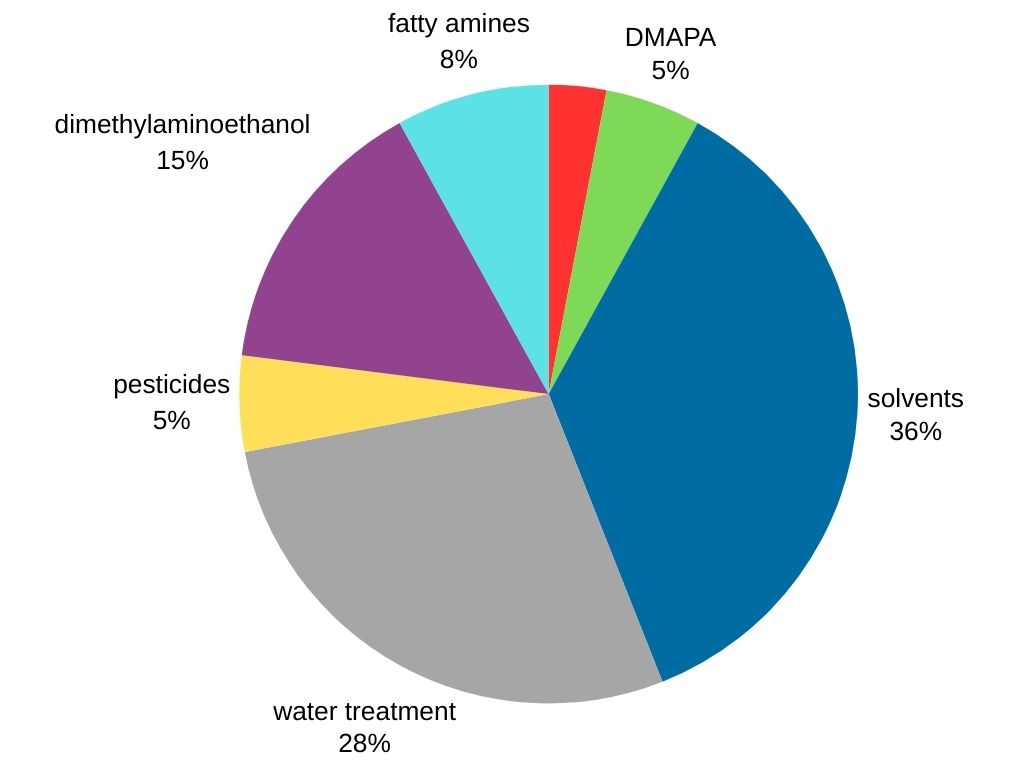
La diméthylamine se distingue comme la méthylamine la plus demandée sur le marché mondial. Il est utilisé dans diverses industries, notamment :
- Production de solvants : la diméthylamine sert de précurseur crucial pour la synthèse de solvants populaires comme le diméthylformamide (DMF) et le diméthylacétamide (DMAC).
- Traitement de l’eau.
- Tensioactifs : la diméthylamine est utilisée dans la production de 3-diméthylaminopropylamine (DMAPA), qui est un intermédiaire tensioactif.
- Traitement du caoutchouc : la diméthylamine réagit avec le disulfure de carbone pour produire du dithiocarbamate de diméthyle, un composant crucial dans la vulcanisation du caoutchouc, qui renforce et améliore les propriétés du caoutchouc.
- Produits agrochimiques (pesticides).
- Autres produits chimiques (diméthylaminoéthanol et amines grasses).
5. Toxicologie de la diméthylamine
La diméthylamine est un liquide ou un gaz inflammable qui présente un risque d’incendie important.
Effets d’exposition aiguë
- Irritants et corrosifs pour la peau et les yeux : le contact peut provoquer de graves brûlures et irritations.
- Irritant par inhalation : la respiration irrite le nez, la gorge et les poumons. Des concentrations élevées peuvent provoquer une accumulation de liquide dans les poumons (œdème pulmonaire), ce qui est une urgence médicale.
Effets d’exposition chronique
- Peut endommager le foie en cas d’exposition répétée.
- Danger potentiel pour la reproduction (effets sur les testicules mâles).
- Peut irriter les poumons, entraînant une bronchite accompagnée de toux, de mucosités et d’essoufflement.
La diméthylamine n’est pas classée comme cancérigène, selon les données actuelles.
Limites d’exposition sur le lieu de travail
- OSHA PEL (limite d’exposition admissible) : 10 ppm en moyenne sur une journée de travail de 8 heures.
- NIOSH REL (limite d’exposition recommandée) : 10 ppm en moyenne sur une journée de travail de 10 heures.
- ACGIH TLV (valeur limite seuil) : 5 ppm en moyenne sur une journée de travail de 8 heures, limite d’exposition à court terme (STEL) de 15 ppm.
Mesures de précaution
- Contrôles techniques : Donner la priorité aux opérations de confinement et à l’utilisation d’une ventilation par aspiration locale pour minimiser l’exposition à l’air.
- Pratiques de travail : maintenez de bonnes pratiques d’hygiène, évitez tout contact avec la peau et les yeux, et ne mangez pas, ne buvez pas et ne fumez pas dans les zones contaminées.
- Équipement de protection individuelle : lorsque les contrôles techniques sont insuffisants, portez des gants, des vêtements, des lunettes ou des lunettes de sécurité appropriés résistants aux produits chimiques et des respirateurs en suivant protocoles établis.
Stockage et manipulation
- Conserver dans des récipients hermétiquement fermés dans un endroit frais et bien ventilé, à l’écart des sources de chaleur et des produits chimiques incompatibles (par exemple, agents oxydants, acides forts et mercure).
- Mettez et collez les conteneurs métalliques pendant les opérations de transfert.
- Utilisez des outils et des équipements anti-étincelles, en particulier lors de la manipulation de conteneurs.
Références
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
- https://nj.gov/health/eoh/rtkweb/documents/fs/0737.pdf
