Methylamin: Herstellung, Reaktionen und Verwendungen
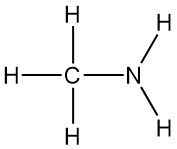
Methylamin ist das einfachste primäre Amin mit der Formel CH3NH2. Es ist ein farbloses Gas, das aus Ammoniak gewonnen wird und bei dem ein Wasserstoffatom durch eine Methylgruppe ersetzt ist. Es wurde erstmals 1849 von Wurtz zusammen mit Dimethylamin und Trimethylamin synthetisiert.
Über die industrielle Synthese von Methylaminen aus Methanol und Ammoniak wurde 1884 berichtet und in den 1920er Jahren für die Ledergerbung kommerzialisiert.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Methylamin
Methylamin ist ein Gas, das in geringen Konzentrationen einen charakteristischen Fischgeruch aufweist, bei höheren Konzentrationen jedoch einen ammoniakähnlichen Geruch aufweist. Seine wässrigen Lösungen bilden beim Abkühlen kristalline Hydrate mit der Formel CH3NH2·3 H2O.
Methylamin ist in verschiedenen organischen Lösungsmitteln löslich, beispielsweise Methanol, Ethanol, Dimethylformamid und Ethylenglykol.
Tabelle 1 zeigt die detaillierten physikalischen Eigenschaften von Methylamin.
| Eigenschaft | Wert |
|---|---|
| Molekulargewicht (g/mol) | 31.06 |
| Siedepunkt (101,33 kPa), °C | -6.3 |
| Schmelzpunkt, °C | -93,0 |
| Dichte (Gas), g/cm3 bei 101,33 kPa | 0,0014 |
| Dichte (flüssig), g/cm3 bei 25 °C | 0,6624 |
| pKa (bei 25 °C) | 10,62 |
| Oberflächenspannung (25 °C), 10-3 N/m | 19.19 |
| Verdampfungswärme (25 °C), kJ/mol | 24.249 |
| Verdampfungswärme (Siedepunkt), kJ/mol | 26,0 |
| Schmelzwärme, kJ/mol | 6.054 |
| Standardbildungswärme (Flüssigkeit, 25 °C), kJ/mol | -47,31 |
| Standardbildungswärme (Gas, 25 °C), kJ/mol | -22,98 |
| Verbrennungswärme (Flüssigkeit, Standardzustand, 25 °C), kJ/mol | -1061,35 |
| Wärmekapazität (ideales Gas, 25 °C), J K-1 mol-1 | 50,1 |
| Kritische Temperatur, °C | 156,9 |
| Kritischer Druck, MPa | 7,46 |
| Dielektrizitätskonstante (Flüssigkeit, 25 °C) | 9.4 |
| Dipolmoment in Benzol (25 °C), D | 1,47 |
| Flammpunkt (geschlossener Tiegel), °C | -62 |
| Zündtemperatur in Luft, °C | 430 |
| Untere Explosionsgrenze in Luft (Vol. %) | 4.9 |
| Obere Explosionsgrenze in Luft (Vol.-%) | 20,7 |
2. Chemische Reaktionen von Methylamin
Methylamin ist eine schwache Base, die mit Säuren leicht Salze bildet (z. B. Methylammoniumhalogenide, auch Methylaminhydrohalogenide genannt, mit den entsprechenden Halogenwasserstoffsäuren).
Die Reaktion von Methylamin mit Alkylhalogeniden führt zur weiteren Alkylierung bis hin zur Bildung quartärer Ammoniumsalze. Ein Beispiel ist die Reaktion mit Ethylhalogenid unter Bildung von Methylethylamin, Methyldiethylamin und Methyltriethylammoniumhalogenid.
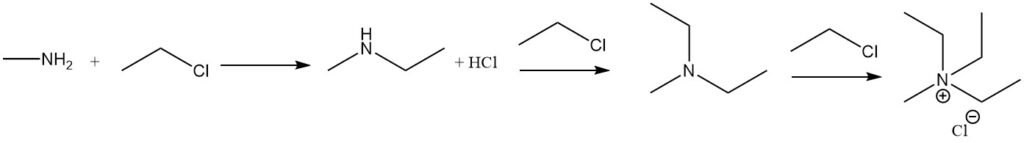
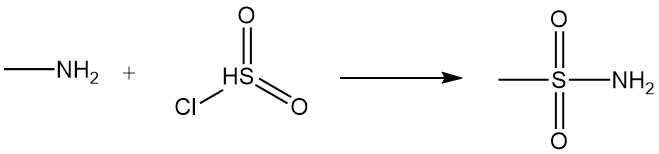
Die Reaktion von Methylamin mit Carbonsäuren und ihren Derivaten führt zu N-Methylamiden, und die Reaktion mit Sulfonylchlorid erzeugt substituiertes Methylsulfonamid.
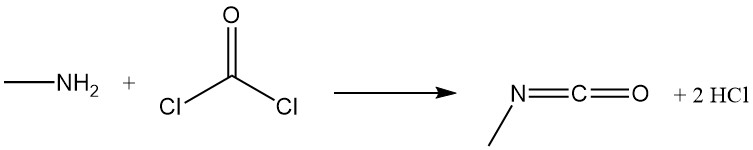
Methylamin reagiert mit Phosgen unter Bildung von Methylisocyanat, einem Zwischenprodukt bei der Herstellung von Carbamat-Insektiziden, und mit Schwefelkohlenstoff in Gegenwart von Natriumhydroxid unter Bildung von Natriummethyldithiocarbamat.
Harnstoff reagiert mit Methylamin über das Zwischenprodukt Ammoniumcyanat zu N-Methylharnstoff.
Alkalische Hypochlorite führen zu einer Mischung aus Methylmono- und -dichloraminen.
Methylamin wird durch Behandlung mit salpetriger Säure zu Methanol und Stickstoff und durch Einwirkung von Nitrosylchlorid zu Methylchlorid und Stickstoff zersetzt.
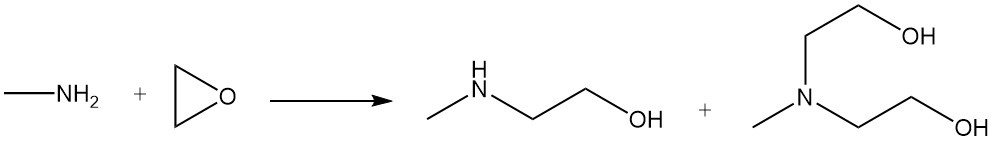
Methylethanolamin und Methyldiethanolamin entstehen durch die Reaktion von Methylamin mit Ethylenoxid.
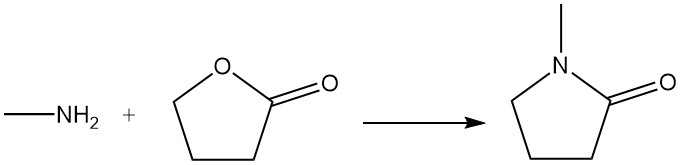
γ-Butyrolacton reagiert mit Methylamin zu N-Methylpyrrolidon, das als Lösungsmittel verwendet wird.
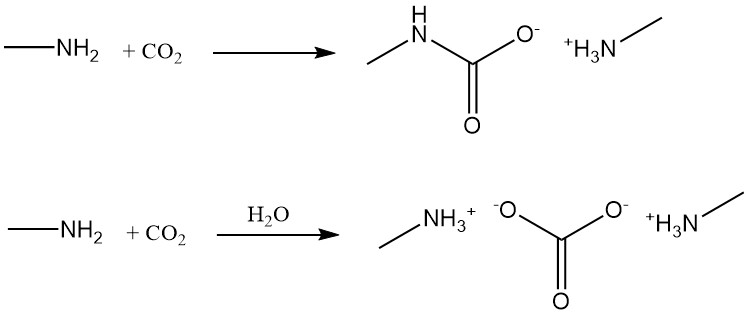
Methylamin reagiert mit Kohlendioxid unter wasserfreien Bedingungen zu Methylamincarbamat und in Gegenwart von Wasser zu Methylamincarbonat.
Methylamin wirkt korrosiv gegenüber Aluminium, Kupfer, Kupferlegierungen, verzinktem Metall, Magnesium, Zink und deren Legierungen. Stahl zeigt jedoch eine gute Leistung als Baumaterial für den Umgang mit wasserfreiem Methylamin und seinen wässrigen Lösungen.
3. Herstellung von Methylamin
Methylamin entsteht durch die exotherme Reaktion zwischen Methanol und Ammoniak an einem amorphen Siliciumdioxid-Aluminiumoxid-Katalysator bei 350–450 °C. Bei dieser Reaktion entsteht eine Mischung der drei Methylamin-Varianten (Mono-, Di- und Trimethylamin).
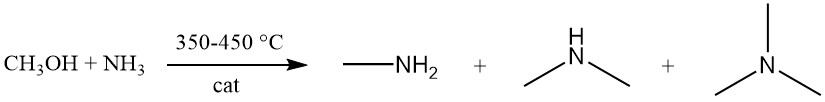
Während das Gleichgewicht die Bildung von Trimethylamin begünstigt, priorisiert die Marktnachfrage Mono- und insbesondere Dimethylamin. Der Aminsyntheseprozess kann durch neun bimolekulare Gleichgewichtsreaktionen modelliert werden, von denen drei speziell die Aminbildung beinhalten:
- NH3 + CH3OH → CH3NH2 + H2O
- CH3NH2 + CH3OH → (CH3)2NH + H2O
- (CH3)2NH + CH3OH → (CH3)3N + H2O
Für die Dampfphasen-Methanol-Ammoniak-Reaktion werden derzeit zwei primäre Katalysatorsysteme verwendet: amorphe feste Säurekatalysatoren und formselektive Katalysatoren auf Zeolithbasis.
Das rohe Reaktionsgemisch, das Methylamine, überschüssiges Ammoniak, Wasser und nicht umgewandeltes Methanol enthält, wird mithilfe einer Reihe von Destillationskolonnen (typischerweise 4–5) gereinigt. Trimethylamin wird durch extraktive Destillation aus der Mischung abgetrennt.
Dieser Reinigungsprozess erzielt hohe Ausbeuten (>98 %) an reinem, wasserfreiem Mono-, Di- und Trimethylamin. Das zurückgewonnene Methanol verbessert die Prozesseffizienz und die Lebensdauer des Katalysators.
4. Verwendung von Methylamin
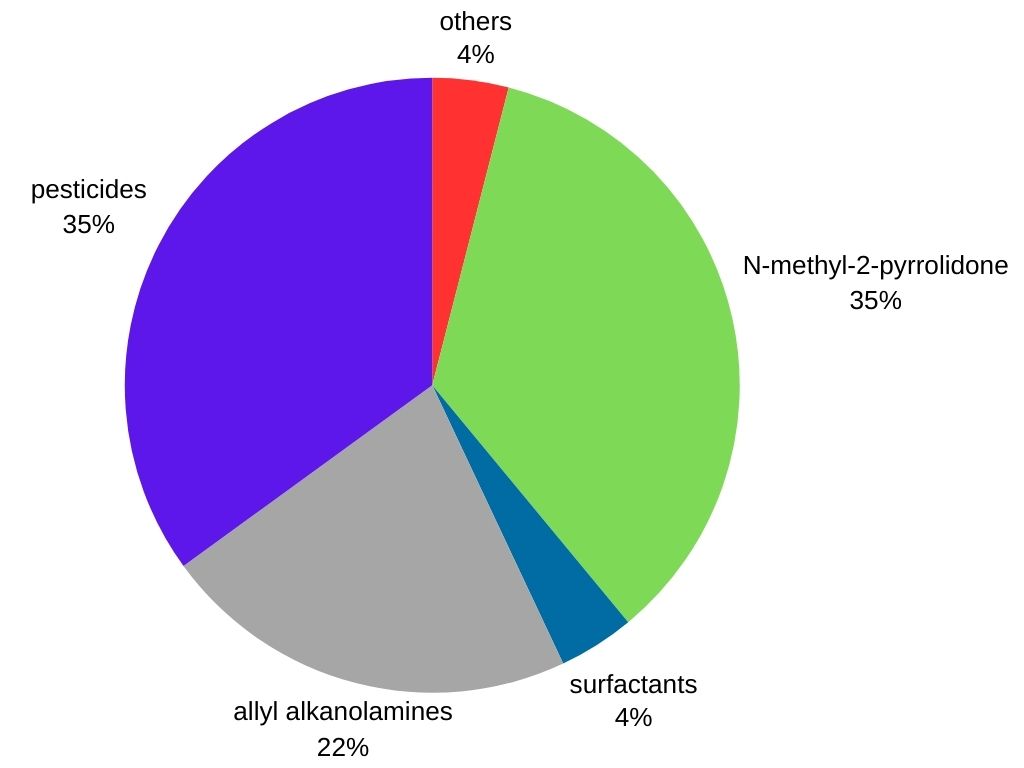
Methylamin wird hauptsächlich als Zwischenprodukt bei der Herstellung mehrerer kommerzieller Produkte verwendet:
- Agrochemikalien: Methylamin ist ein wichtiges Zwischenprodukt bei der Herstellung zahlreicher Herbizide, Pestizide und Insektizide und trägt zum Pflanzenschutz bei.
- Pharmazeutika: Es wird bei der Synthese bestimmter Medikamente verwendet, darunter abschwellende Mittel und Antihistaminika.
- Chemikalien für die Gummiverarbeitung: Methylamin findet Anwendung bei der Herstellung verschiedener Gummiprodukte wie Reifen und Schläuche.
- Tenside: Es wird bei der Herstellung von Reinigungs- und Netzmitteln eingesetzt, die in Waschmitteln, Shampoos und Emulgatoren enthalten sind.
- Andere Anwendungen: Methylamin ist auch ein Vorläufer für Tovex (Wassergel-Sprengstoff), das Lösungsmittel N-Methyl-2-pyrrolidon, Methyldiethanolamin (ein Lösungsmittel, das bei der Kohlenwasserstoffverarbeitung verwendet wird) und das Bodendesinfektionsmittel „Metam-Natrium“.
5. Toxikologie von Methylamin
Sowohl Methylamin als auch seine Lösungen sind extrem entzündlich und erfordern eine ordnungsgemäße Handhabung, um Brände und Explosionen zu verhindern.
Methylamin und seine wässrigen Lösungen sind ätzend und können Verätzungen und Reizungen der Augen, der Haut und der Atemwege verursachen. Beim Einatmen wirkt es in geringen Konzentrationen (75 ppm) auf die oberen Atemwege, höhere Konzentrationen können die Leber schädigen.
Die Exposition gegenüber Methylamin kann ähnliche Auswirkungen wie Ammoniak haben, einschließlich Bronchitis, Konjunktivitis, Dermatitis und in schweren Fällen Reizungen, Verbrennungen, Lungenschäden und verzögerte Organnarbenbildung.
Die wiederholte Exposition gegenüber Methylamin bei Tieren wurde mit Lebertoxizität, Anomalien der Blutchemie und Lungenproblemen in Verbindung gebracht.
Studien zur genetischen Toxizität sind nicht schlüssig.
Vorhandene Studien deuten darauf hin, dass der Fötus nicht besonders anfällig für eine Exposition ist, obwohl weitere Untersuchungen erforderlich sind.
Die American Conference of Governmental Industrial Hygienists (ACGIH) hat einen Schwellenwert (TLV) von 5 ppm (parts per million) als zeitgewichteten Durchschnitt (TWA) und 15 ppm als kurzfristigen Expositionsgrenzwert (STEL) festgelegt Methylamin.
Verweise
- Methylamines; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a16_535.pub4
- Methylamine; Encyclopedia of Toxicology (Third Edition). – https://www.sciencedirect.com/science/article/abs/pii/B9780123864543005182
- Methylamines; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.1305200820211818.a01.pub2
