Butirolactona: Propiedades, Producción y Usos
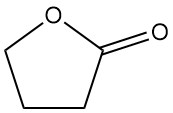
La γ-butirolactona (CAS 96-48-0), también conocida como lactona del ácido γ-hidroxibutírico, es un compuesto orgánico simple con la fórmula C4H6O2. Es un líquido higroscópico e incoloro con un ligero olor que puede parecer anodino a primera vista.
Su producción industrial comenzó en la década de 1940 como resultado del trabajo de Reppe y sus colegas de BASF. El proceso de Reppe sigue siendo el método dominante para la síntesis de γ-butirolactona a gran escala.
Tabla de contenido
1. Propiedades físicas de la butirolactona
La γ-butirolactona existe como un líquido incoloro, ligeramente higroscópico y con un ligero olor. Es miscible con agua, alcoholes, ésteres, éteres, cetonas e hidrocarburos aromáticos. Si bien tiene una miscibilidad limitada con hidrocarburos alifáticos lineales y cíclicos, se utiliza como disolvente para numerosos polímeros e hidrocarburos inferiores.
Algunas propiedades físicas de la γ-butirolactona se enumeran en la siguiente tabla:
| Propiedad | Valor |
|---|---|
| Masa molar | 86,09 g/mol |
| Punto de fusión | -43,5°C |
| Punto de ebullición | 204-206°C (a 101,3 kPa) |
| Densidad (0°C) | 1,15 g/cm³ |
| Densidad (20°C) | 1,13 g/cm³ |
| Densidad (40°C) | 1,11 g/cm³ |
| Temperatura crítica | 436,5°C |
| Presión crítica | 3,35MPa |
| Presión de vapor (20°C) | 0,04 kPa |
| Presión de vapor (50°C) | 0,3kPa |
| Presión de vapor (100°C) | 3,6 kPa |
| Presión de vapor (150°C) | 22,5 kPa |
| Presión de vapor (205°C) | 101,3 kPa |
| Calor de vaporización (206°C) | 535 kJ/kg |
| Calor de solución en agua | 2500 J/mol |
| Capacidad calorífica específica (cp) - Líquido (25 °C) | 1680 J·kg⁻¹ K⁻¹ |
| Capacidad calorífica específica (cp) - Líquido (100 °C) | 1850 J·kg⁻¹ K⁻¹ |
| Capacidad calorífica específica (cp) - Líquido (200 °C) | 2200 J·kg⁻¹ K⁻¹ |
| Capacidad calorífica específica (cp) - Gas (100 °C) | 1275 J·kg⁻¹ K⁻¹ |
| Capacidad calorífica específica (cp) - Gas (200 °C) | 1575 J·kg⁻¹ K⁻¹ |
| Capacidad calorífica específica (cp) - Gas (300 °C) | 1820 J·kg⁻¹ K⁻¹ |
| Punto de inflamación | 100-101°C |
| Temperatura de ignición | 455°C |
| Calor de combustión | 234 kJ/g |
| Límites de explosión: inferiores | 2,7 % en volumen |
| Límites de explosión: superior | 15,6% vol. |
| Índice de refracción (20°C) | 1,4352 |
| Viscosidad (20°C) | 1,90 mPa·s |
| Viscosidad (50°C) | 1,25 mPa·s |
| Viscosidad (80°C) | 0,86 mPa·s |
| Viscosidad (110°C) | 0,63 mPa·s |
| Viscosidad (140°C) | 0,49 mPa·s |
| Viscosidad (170°C) | 0,40 mPa·s |
| Tensión superficial (20°C) | 44,6 x 10⁻⁵ N/cm |
| Constante dieléctrica (20°C) | 39.1 |
| Conductividad térmica (25-65 °C) | 0,276 J·m⁻¹ s⁻¹ K⁻¹ |
| Conductividad | 0,7 µS/cm |
2. Propiedades químicas de la butirolactona
En una solución acuosa, la isomerización entre la forma de lactona y la forma de ácido hidroxibutírico libre es un equilibrio que depende de la temperatura. A 0°C, la forma lactona predomina completamente, mientras que a 100°C, aproximadamente el 80% existe como lactona.
Las condiciones alcalinas fuertes (un equivalente molar de álcali) desplazan el equilibrio completamente hacia la forma de ácido hidroxibutírico. Esta propiedad permite la determinación titrimétrica de butirolactona. A un pH neutro (7), la butirolactona es muy estable.
La butirolactona sufre reacciones de escisión del anillo con varios reactivos, produciendo derivados del ácido γ-hidroxibutírico. Los ejemplos incluyen reacciones con bases, haluros de hidrógeno y alcoholes (en condiciones ácidas).
También sufre reacciones en la posición α sin escisión del anillo. Estos incluyen reacciones con amoníaco, aminas, compuestos carbonílicos y halogenación. Por ejemplo, su condensación con acetato de etilo forma α-acetobutirolactona, un intermediario importante en la síntesis de vitamina B1.
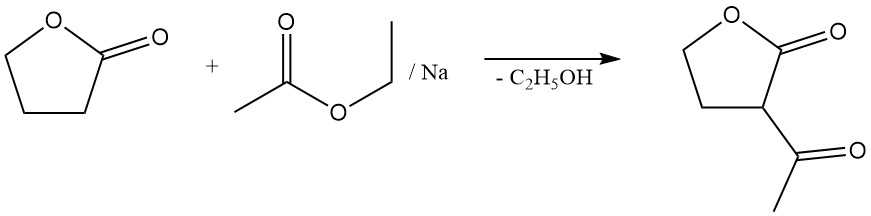
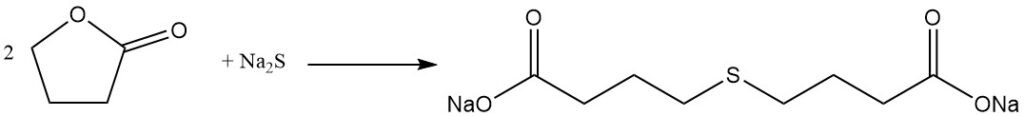
La reacción de escisión del anillo de lactona permite la preparación de valiosos derivados del ácido butírico sustituidos con γ. Por ejemplo, la reacción con sulfuro de sodio produce el aditivo para caucho ácido tiodibutírico,
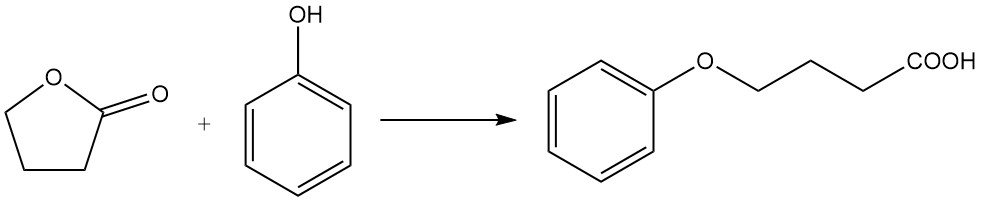
mientras que la reacción con fenol produce ácido fenoxibutírico.
Reemplazar el átomo de oxígeno del anillo con nitrógeno es una reacción industrial utilizada para la síntesis de derivados de pirrolidona. Por ejemplo, la butirolactona reacciona con la metilamina para producir N-metilpirrolidona (NMP), un disolvente industrial clave.
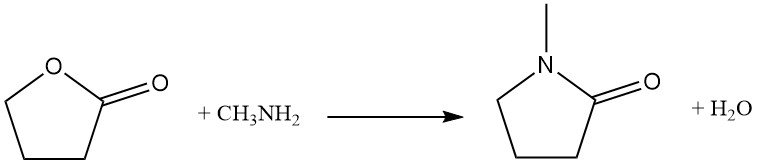
La homopolimerización directa de butirolactona requiere alta presión (2000 MPa), pero rutas alternativas, como la fermentación de azúcares, pueden dar un producto similar.
3. Producción de butirolactona
3.1. Producción de butirolactona mediante deshidrogenación de 1,4-butanodiol
El proceso Reppe es la ruta industrial predominante para la síntesis de butirolactona, lograda mediante la deshidrogenación endotérmica en fase gaseosa del 1,4-butanodiol. Esta reacción de varios pasos se produce a través de intermedios de γ-hidroxibutiraldehído y 2-hidroxitetrahidrofurano.

Los principales fabricantes que emplean este proceso son BASF, Ashland y Lyondell.
El vapor de 1,4-butanodiol precalentado se combina con una corriente de hidrógeno circulante caliente y se pasa sobre un lecho de catalizador de cobre a presión atmosférica y temperaturas que oscilan entre 180 y 300 °C (Figura 1). Esta reacción proporciona un alto rendimiento de aproximadamente 95 % de butirolactona.
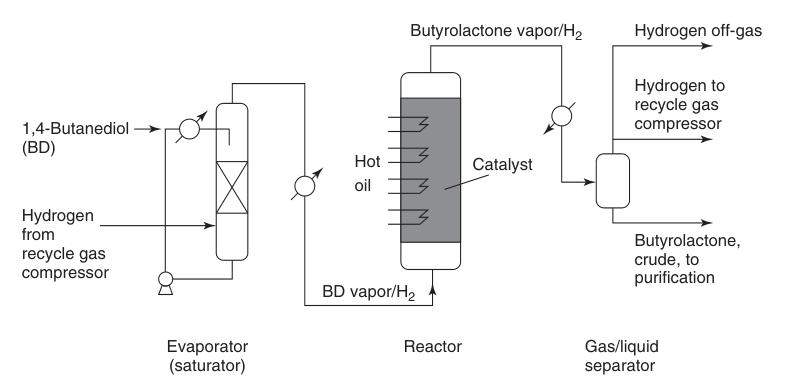
El subproducto de hidrógeno generado requiere una purificación mínima para su posible reutilización, lo que normalmente implica una metanización catalítica para eliminar las impurezas de monóxido de carbono.
La butirolactona cruda que se separa de la corriente de gas reciclado contiene impurezas menores como 1,4-butanodiol sin reaccionar, ácido butírico y compuestos de alto punto de ebullición. Estos se eliminan mediante destilación para obtener butirolactona pura.
La butirolactona en sí no es corrosiva y es compatible con equipos de acero al carbono. Sin embargo, los componentes expuestos al producto crudo caliente que contiene ácido butírico, como partes de los recipientes y tuberías de síntesis o destilación, requieren el uso de acero inoxidable para una mayor durabilidad.
3.2. Producción de butirolactona mediante hidrogenación de anhídrido maleico
Una ruta alternativa a la butirolactona implica la hidrogenación catalítica del anhídrido maleico. En este proceso, se introduce anhídrido maleico fundido precalentado en una corriente circulante de hidrógeno bajo presión (6-12 MPa) y temperatura (160-280°C). Un catalizador a base de níquel promueve la reacción, que se desarrolla de forma exotérmica con un ΔH de -211 kJ/mol:
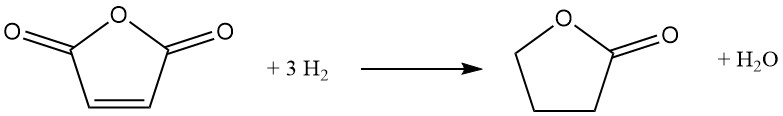
La vía de reacción implica anhídrido succínico intermedio y, dependiendo de las condiciones elegidas, puede dirigirse hacia la producción de tetrahidrofurano. Sin embargo, la hidrogenación completa del anhídrido succínico conduce inevitablemente a la coformación de tetrahidrofurano.
El exceso de hidrógeno se recicla después del lavado con agua para eliminar las impurezas. Los subproductos formados durante la síntesis de butirolactona, incluidos propanol, butanol, ácido propiónico y ácido butírico, se separan de la corriente de gas circulante. La destilación posterior purifica la corriente de butirolactona.
Debido a la presencia de subproductos ácidos, tanto el equipo de síntesis como el de destilación requieren una construcción de acero inoxidable. Mitsubishi Chemical Corporation es un fabricante que emplea este método.
3.3. Producción de butirolactona mediante hidrogenación de ésteres maleicos
En la década de 1980, surgieron varios procesos que utilizaban maleato de dimetilo como intermediario y ofrecen rutas alternativas al 1,4-butanodiol y al tetrahidrofurano (THF). Estos métodos también presentan la oportunidad de aislar butirolactona, un intermedio en la secuencia de reacción.
Un proceso notable, desarrollado por Kvaerner Process Technology (ahora Johnson Matthey Davy Technologies), utiliza maleato de dimetilo como producto inicial obtenido a partir de anhídrido maleico y metanol utilizando un catalizador de intercambio iónico ácido fuerte.
La hidrogenación posterior en fase gaseosa sobre un sistema catalizador a base de cobre, bajo presiones de 2 a 8 MPa y temperaturas de 150 a 250 °C, produce una mezcla de los productos deseados: 1,4-butanodiol, THF, butirolactona, trazas de dimetilo. succinato (intermedio) y n-butanol como subproducto principal.
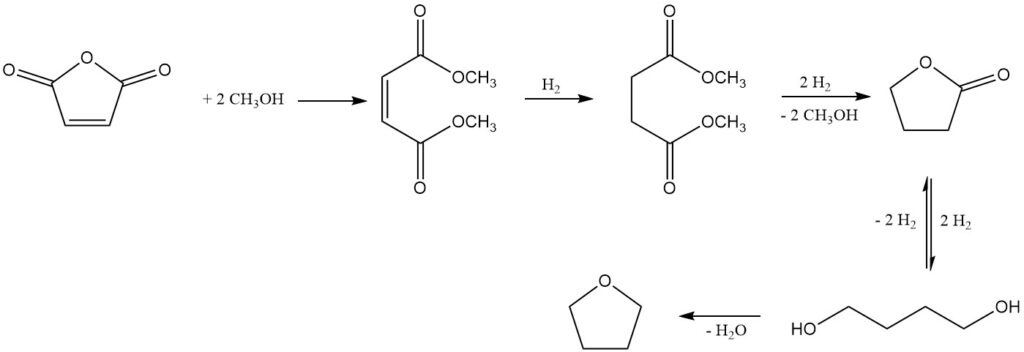
La butirolactona y el succinato de dimetilo forman una mezcla azeotrópica, lo que permite su recuperación y reciclaje a la etapa de hidrogenación. Esta estrategia de reciclaje promueve la conversión completa hacia 1,4-butanodiol y THF. Alternativamente, el azeótropo se puede refinar mediante destilación para aislar la butirolactona pura.
El rendimiento de butirolactona está directamente influenciado por la presión de funcionamiento y la temperatura durante la hidrogenación, que dictan el equilibrio entre 1,4-butanodiol y butirolactona. En las condiciones informadas, los rendimientos pueden oscilar entre el 5% y el 50%.
Este proceso innovador ha ganado un importante interés comercial, y KPT y JM Davy obtuvieron licencias para construir múltiples plantas de butanodiol-butirolactona-THF en Arabia Saudita, Malasia, Corea y China.
3.4. Producción de butirolactona mediante proceso de base biológica
Metabolix (ahora Yield10 Bioscience, Inc.) desarrolló un proceso de fermentación para producir poli(4-hidroxibutirato) (polibutirolactona) a partir de azúcares. Este polímero se puede despolimerizar a butirolactona a temperaturas superiores a 200 °C, logrando resultados óptimos con hidróxido de calcio. La biomasa restante se convierte en combustible sólido. A partir de 2019, no existe ninguna planta comercial que utilice este método.
BioAmber propuso una ruta de base biológica en la que los azúcares se fermentan hasta obtener sal de diamonio del ácido succínico. La posterior eliminación del amoníaco produce ácido succínico, que puede hidrogenarse en presencia de un catalizador de metal precioso para producir butirolactona, junto con 1,4-butanodiol y tetrahidrofurano. Este proceso aún no ha alcanzado aplicación comercial.
Aunque no tiene importancia comercial, la investigación ha explorado varias vías alternativas para la síntesis de butirolactona a partir de tetrahidrofurano, dihidrofurano, acetileno, butinodiol, olefinas, butadieno o mediante carbonilación.
4. Usos de la butirolactona
La versatilidad de la butirolactona va mucho más allá de su papel como simple intermediario químico. Sus aplicaciones abarcan diversos campos, desde formulaciones farmacéuticas hasta ciencia de polímeros e incluso tecnologías emergentes en electrónica.
La butirolactona sirve como componente fundamental para diversos productos químicos, entre ellos la N-metilpirrolidona (NMP) y la pirrolidona, ambas con sus propios usos importantes. También se utiliza en la síntesis de herbicidas fenoxi como el MCPB (ácido γ-2-metil-4-clorofenoxibutírico) y reguladores del crecimiento.
Es un intermediario en la producción de α-acetobutirolactona, un paso vital en la síntesis de vitamina B1. La butirolactona también se utiliza para la producción de ácido tiodibutírico, un valioso aditivo en la fabricación de caucho.
Es un disolvente que puede disolver diversos polímeros, facilitando su procesamiento y manipulación. Además, es un valioso catalizador para reacciones de polimerización específicas.
La butirolactona contribuye a la formulación de composiciones para ondular el cabello, cremas solares, otros productos de cuidado personal y productos farmacéuticos.
Otras aplicaciones de la butirolactona incluyen: como disolvente en tintas de impresión por inyección, extractante en la industria petrolera, como estabilizador para clorohidrocarburos y pesticidas a base de fósforo y como nematocida.
Sus propiedades únicas lo convierten en un cosolvente prometedor para electrolitos de condensadores en la industria electrónica y tiene un uso potencial en fotoprotectores.
5. Toxicología y Salud Laboral
Absorción y Metabolismo:
- La butirolactona se absorbe fácilmente a través del intestino y la piel. Su vida media oral en ratas es de unos 20 minutos.
- El metabolismo y la excreción son rápidos y producen principalmente ácido γ-hidroxibutírico como metabolito principal.
- En humanos, los estudios informan (S)-3,4-dihidroxibutirato, ácido glicólico y otros metabolitos en la orina después de la ingestión.
Toxicidad aguda:
- La butirolactona presenta una toxicidad aguda baja, con valores de LD50 entre 800 y 1800 mg/kg en roedores y 500-1700 mg/kg en cobayas.
- La LD50 dérmica en cobayas es 5600 mg/kg.
- La CL50 inhalada (rata, 4 h) supera la concentración no letal más alta probada (>5,1 mg/L).
- La inhalación a temperatura ambiente saturada no muestra efectos adversos en ratas [BASF, (1960) resultados no publicados].
Efectos neurológicos:
- La depresión del sistema nervioso central (SNC) de la butirolactona se produce a través de su metabolito, el ácido γ-hidroxibutírico, con efectos anestésicos adicionales sobre el sistema nervioso periférico.
- Dosis de 2500 mg en humanos adultos indujeron un sueño temporal.
- Las dosis de 66 mg/kg en niños como anestesia provocaron un sueño profundo con depresión respiratoria ocasional.
- Dosis orales accidentales más altas en adultos y bebés provocaron inconsciencia inducida por depresión del SNC, ocasionalmente coma, bradicardia y depresión respiratoria. Los pacientes se recuperaron completamente en 24 horas con cuidados de apoyo.
Efectos locales y cutáneos:
- La butirolactona no irrita la piel, pero sí irrita moderadamente los ojos en conejos [BASF, (1960) resultados no publicados].
- No se observó sensibilización cutánea en cobayas.
- La prueba del parche en 200 voluntarios no encontró reacciones cutáneas.
- Las lociones que contienen butirolactona son bien toleradas para aplicación tópica.
- Ha servido como un analgésico tópico exitoso para el dolor musculoesquelético, los dolores de cabeza y las migrañas.
Estudios de crónica y carcinogenicidad:
- La administración oral prolongada de 3 g/kg al día durante cuatro semanas provocó depresión del SNC en ratas, pero no produjo efectos significativos adicionales.
- Los estudios de dosis repetidas mostraron una toxicidad ligeramente mayor en comparación con la alimentación forzada con posibles efectos en bolo.
- Numerosos estudios de mutagenicidad y genotoxicidad no indican potencial genotóxico.
- Estudios de carcinogenicidad a largo plazo en ratas y ratones en dosis altas no encontraron evidencia de potencial tumorigénico.
- Los primeros estudios dérmicos y orales tampoco mostraron efectos cancerígenos.
- En general, la evidencia sugiere que no hay ningún riesgo cancerígeno significativo asociado con la butirolactona.
Efectos sobre el desarrollo y la reproducción:
- La exposición prenatal en ratas y conejos por vía oral y por inhalación no mostró efectos en el desarrollo relacionados con la sustancia (BASF AG, (1993) resultados no publicados).
Exposición ocupacional:
- Los límites de exposición ocupacional específicos a la butirolactona no están establecidos en Europa ni en EE. UU.
Impacto ambiental:
- Los datos de toxicidad aguda y la rápida biodegradabilidad sugieren un riesgo ambiental mínimo.
Referencia
- Butyrolactone; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_495.pub2
