Herstellung und Anwendung von Dichloressigsäure

Dichloressigsäure ist eine farblose und stark ätzende Flüssigkeit, die saure Dämpfe abgibt, die zu Reizungen der Schleimhäute führen können. Es ist vollständig mit Wasser mischbar und kann sich leicht in verschiedenen organischen Lösungsmitteln wie Alkoholen, Ketonen, Kohlenwasserstoffen und chlorierten Kohlenwasserstoffen lösen.
Inhaltsverzeichnis
1. Physikalische Eigenschaften von Dichloressigsäure
Zu den physikalischen Eigenschaften von Dichloressigsäure, auch 2,2-Dichlorethansäure genannt, gehören:
- Molmasse: 128,95 g/mol
- Siedepunkt: 192 °C (101,3 kPa)
- Gefrierpunkt: 13,5 °C
- Dichte: 1,564
- Dampfdruck: 0,19 kPa (bei 20 °C)
- Dissoziationskonstante: 5×10-2 mol/L (bei 18 °C)
2. Chemische Eigenschaften von Dichloressigsäure
Dichloressigsäure besitzt zwei Chloratome, die anfällig für Verdrängungsreaktionen sind.
Bei der Reaktion mit aromatischen Verbindungen entstehen Diarylessigsäuren, während in Gegenwart von Phenol Diphenoxyessigsäuren entstehen.
Im Vergleich zu Chloressigsäure weist Dichloressigsäure eine geringere Hydrolyseanfälligkeit auf. Allerdings kann das Vorhandensein von Dichloressigsäureverunreinigungen in Chloressigsäure bei der Herstellung von Carboxymethylcellulose (CMCs) und Stärke zu einer Vernetzung führen. Der resultierende Vernetzungseffekt kann je nach beabsichtigter Anwendung des Endprodukts erwünscht oder unerwünscht sein.
3. Herstellungsmethoden von Dichloressigsäure
Der wirtschaftlichste Ansatz zur Herstellung von Dichloressigsäure ist die Hydrolyse von Dichloracetylchlorid.

Darüber hinaus kann durch Hydrolyse von Pentachlorethan mit 88–99 %iger Schwefelsäure oder durch Oxidation von 1,1-Dichloraceton mit Salpetersäure und Luft eine Ausbeute von 90 % an 98 % reiner Dichloressigsäure erreicht werden.
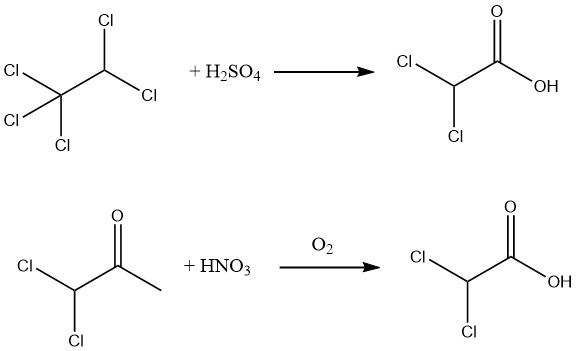
Die Hydrolyse des Methylesters, der durch die Veresterung roher Dichloressigsäure leicht erhältlich ist, ermöglicht die Herstellung außergewöhnlich reiner Dichloressigsäure.

Darüber hinaus stellt die katalytische Dechlorierung von Trichloressigsäure oder Ethyltrichloracetat mit Wasserstoff an einem Palladiumkatalysator eine Methode zur Gewinnung von Dichloressigsäure und Ethyldichloracetat dar.

Die Trennung reiner Dichloressigsäure von anderen Chloressigsäuren erweist sich mit physikalischen Mitteln wie der fraktionierten Destillation als schwierig, vor allem aufgrund der geringen Siedepunktunterschiede, insbesondere zwischen Di- und Trichloressigsäure.
Effektive Destillationskolonnen können jedoch Estermischungen zufriedenstellend fraktionieren. Darüber hinaus können Mischungen der von den drei Chloressigsäuren abgeleiteten Salze mit Wasser, Alkohol oder Wasser-Alkohol-Lösungen gewaschen werden, um vorzugsweise Dichloracetat aufzulösen, das dann angesäuert werden kann, um reine Dichloressigsäure zu erhalten.
Im Labor kann Dichloressigsäure durch Reaktion von Chloralhydrat mit Kalium- oder Natriumcyanid synthetisiert werden:
Cl3CCH(OH)2 + KCN → HCN + KCl + Cl2CHCOOH
4. Anwendungen von Dichloressigsäure
Dichloressigsäure wird als Testreagenz bei analytischen Messungen während der Faserherstellung eingesetzt, insbesondere bei der Herstellung von Polyethylenterephthalat. Es dient auch als medizinisches Desinfektionsmittel und ersetzt Formalin.
Darüber hinaus spielt Dichloressigsäure eine wichtige Rolle als Deblockierungsmittel bei der Festphasensynthese von Oligonukleotiden. Um diese Funktion zu erfüllen, ist eine hochreine Dichloressigsäure erforderlich, die weitgehend frei von Chloral (Trichloracetaldehyd) ist.
In der organischen Synthese dient Dichloressigsäure, insbesondere in Form ihrer Ester, als reaktiver Ausgangsstoff. Es wird bei der Herstellung von Glyoxylsäure, Dialkoxy- und Diaroxysäuren sowie Sulfonamiden verwendet und dient somit als entscheidende Zwischenverbindung.
Referenz
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
