Trichloorazijnzuur: eigenschappen, productie en toepassingen

Trichloorazijnzuur, ook bekend als trichloorethaanzuur, is een kleurloze hygroscopische kristallijne vaste stof met de chemische formule Cl3CCOOH. Het is een sterk zuur en een corrosieve substantie die de huid, ogen en andere weefsels kan beschadigen bij contact.
Inhoudsopgave
1. Fysische eigenschappen van trichloorazijnzuur
Trichloorazijnzuur [76-03-9] bestaat als hygroscopische, rhombohedrale kristallen bij standaardtemperatuur en -druk met een scherpe geur. Het heeft een hoge oplosbaarheid in water en verschillende organische oplosmiddelen. Belangrijke fysische eigenschappen zijn:
- Molaire massa: 163,4 g/mol
- Smeltpunt: 59,2 °C
- Kookpunt: 197,6 °C bij 101,3 kPa; ~107 °C onder verminderde druk (2,8 kPa)
- Dichtheid bij 60 °C: 1,63 g/cm³
- Breukindex bij 65 °C: 1,459
- pKa: 0,70
- Dipoolmoment: 3,23 D
2. Chemische eigenschappen van trichloorazijnzuur
Trichloorazijnzuur vertoont een sterke zuurgraad (pKa = 0,7) vanwege de volledige substitutie van methylwaterstoffen met chlooratomen, waardoor het stabieler is dan chloorazijnzuur en dichloorazijnzuur en minder gevoelig is voor substitutiereacties van chlooratomen.
Onder waterige omstandigheden induceren verhoogde temperaturen de ontleding van trichloorazijnzuur in chloroform en koolstofdioxide. Dit proces wordt versneld in de aanwezigheid van organische of anorganische basen, terwijl aniline, resorcinol en actieve kool dienen als katalysatoren in watervrije omstandigheden.
Puur thermische ontleding vindt alleen plaats boven het kookpunt en levert gechloreerde koolwaterstoffen, koolmonoxide, kooldioxide en fosgeen op.
Trichloorazijnzuur vormt zouten met diverse anorganische en organische basen. Deze zouten ontleden bij verhitting in waterige omgevingen, waarbij chloroform vrijkomt.
3. Productie van trichloorazijnzuur
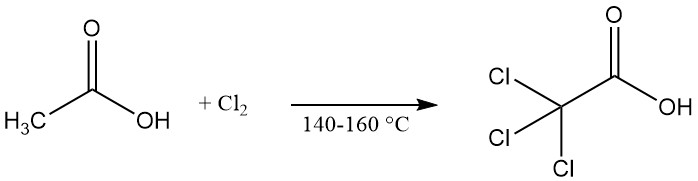
Trichloorazijnzuur wordt commercieel geproduceerd door chlorering van azijnzuur, chloorazijnzuur of de moederloog bij verhoogde temperaturen (140–160 °C). Calciumhypochloriet kan worden gebruikt als katalysator om de reactie te versnellen.
Het gebruik van zware metaalzouten als katalysatoren blijft controversieel. Hoewel voorbeelden zoals ijzer- en koperverbindingen zijn gebruikt, blijven er zorgen bestaan over hun verwijdering door precipitatie met zwavelzuur of fosforzuur.
Alternatieve benaderingen die zijn onderzocht, zijn onder meer het gebruik van 2% fosforzuur of het combineren van katalysatoren met UV-licht. Katalysatorvrije methoden zijn ook ontwikkeld.
Het resulterende ruwe product, dat doorgaans ongeveer 95% trichloorazijnzuur bevat, ondergaat zuivering door smeltkristallisatie. Dit verwijdert effectief onzuiverheden die aanwezig zijn in de moederloog. Verdere verbetering van de zuiverheid kan worden bereikt via centrifugatie of extra herkristallisatiestappen.
Wanneer zwavelzuur wordt gebruikt als katalysator bij hogere reactietemperaturen (tot 180 °C), is zuivering na de productie niet nodig.
4. Toepassingen van trichloorazijnzuur
Vóór de jaren 90 was de primaire toepassing van trichloorazijnzuur de productie van het natriumzout, gebruikt als selectief herbicide en in combinatie met 2,4-D en 2,4,5-T formuleringen voor totale onkruidbestrijding. Vanwege ecotoxicologische zorgen is deze toepassing echter aanzienlijk afgenomen.
Naast herbiciden vindt trichloorazijnzuur diverse toepassingen in verschillende vakgebieden:
- Bij de behandeling van metaaloppervlakken wordt trichloorazijnzuur gebruikt als ets- en beitsmiddel
- Het wordt gebruikt als zwelmiddel en oplosmiddel in de kunststofindustrie.
- In de biochemie, voor de precipitatie van eiwitten, albumine, DNA en RNA
- Hulpmiddel bij textielafwerking
- Het wordt toegevoegd als additief om de hogedrukeigenschappen van smeeroliën te verbeteren.
- Vanwege zijn corrosieve aard wordt trichloorazijnzuur in gecontroleerde omgevingen gebruikt om wratten en eelt te verwijderen en specifieke huidaandoeningen te behandelen.
- Trichloorazijnzuur en zijn esters dienen als waardevolle startmaterialen voor verschillende organische syntheses.
- Het zuur vertoont onderscheidende kleurreacties, waardoor de identificatie van verschillende organische verbindingen in de analytische chemie mogelijk is.
5. Derivaten van trichloorazijnzuur
5.1. Trichlooracetylchloride
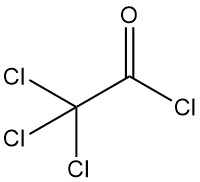
Trichlooracetylchloride [76-02-8] heeft de chemische formule Cl3CCOCl en een molaire massa van 197,9 g/mol, bezit fysische eigenschappen die vergelijkbaar zijn met dichlooracetylchloride:
- Kookpunt: 118 °C bij 101,3 kPa
- Dichtheid bij 20 °C: 1,620 g/cm³
- Breukindex bij 20 °C: 1,4695
Trichlooracetylchloride hydrolyseert gemakkelijk tot trichloorazijnzuur en zoutzuur bij 75–85 °C in water. Het reageert met ammoniumhydroxide of geconcentreerde natriumcarbonaatoplossingen om overeenkomstige zouten te vormen.
Trichlooracetylchloride wordt geproduceerd door verschillende methoden:
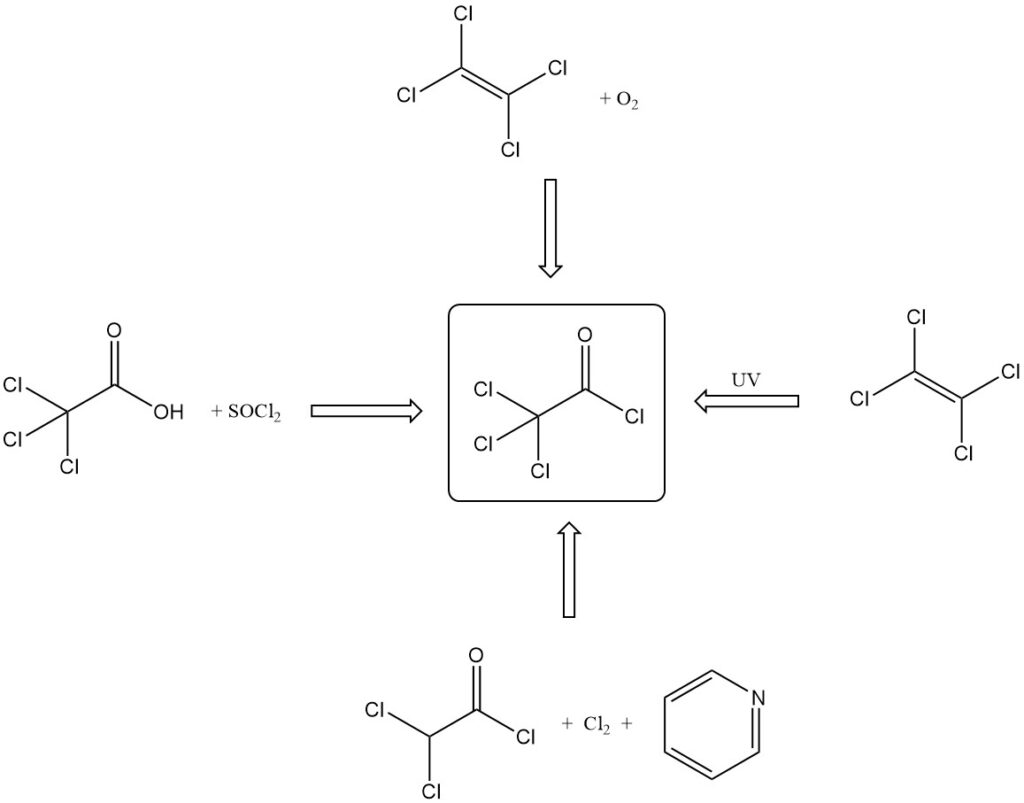
- Door reactie van trichloorazijnzuur met anorganische zuurchloriden (SOCl2, PCl3) of P2O5 en HCl.
- Door oxidatie van tetrachloorethyleen met rokend zwavelzuur, zuurstof of rokend salpeterzuur en zwavelzuur.
- Door fotochemische oxidatie van tetrachloorethyleen met UV-licht, radioactieve bestraling of sensibilisatie met chloor/jodium.
- Door de reactie van dichlooracetylchloride met pyridine en chloor.
Trichlooracetylchloride wordt gebruikt om trichloorazijnzuuresters, anhydriden en pesticiden (bijv. chloorpyrifos) te produceren en als uitgangsmateriaal voor de synthese van trifluorazijnzuur.
5.2. Trichloorazijnzuuresters
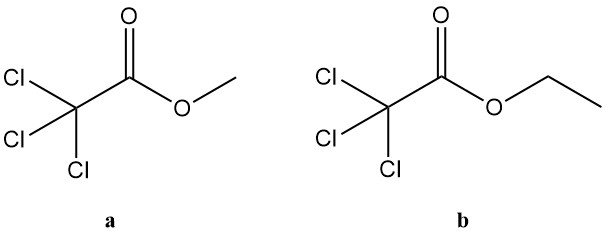
Trichloorazijnzuuresters omvatten een brede groep verbindingen, maar alleen de methyl- en ethylderivaten zijn van groot industrieel belang. Deze twee esters vinden toepassing in verschillende gebieden:
- Oplosmiddelen: Hoewel ze niet hun primaire gebruik zijn, kunnen zowel methyl- als ethyltrichlooracetaat indien nodig als niche-oplosmiddelen fungeren.
- Deze esters dienen als waardevolle startmaterialen voor de synthese van andere verbindingen, met name amiden en polyalcoholesters. Deze derivaten zijn onderzocht op hun potentiële gebruik als weekmakers, met specifieke functionaliteiten of eigenschappen die niet direct beschikbaar zijn in conventionele weekmakers.
- Ethyltrichlooracetaat vindt bredere toepassing als co-katalysator in Ziegler-type polymerisaties.
Ter referentie, hier zijn enkele belangrijke fysieke eigenschappen van de twee industrieel relevante esters:
a. Methyltrichlooracetaat:
- CAS-nummer: 598-99-2
- Formule: Cl3CCOOCH3
- Molaire massa: 177,43 g/mol
- Kookpunt: 153 °C (bij 101,3 kPa)
- Dichtheid: 1,4864 g/cm³ (bij 20 °C)
- Breukindex: 1,4572 (bij 20 °C)
b. Ethyltrichlooracetaat:
- CAS-nummer: 515-84-4
- Formule: Cl3CCOOCH2CH3
- Molar massa: 191,45 g/mol
- Kookpunt: 167,5 °C (bij 101,3 kPa)
- Den siteit: 1,3823 g/cm³ (bij 20 °C)
- Brekingsindex: 1,4505 (bij 20 °C)
5.3. Natriumtrichlooracetaat
Natriumtrichlooracetaat (Cl3CCOONa), het enige industrieel significante zout van trichloorazijnzuur, vertoont verschillende belangrijke eigenschappen:
Fysische eigenschappen:
- Een kleurloze vaste stof ontleedt onder het smeltpunt.
- Zeer oplosbaar in water en methanol, matig oplosbaar in andere polaire oplosmiddelen.
- Oplosbaarheid in water neemt toe met de temperatuur (50% bij 5 °C, 60% bij 20 °C, 70% bij 40 °C).
Chemische eigenschappen:
- Stabiel als het droog is, maar ondergaat hydrolyse in een waterige oplossing, waarbij natriumbicarbonaat en dichloorazijnzuur worden gegenereerd.
- Thermische ontleding bij verhoogde temperaturen (125–170 °C) produceert natriumchloride, trichlooracetylchloride, koolmonoxide en koolstofdioxide.
- Het reageert met olefinen als faseoverdrachtskatalysatoren gebruikt.
Productie:
Natriumtrichlooracetaat wordt industrieel geproduceerd door trichloorazijnzuur te neutraliseren met natriumhydroxide of carbonaat.
Toepassingen:
- Natriumtrichlooracetaat, gecombineerd met reductiemiddelen en metaalzouten, bevordert vinylpolymerisatie.
- Het helpt bij de absorptie en verspreiding van kleurstoffen in polyester- en cellulosevezels.
- In diazopapier dat door hitte wordt ontwikkeld, wordt het gebruikt om base vrij te maken bij verhoogde temperaturen (100–200 °C)
- Het werd eerder gebruikt als herbicide om monocotyledonen te bestrijden, met een halfwaardetijd in de bodem van 1-2 maanden; zorgen over ecotoxiciteit leidden echter tot wijdverbreide verboden in de VS, Canada, EU en Zuid-Amerika.
6. Toxicologie van trichloorazijnzuur en trichlooracetaat
Trichloorazijnzuur brengt verschillende gezondheidsrisico’s met zich mee vanwege de corrosieve aard en het vermogen om eiwitten neer te slaan. Hoewel het niet snel door de huid wordt opgenomen, kan het bij contact aanzienlijke oog- en huidirritatie veroorzaken.
Belangrijkste toxiciteitsgegevens:
- Orale LD50: 3320–5060 mg/kg (ratten)
- Laagste dodelijke dosis (vrouwtjeshonden): 1590 mg/kg
- Inhalatie (4 uur, hoge dosis): Geen significante effecten waargenomen bij dieren
- Acute menselijke blootstelling: huid- en oogverbranding, irritatie, gastro-intestinale effecten
- Chronische gegevens: beperkt, heeft mogelijk invloed op de bovenste luchtwegen
- Voorgestelde TLV-TWA: 1 ppm (7 mg/m³)
Zorgen over de veiligheid van trichloorazijnzuur omvatten:
- Huid- en oogschade: De corrosieve eigenschappen kunnen brandwonden en irritatie veroorzaken.
- Eiwitbinding: verdringt medicijnen van eiwitbindingsplaatsen, wat mogelijk hun effectiviteit verandert.
- Beperkte chronische gegevens: Mogelijke effecten op de lange termijn vereisen nader onderzoek.
Trichlooracetaat heeft een voorlopig getolereerde dagelijkse inname (PTDI) van 0,075 mg/kg lichaamsgewicht. Deze waarde is gebaseerd op een subchronisch onderzoek naar hondenvoeding, waarbij verschillende bijwerkingen werden waargenomen bij doses van ≥ 2000 mg/kg in voedsel.
Er werden bijwerkingen waargenomen, zoals verlies van lichaamsmassa, malaise, weefselschade (tandvlees, mondslijmvlies), veranderingen in witte bloedcellen, abnormale urinebevindingen, lever- en hartletsels, spieratrofie en verminderde spermaproductie.
Het niet-toxische effectniveau was 500 mg/kg in het dieet. In-vitrogegevens suggereren geen mutageen potentieel.
Referentie
- Chloroacetic Acids; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_537.pub3
