Mierenzuur: eigenschappen, reacties, productie en toepassingen
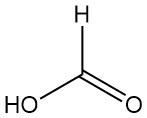
Wat is mierenzuur?
Methaanzuur, beter bekend als mierenzuur, is het eenvoudigste carbonzuur met de formule HCOOH. Het is een kleurloze, bijtende vloeistof met een scherpe geur die volledig mengbaar is met water en veel polaire oplosmiddelen, maar slechts gedeeltelijk mengbaar met koolwaterstoffen.
Mierenzuur ontleent zijn naam aan mieren (Latijn: Formica), waaruit het voor het eerst werd verkregen door droge distillatie. De eerste wetenschappelijke studie over de eigenschappen ervan, “Concerning Some Un-Common Observations and Experiments Made with an Acid Juice to be Found in Ants,” werd al in 1670 gepubliceerd.
Inhoudsopgave
1. Fysische eigenschappen van mierenzuur
Mierenzuur is een kleurloze, heldere, corrosieve vloeistof met een scherpe geur. Het is het sterkste ongesubstitueerde alkylcarbonzuur.
De temperatuurafhankelijkheid van de dichtheid van mierenzuur is weergegeven in Tabel 1.
| Temperatuur, °C | Dichtheid, g/cm3 |
|---|---|
| 0 | 1,244 |
| 10 | 1,232 |
| 15 | 1,226 |
| 20 | 1,220 |
| 25 | 1,214 |
| 30 | 1.207 |
| 40 | 1.195 |
| 50 | 1.182 |
| 60 | 1.169 |
| 70 | 1.156 |
| 80 | 1.143 |
| 90 | 1.130 |
| 100 | 1.117 |
Mierenzuur neemt niet in volume toe wanneer het stolt en heeft de neiging om supercooling te ondergaan.
Tabel 2 toont de dampdrukcurve van zuiver mierenzuur. De damp van mierenzuur wijkt aanzienlijk af van het gedrag van een ideaal gas omdat de moleculen gedeeltelijk dimeriseren in de dampfase. Bij kamertemperatuur en normale druk bestaat 95% van de mierenzuurdamp uit gedimeriseerd mierenzuur.
| Vloeistof | Vast | ||
|---|---|---|---|
| Temperatuur, °C | Druk (kPa) | Temperatuur, °C | Druk (kPa) |
| -5,23 | 1,083 | -5,07 | 0,664 |
| 0,00 | 1,488 | 0,00 | 1,096 |
| 8,25 | 2,392 | 8,25 | 2,392 |
| 12,57 | 3,029 | - | - |
| 20,00 | 4.473 | - | - |
| 29.96 | 7.248 | - | - |
| 39.89 | 11.357 | - | - |
| 49.93 | 17.347 | - | - |
| 59,98 | 25,693 | - | - |
| 70,04 | 37,413 | - | - |
| 79,93 | 52,747 | - | - |
| 100,68 | 101,667 | - | - |
| 110,62 | 135,680 | - | - |
De enthalpie van de gasfase-dimerisatie is -63,8 kJ/mol.
De ringvormige dimere structuur bestaat zowel in de dampfase als in oplossing. Vloeibaar mierenzuur bestaat uit lange ketens van moleculen die met elkaar verbonden zijn door waterstofbruggen. Vast mierenzuur kan ook worden geïsoleerd in twee polymorfe vormen (α en β).
Mierenzuur en water vormen een maximaal kokend azeotroop mengsel waarvan het kookpunt 107,6 °C is bij 101,3 kPa; het bestaat uit 77,6 gew.% mierenzuur en 22,4 gew.% water.
De variatie van dynamische viscositeit met temperatuur wordt weergegeven in Tabel 3. De dynamische viscositeit van mierenzuur-watermengsels neemt ongeveer lineair af naarmate het watergehalte van mierenzuur toeneemt. De thermische geleidbaarheid van mierenzuur is aanzienlijk hoger dan die van vergelijkbare vloeistoffen vanwege de uitgesproken polariteit.
| Temperatuur, °C | Viscositeit, mPa.s |
|---|---|
| 10 | 2,262 |
| 20 | 1,804 |
| 30 | 1,465 |
| 40 | 1,224 |
| 50 | 1,025 |
De fysische eigenschappen van mierenzuur staan in de onderstaande tabel:
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [64-18-6] |
| Formule | HCOOH |
| Moleculair gewicht | 46,03 g/mol |
| Smeltpunt | 8,3 °C |
| Kookpunt | 100,8 °C |
| pKa | 3,74 |
| Smeltwarmte | 276 J/g |
| Verdampingswarmte (bij kookpunt) | 483 J/g |
| Diëlektrische constante |
Vloeistof (bij 20 °C): 57,9 Vaste stof (bij -10,1 °C): 11,7 |
| Breukindex | 1,37140 |
| Oppervlaktespanning σ |
(bij 20°C): 37,67×10-3 N/m (bij 40 °C): 35,48×10-3 N/m (bij 60 °C): 33,28×10-3 N/m (bij 80 °C): 31,09×10-3 N/m |
| Warmte van vorming |
Vloeistof (bij 25 °C): -425,0 kJ/mol Damp (bij 25 °C, monomeer): -378,57 kJ/mol (bij 25 °C, dimeer): -820,94 kJ/mol |
| Verbrandingswarmte | Vloeistof (bij 25 °C): -254,8 kJ/mol |
| Entropie |
Vloeistof (bij 25 °C): 129,0 J K-1 mol-1 Damp (bij 25 °C, monomeer): 248,88 J K-1 mol-1 (bij 25 °C, dimeer): 332,67 J K-1 mol-1 |
| Neutralisatiewarmte | 56,9 kJ/mol |
2. Reacties van mierenzuur
Hoewel mierenzuur relatief stabiel is bij kamertemperatuur, is het in feite een thermisch onstabiele verbinding die twee belangrijke alternatieve routes voor ontleding heeft: dehydratatie- en dehydrogeneringsreacties.
HCOOH → CO + H2O
HCOOH → CO2 + H2
De dehydratatiereactie, die overheerst in de vloeibare fase, wordt begunstigd in de aanwezigheid van oxidekatalysatoren of sterke zuren, terwijl de dehydrogeneringsreactie wordt bevorderd door metaalkatalysatoren.
Mierenzuur wordt bijzonder onstabiel in concentraties van bijna 100%, en hiermee moet rekening worden gehouden bij het opslaan van zeer geconcentreerd mierenzuur. Over het algemeen is de ontleding van mierenzuur een functie van zowel de zuurconcentratie als de temperatuur.
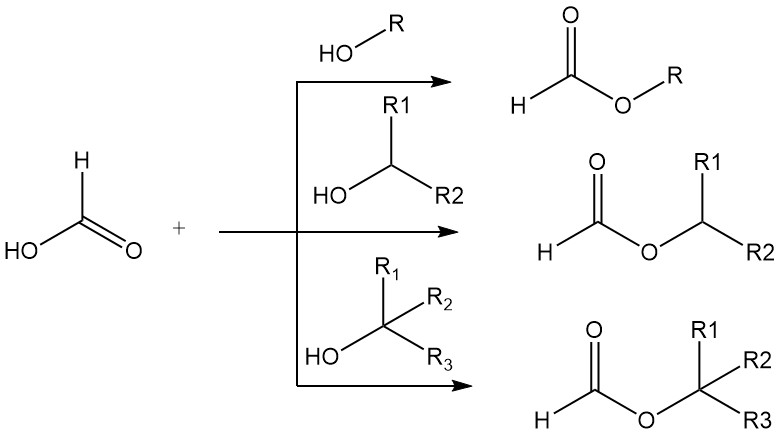
Mierenzuur vertoont veel van de typische chemische eigenschappen van de alifatische carbonzuren, bijvoorbeeld verestering en amidering, maar zoals gebruikelijk is voor het eerste lid van een homologe reeks, zijn er opvallende verschillen in de eigenschappen van mierenzuur en zijn hogere homologen.
Mierenzuur vormt esters met primaire, secundaire en tertiaire alcoholen. De hoge zuurgraad van mierenzuur maakt het gebruik van minerale zuurkatalysatoren overbodig bij eenvoudige veresteringen. Primaire en secundaire alcoholen worden in zuiver mierenzuur 15.000–20.000 keer sneller veresterd dan in zuiver azijnzuur.
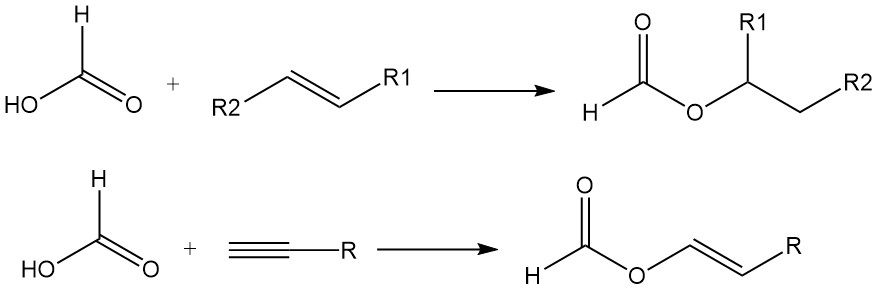
Mierenzuur voegt zich ook toe aan de dubbele bindingen van olefinen om esters te vormen. Acetylenen reageren met mierenzuur in de dampfase om vinylformiaten te produceren.
Mierenzuur reageert met de meeste aminen om formylaminoverbindingen te vormen. Bijvoorbeeld, bij de productie van formamiden wordt mierenzuur gebruikt om formylering door dehydratie te bereiken. Bij bepaalde diamines vindt imidazoolvorming plaats. Beide reactietypen hebben synthetisch nut.
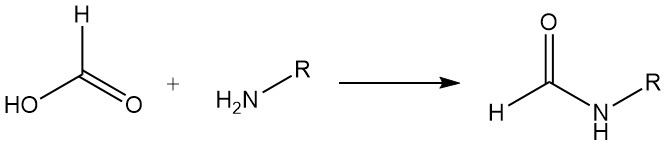
Mierenzuur en tertiaire organische basen vormen additieverbindingen (3:1 en 2:1 verhoudingen van mierenzuur tot base). Additieverbindingen van mierenzuur en trimethylamine of triethylamine kunnen worden gebruikt als vloeibare reductiemiddelen in veel selectieve reducties. De reductie van zwaveldioxide tot zwavel is ongeveer kwantitatief.
Mierenzuur lost ijzer en zink op en corrodeert de meeste soorten staal. De reactie met ijzer levert Fe(II)formiaat en waterstofgas op. Van de gangbare metalen en legeringen vertonen aluminium, koper en nikkel enige weerstand.
2 HCOOH + Fe → Fe(OOCH)2 + H2
Mierenzuur is het meest corrosief in relatief verdunde oplossingen in water. Voor zacht staal wordt de hoogste corrosiesnelheid waargenomen rond de 20% oplossingsconcentratie, waarbij de geleidbaarheid van de oplossing ook het hoogst is. Sommige corrosie-inhibitoren kunnen een zeer goede bescherming bieden.
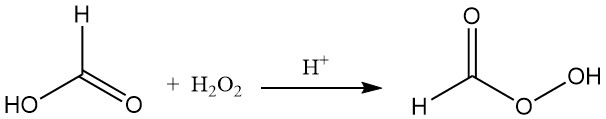
Mierenzuur reageert met waterstofperoxide in aanwezigheid van een zure katalysator om onstabiel permeïnezuur (HCOOOH) te vormen.
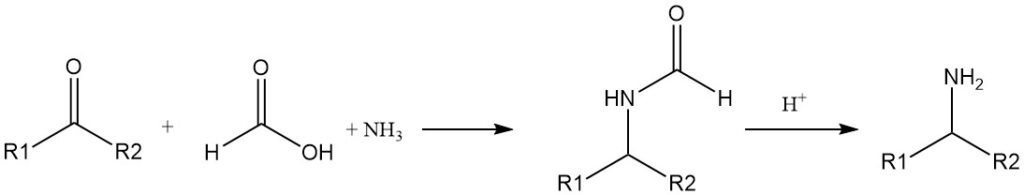
Het formylwaterstofatoom vertoont een aldehydisch karakter en mierenzuur reduceert sommige zouten en oxiden tot metalen. Het kan ook worden gebruikt als reductiemiddel (hydridedonor) in veel organische reacties, ter vervanging van H2.
De reductie van imines (Schiff-basen) door mierenzuur is al lang bekend. Primaire aminen kunnen worden bereid uit ketonen, ammoniak en mierenzuur (Leuckart-reactie).
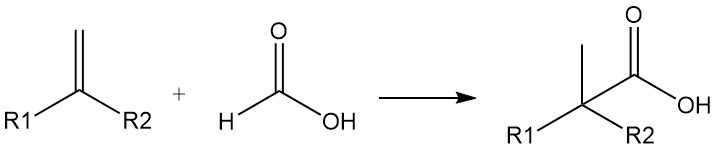
Mierenzuur kan ook worden gebruikt als bron van koolmonoxide. Sterk vertakte carbonzuren kunnen worden bereid uit olefinen en mierenzuur in aanwezigheid van zwavelzuur of waterstoffluoride (Koch-carbonzuursynthese). De reactie verloopt via toevoeging van CO.
3. Productie van mierenzuur
Mierenzuur wordt tegenwoordig voornamelijk via twee routes geproduceerd: de hydrolyse van methylformiaat en de bereiding van vrij mierenzuur uit formiaatzouten.
De op methylformiaat gebaseerde procesroute is momenteel dominant. Ongeveer 90% van de geïnstalleerde capaciteit is gebaseerd op dit proces. De economische nadelen van de eerder toegepaste methoden leidden tot de ontwikkeling van een proces dat specifiek is gericht op de productie van mierenzuur zonder ongewenste bijproducten.
In de jaren 70 werd de hydrolyse van methylformiaat tot methanol en mierenzuur door verschillende bedrijven commercieel ontwikkeld tot een economisch haalbare methode.
Dit proces omvat carbonylering van methanol en daaropvolgende hydrolyse van het geproduceerde methylformiaat. De methanol die uit dit proces ontstaat, wordt teruggevoerd naar de eerste fase.
Mierenzuurfabrieken op basis van dit proces werden in 1981 opgestart bij BASF (Duitsland) en in 1982 bij Kemira (Finland). Recentere grootschalige producenten die deze route gebruiken, zijn de Chinese bedrijven Feicheng Acid Chemicals en Luxi Chemical Group.
De andere huidige productiemethode omvat de vorming van vrij zuur uit zijn zouten. Voor dit doel worden voornamelijk natriumformiaat en calciumformiaat gebruikt. Acidolyse wordt normaal gesproken uitgevoerd met zwavelzuur of fosforzuur. Sulfaat- of fosfaatzouten worden geproduceerd als bijproducten.
3.1. Productie van mierenzuur door hydrolyse van methylformiaat
De eenvoudigste theoretisch mogelijke methode om mierenzuur te produceren, is de reactie van koolmonoxide met water. Onder 150 °C is de reactie erg traag en hoewel het evenwicht bij hogere temperaturen snel wordt bereikt, moet de druk worden verhoogd om acceptabele mierenzuurconcentraties te verkrijgen.
CO + H2O → HCOOH
De thermodynamische hindernissen kunnen worden omzeild als methylformiaat als tussenproduct wordt gevormd.
De vloeibare-fase carbonylering van methanol tot methylformiaat in aanwezigheid van een basische katalysator zoals natrium- of kaliummethoxide (NaOCH3 of KOCH3) en verdere hydrolyse tot mierenzuur worden al sinds het begin van de jaren 80 industrieel toegepast.
Kaliummethoxide is beter oplosbaar in methylformiaat dan natriummethoxide en heeft dienovereenkomstig een hogere reactiesnelheid. De methanol die in de tweede fase vrijkomt, wordt teruggevoerd naar de eerste fase.
CH3OH + CO → HCOOCH3
HCOOCH3 + H2O → HCOOH + CH3OH
Het methylformiaatproces wordt bijvoorbeeld gebruikt door Eastman Chemical Company, BASF, Kemira, Luxi Chemical Group en Feicheng Acid Chemicals.
De reactieomstandigheden voor de eerste carbonyleringsstap zijn in beide gevallen grotendeels vergelijkbaar, maar ze verschillen in hun benadering van de hydrolysefase.
3.1.1. Carbonylering
Volgens de gepubliceerde gegevens lijken de typische reactieomstandigheden 80 °C, 4,5 MPa druk en 2,5 gew.% natriummethoxidekatalysator te zijn. Onder deze omstandigheden is de methanolconversie ongeveer 30% en de conversie van koolmonoxide ongeveer 95%.
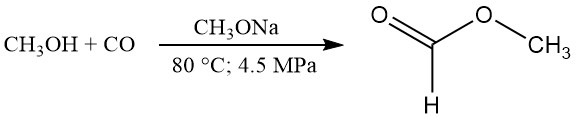
Bijna kwantitatieve omzetting van methanol naar methylformiaat kan worden bereikt door het recyclen van de niet-omgezette methanol. De carbonyleringssnelheid kan worden verhoogd door de temperatuur, de CO-partiële druk, de katalysatorconcentratie of de interface tussen de gas- en vloeistoffasen te verhogen.
Als nevenreactie produceert de katalysator formiaatzouten (Na en K). Formiaatzouten zijn minder oplosbaar in methylformiaat dan in methanol. Daarom moet het risico op afzetting en verstopping door neerslag van de katalysator worden beheerd.
Het koolmonoxide mag geen significante hoeveelheid koolstofdioxide bevatten; anders wordt het katalytisch inactieve carbonaat neergeslagen.
Het niet-ontlede alkalimetaalmethoxide in het methylformiaat moet worden geneutraliseerd om de omgekeerde reactie te voorkomen, dat wil zeggen de ontleding van het methylformiaat in methanol en CO bij verhitting.
3.1.2. Hydrolyse
Het hydrolyse-evenwicht van methylformiaat is relatief ongunstig, maar is afhankelijk van de waterconcentratie op een manier die het gebruik van een hoge stoichiometrische overmaat aan water begunstigt, met als gevolg problemen bij het vinden van een energie-efficiënte methode om het overtollige water te verwijderen.
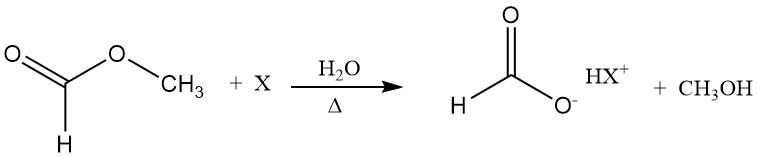
Mierenzuur fungeert als hydrolysekatalysator (autokatalyse). Een manier om de ongunstige positie van het hydrolyse-evenwicht te overwinnen, is door methylformiaat te hydrolyseren in aanwezigheid van een additief, bijvoorbeeld een tertiair amine.
De base vormt een zoutachtig adduct met mierenzuur; daarom neemt de concentratie van vrij mierenzuur af en verschuift het hydrolyse-evenwicht in de richting van de producten. In een volgende stap kan mierenzuur uit de base worden gedestilleerd zonder ontleding.
3.2. Productie van mierenzuur uit formiaten
De reactie van formiaatzouten met minerale zuren (meestal zwavelzuur) is het oudste commerciële proces voor de productie van mierenzuur en is nog steeds van industrieel belang. Perstorp is de grootste producent van mierenzuur door de acidolyse van formiaatzouten.
Natriumformiaat, kaliumformiaat en calciumformiaat zijn industrieel verkrijgbaar uit de productie van meerwaardige alcoholen.
De acidolyse van formiaatzouten is technisch gezien eenvoudig, maar de onvermijdelijke productie van coproductzouten zoals natrium- en calciumsulfaat is een duidelijk nadeel van deze route.
2 HCOONa + H2SO4 → 2 HCOOH + Na2SO4
(HCOO)2Ca + H2SO4 → 2 HCOOH + CaSO4
Sommige Chinese patenten beschrijven de bereiding van mierenzuur uit CO en alkalimetaal- of aardalkalimetaalhydroxiden, gevolgd door verzuring met fosforzuur. Koolmonoxide kan afkomstig zijn van de productie van fosfor. De resulterende fosfaatzouten worden gebruikt als meststoffen.
3.2.1. Formiaten als polyolbijproducten
Formiaatzouten komen voor als bijproducten bij de productie van pentaerythritol, trimethylolpropaan en 2,2-dimethyl-1,3-propaandiol (neopentylglycol).
Bijvoorbeeld, pentaerythritol wordt geproduceerd door de reactie van formaldehyde met aceetaldehyde in een waterig alkalisch medium. Het intermediaire aldehyde reageert verder met formaldehyde door de Cannizzaro-reactie om pentaerythritol en mierenzuur te produceren.
Het gevormde mierenzuur reageert onmiddellijk met de aanwezige alkali, waardoor het overeenkomstige formiaatzout als het uiteindelijke coproduct ontstaat.
3 HCHO + CH3CHO → (HOCH2)3CCHO
(HOCH2)3CCHO + HCHO + H2O → C(CH2OH)4 + HCOOH
HCOOH + NaOH → HCOONa + H2O
2 HCOOH + Ca(OH)2 → (HCOO)2Ca + 2 H2O
Ook wordt de overtollige alkali in het proces geneutraliseerd door mierenzuur. Het pentaerythritolproduct wordt geïsoleerd door stapsgewijze concentratie en fractionele kristallisatie.
3.2.2. Formaten uit koolmonoxide
Formaatzouten kunnen worden gemaakt door een direct proces gebaseerd op de reactie van CO met een base zoals NaOH en KOH.
NaOH (aq) + CO → HCOONa (aq)
KOH (aq) + CO → HCOOK (aq)
3.3. Productie van mierenzuur uit kooldioxide
Hydrogenering van kooldioxide in alcohol produceert mierenzuur in een bijna watervrije omgeving, wat een voordeel is bij productwinning. Oplosbare Ru-complexen zijn de voorkeurskatalysatoren en een complexvormend middel wordt gebruikt om de reactie thermodynamisch gunstig te maken.
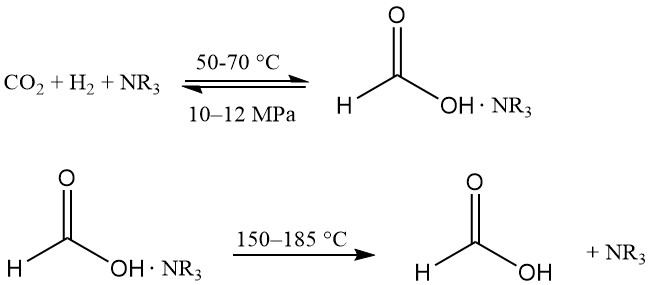
Deze technologie werd voor het eerst geïntroduceerd door BP Chemicals in de jaren 80 en is ontwikkeld door BASF.
De reactie vindt plaats in een mengsel van tertiair amine (meestal n-trihexylamine) en alcohol (bijv. methanol) bij 50–70 °C en 10–12 MPa. Er wordt wat water toegevoegd om de fasescheiding te vergemakkelijken. Het mierenzuur-aminecomplex wordt thermisch gedissocieerd bij 150–185 °C.
Het proces moet de dure overgangsmetaalcomplexkatalysator actief houden, maar voorkomen dat er zelfs sporen van in actieve vorm aanwezig zijn bij destillatie van mierenzuur, omdat het de ontleding van het zuur kan katalyseren. Mogelijke katalysatorresten kunnen reversibel worden geïnactiveerd met CO.
Er zijn verschillende elektrochemische processen in ontwikkeling voor de productie van mierenzuur of formiaatzout uit koolstofdioxide. Het proces van CO2-elektrolyse is in feite het omgekeerd laten draaien van een brandstofcel. In een elektrolyser wordt CO2 gereduceerd bij de kathode, terwijl de zuurstofontwikkelingsreactie plaatsvindt bij de anode.
De afgelopen jaren hebben grote verbeteringen in katalysatorsystemen en elektroden geresulteerd in veel hogere opbrengsten, Faradische efficiëntie en brandstofefficiëntie.
3.4. Productie van mierenzuur uit biomassa
Vrijwel elke plantenbiomassa kan worden geoxideerd tot mierenzuur, CO2 en water met een hoge selectiviteit voor mierenzuur door polyoxometallaten te gebruiken als zuurstofafgevende katalysatoren.
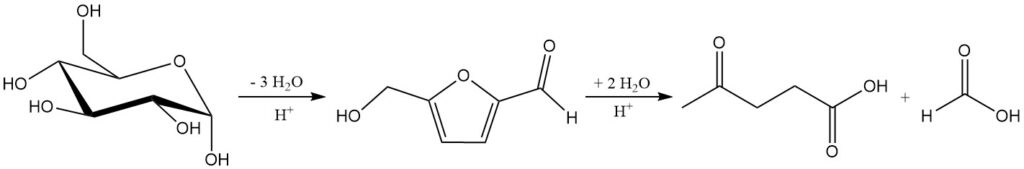
Minerale zuurhydrolyse van cellulose en hemicellulose rond 200 °C produceert een mengsel van levulinezuur, mierenzuur en furfural. De totale reactie van C6-suikers tot levulinezuur en mierenzuur wordt weergegeven in Schema 1.
3.5. Terugwinning van mierenzuur
3.5.1. Azeotrope destillatie
Mengsels van mierenzuur en water kunnen niet worden geconcentreerd tot meer dan de azeotrope samenstelling door eenvoudige destillatie. De concentratie van mierenzuur in het azeotrope mengsel neemt toe als de destillatie onder druk wordt uitgevoerd, maar het hogere kookpunt bij hoge druk verhoogt ook de ontledingssnelheid van mierenzuur.
Een combinatie van destillatie onder druk gevolgd door vacuümdestillatie kan praktisch alle gewenste concentraties opleveren.
3.5.2. Extractie
Er zijn verschillende technologieën ontwikkeld waarbij reactieve extractie wordt gebruikt om mierenzuur over te brengen naar een afzonderlijke organische fase of mierenzuur wordt gebonden aan een zwak complexerend middel in de waterfase. In beide gevallen kan de azeotroop worden vermeden.
Wanneer fasescheiding is betrokken, is het mogelijk om de totale hoeveelheid water die moet worden verdampt te verminderen. Meestal worden secundaire amiden of tertiaire aminen gebruikt.
Bij extractieve destillatie wordt mierenzuur geëxtraheerd in een destillatiekolom door middel van een basisch extractiemiddel dat tegenstrooms wordt ingebracht en in de bodem van de kolom wordt gevoerd. Als dit mengsel in een kolom stroomafwaarts wordt verhit, wordt het mierenzuur vrijgemaakt uit het zoutachtige adduct en gedestilleerd.
4. Toepassingen van mierenzuur
Vanwege de zuurgraad, de aldehyde-aard en de reducerende eigenschappen wordt mierenzuur op verschillende gebieden gebruikt. In tegenstelling tot minerale zuren verdampt mierenzuur zonder residu achter te laten. In Europa wordt het meeste mierenzuur gebruikt in de veevoederindustrie en als hulpmiddel bij het inkuilen.
4.1. Toepassingen van mierenzuur bij het behoud van biomassa
4.1.1. Kuilvoer
De term kuilvoer verwijst traditioneel naar het inkuilen van voedergewassen (voornamelijk grassen) voor het voeren van runderen op boerderijen. De consumptie is afhankelijk van het klimaat; op mierenzuur gebaseerde inkuiling is vooral geschikt voor natte omstandigheden. Noord-Europa is het belangrijkste consumptiegebied.
Inkuiling is gebaseerd op fermentatie onder anaërobe omstandigheden, waarbij melkzuur geproduceerd door melkzuurbacteriën de kuil conserveert. Melkzuur verlaagt de pH en voorkomt zo ongewenste microbiële groei.
De toevoeging van mierenzuur resulteert in een snelle initiële daling van de pH, wat de groei van melkzuurbacteriën bevordert en de groei van bacteriën onderdrukt die ongewenste verbindingen produceren, zoals boterzuur. Wanneer de pH-daling wordt versterkt met mierenzuur, wordt spontane fermentatie beperkt.
Voordelen zijn onder meer meer restsuikers en eiwitten. Beperking van fermentatie heeft naar verluidt een positief effect op de vrijwillige inname bij het voeren van melkkoeien en verbetert zo de melkproductie.
Voedergewassen zoals gras, maïs, klaver en alfalfa worden gesneden, gehakt en vervolgens gefermenteerd in silo’s of balen die zijn afgedekt met luchtdichte folie. Mierenzuur is uitstekend geschikt voor het inkuilen van moeilijk in te kuilen materialen, met name natte of suikerarme voedergewassen, die ook een hoge buffercapaciteit kunnen hebben.
Mierenzuur wordt ook gebruikt om fermentatie te beperken bij het inkuilen van gekneusd graan met een hoog vochtgehalte.
Bijproducten van de voedingsmiddelen- en drankenindustrie, zoals gebruikte brij van brouwerijen, kunnen worden geconserveerd met mierenzuuroplossingen om diervoeder met een lange houdbaarheid te leveren.
Mierenzuur wordt gebruikt in verschillende formuleringen, soms in mengsels met andere organische zuren met een korte keten, zoals propionzuur, en wordt vaak gebufferd met een formiaatzout voor veilige verwerking en verminderde corrosie.
4.1.2. Dierlijke biomassa
Dierlijke biomassa kan ook worden geconserveerd met mierenzuur. Het grootste gebruik is bij de verwerking van bijproducten uit de visindustrie om vissilage te produceren. De juiste behandeling van visafval is vaak vereist door milieuwetten en de productie van vissilage kan een economisch haalbare oplossing zijn.
Vissilage is een vloeibaar, eiwitrijk product dat wordt geproduceerd door de pH van gemalen visdelen te verlagen met een zuur conserveermiddel. Onder deze omstandigheden produceren de enzymen uit visresten het uiteindelijke, lang houdbare product in een paar dagen.
Mierenzuur maakt ook efficiënte scheiding van visolie mogelijk tijdens het inkuilproces. Het zuur fungeert ook als verwerkingshulpmiddel door de vorming van microbiële gassen (“koken”) te verminderen. Vissilage kan worden gebruikt als vis- en varkensvoer of als grondstof voor vismeel en oliën.
Mierenzuur is het voorkeurszuur in deze toepassing, meestal gecombineerd met een geschikte antioxidant. De toepassing is een standaardmethode in grote zalmproducerende landen, zoals Noorwegen, en zal naar verwachting steeds belangrijker worden naarmate de aquacultuur toeneemt, vooral in Oost- en Zuidoost-Azië.
Slachtafval kan op dezelfde manier worden geconserveerd als visafval met zuren, meestal mengsels van mierenzuur en melkzuur. De producten zijn geschikt voor pelsdieren en, met beperkingen, voor dierenvoer.
4.2. Toepassingen van mierenzuur in de leerindustrie
Een van de grootste gebruikers van mierenzuur wereldwijd is de leerlooierij. Nu de leerlooierij is verhuisd naar landen met lagere kosten, zijn de groeicijfers in Azië erg hoog, wat de daling in Europa en Noord-Amerika compenseert.
China is de grootste producent van leer en is goed voor ongeveer 30% van de wereldproductie.
Voorbehandeling van huiden laat ze in een licht alkalische toestand achter, maar looien vereist zure omstandigheden. Daarom worden de huiden behandeld met zuur (meestal zwavelzuur en mierenzuur) voordat ze worden gelooid in een proces dat beitsen wordt genoemd.
Zonder deze conditionering zouden de looimiddelen snel aan het oppervlak van de huid worden gefixeerd, terwijl de binnenste laag ruw zou blijven.
Zwavelzuur verlaagt de pH van de vloeistof, terwijl mierenzuur snel en homogeen door de collageenvezels kan dringen. Het zorgt ervoor dat het looimiddel (meestal basisch chroomsulfaat) de gehele dikte van de huid zal doordringen.
Bij het verven van leer wordt mierenzuur gebruikt als egalisatiemiddel om de kleurstof van het ene gebied van het leer naar het andere te verplaatsen, wat resulteert in een gelijkmatigere en gladdere kleurstofverdeling.
4.3. Toepassingen van mierenzuur in textiel
In de textielindustrie wordt mierenzuur gebruikt als pH-regulerend middel bij het verven van wol, nylon en andere natuurlijke en synthetische vezels met zuur- en chroomkleurstoffen. Daarnaast wordt mierenzuur gebruikt om alkalische oplossingen te neutraliseren en het spoelen tijdens het wassen te vergemakkelijken.
Verbetering van de levensstandaard en verhoogde vezelproductie, met name voor exportmarkten, zullen naar verwachting de vraag naar mierenzuur bij het verven en afwerken van textiel in Azië doen toenemen.
4.4. Toepassingen van mierenzuur als toevoegingsmiddelen voor veevoer
Organische zuren en zouten hebben een lange geschiedenis in de veevoerindustrie, die ze vaak gebruikt als conserveermiddelen en voor het verzuren van biggendiëten. Sinds 2006, toen de EU antibioticagroeibevorderaars (AGP’s) verbood, is het gebruik van organische zuren in veevoer toegenomen.
Mierenzuur heeft een sterk verzurend effect, maar ook antimicrobiële effecten, die worden gebruikt om veevoer en drinkwater te beschermen tegen bacteriële besmetting. Mierenzuur is zeer effectief tegen Salmonella, Escherichia coli en Campylobacter bij pH 4,0.
Het werkt positief op de darmflora van dieren en kan zowel de schijnbare verteerbaarheid van energie en eiwitten, als de absorptie en retentie van sommige mineralen verbeteren. Het lijkt de groeiprestaties van gespeende biggen en mestvarkens te verbeteren bij lagere doseringen dan andere organische zuren en zouten.
In de pluimveesector wordt mierenzuur al lang gebruikt om de groei van pathogenen in veevoer en voedermiddelen te voorkomen. Mengsels van mierenzuur met propionzuur, melkzuur of middellangeketenvetzuren hebben bredere antimicrobiële effecten dan mierenzuur alleen.
4.5. Toepassingen van mierenzuur in farmaceutische producten en voedseladditieven
Farmaceutische producten en voedselchemicaliën worden geschat als de grootste sector van mierenzuurgebruik in Azië (voornamelijk in China).
Mierenzuur wordt gebruikt als een synthetisch tussenproduct voor verschillende farmaceutische producten en voedselchemicaliën, waaronder synthetische insuline (zuivering van recombinante insuline), cafeïne, aspartaam en vitamine B1. Het wordt ook veel gebruikt voor pH-aanpassing tijdens de productie van verschillende chemicaliën.
Andere toepassingen in voedsel zijn onder meer Salmonella-decontaminatie en gebruik als conserveermiddel (E236, toegestaan in de VS, maar niet in de EU, Australië en Nieuw-Zeeland) en als smaakstof.
Het gebruik van mierenzuur bij het conserveren van voedsel omvat het begassen van fruit zoals appels en kersen om bederf na de oogst te verminderen. Mierenzuur is vooral effectief bij het vernietigen van schimmelsporen op oppervlakken en containers waarin fruit wordt bewaard.
Bij sommige toepassingen voor het bewaren van voedsel wordt mierenzuur gemengd met melkzuur en/of propionzuur. Het mengsel is minimaal corrosief, maar door de lage pH-waarde helpt het schadelijke micro-organismen te vernietigen en voorkomt het hun voortplanting, waardoor de houdbaarheid van het product wordt verlengd.
4.6. Andere toepassingen
4.6.1. Rubbercoagulatie
Mierenzuur is de voorkeurskeuze voor het coaguleren van latex, een suspensie van microscopisch kleine natuurlijke rubberdeeltjes (polyisopreen) in een waterig medium. De oppervlakken van de latexdeeltjes zijn geladen, waardoor er afstoting tussen hen ontstaat, waardoor coagulatie wordt voorkomen.
Tijdens het coagulatieproces neutraliseert mierenzuur deze ladingen, waardoor de afstoting wordt geëlimineerd. Het proces resulteert in een consistent, hoogwaardig natuurlijk rubberproduct. Het gebruik van sterkere zuren zorgt ervoor dat de pH-waarde te snel en inhomogeen daalt. Hierdoor stolt het latex ongelijkmatig, wat gevolgen kan hebben voor de mechanische eigenschappen.
Zwakkere zuren, zoals azijnzuur, zijn minder efficiënt dan mierenzuur en resulteren in een veel hoger zuurverbruik.
4.6.2. Gasontzwaveling
Mierenzuur wordt gebruikt als ontzwavelingskatalysator bij rookgasontzwaveling voor kolengestookte elektriciteitscentrales. Zwavel, waarvan het gehalte in kolen wel 5% kan bedragen, komt vrij als zwaveldioxide in het stookproces.
Het opvangen van zwaveldioxide door het rookgas door een waterige kalksteenslurry te leiden, resulteert in gips (calciumsulfaat). Het toevoegen van mierenzuur aan de ontzwavelingscyclus verhoogt de efficiëntie van de zwavelafscheiding.
4.6.3. Verzuringsmiddelen voor putten
Mierenzuur wordt gebruikt bij de stimulatie van hogetemperatuurputten in olie- en gasvelden wanneer de conventionele zoutzuur (HCl)-systemen niet adequaat kunnen worden geremd.
Verzuring van putten wordt bereikt door zuur in de put te pompen om kalksteen, dolomiet en calcietcement op te lossen tussen de sedimentkorrels van de reservoirgesteenten.
Mierenzuur heeft het voordeel van een goede remming tegen pijpcorrosie bij temperaturen tot wel 200 °C (mogelijk veroorzaakt door een beschermende laag van ontledingsproducten).
Gemengd HCl-mierenzuur kan nog meer voordelen bieden. Mierenzuur dissocieert niet in aanwezigheid van HCl, dus er is geen reactie met het carbonaat totdat de HCl vrijwel is opgebruikt. HCl/mierenzuurmengsels kunnen dus een grotere penetratie bereiken.
4.6.4. Mierenzuur als bron van waterstof en koolmonoxide
Onder hydrolyseomstandigheden kan het formiaat-ion een bicarbonaat-ion en waterstof vormen.
HCO2– + H2O → HCO3– + H2
Zowel palladium als houtskool blijken actief te zijn als katalysatoren.
De dehydrogeneringsreactie wordt bevorderd door metaalkatalysatoren.
HCOOH → CO2 + H2
Er is een groeiende interesse in waterstofgeneratie op basis van mierenzuur of kaliumformiaat in brandstofcellen. Lange bedrijfstijden en onmiddellijk opladen zonder afhankelijkheid van het stopcontact zijn de voordelen bij toepassing in draagbare apparaten.
De ontleding van mierenzuur in aanwezigheid van sterke zuren zoals zwavelzuur is een schone bron van CO voor op koolmonoxide gebaseerde chemie.
Mierenzuur of de zouten ervan kunnen worden gebruikt als waterstofbron in chemische reacties zonder de vorming van H2 als tussenproduct (Leuckart-reactiemechanisme). De reactie, bekend als transferhydrogenering, is selectief en wordt gekatalyseerd door veel metalen, zelfs zinkpoeder.
Wanneer chirale katalysatorcomplexen worden gebruikt, kan mierenzuur dienen als waterstofbron in asymmetrische hydrogenering, een veelvoorkomende reactiestap in de synthese van veel fijne chemicaliën en farmaceutische producten.
4.6.5. Reinigingsmiddelen
Mierenzuur heeft enige toepassing als actief ingrediënt in commerciële reinigingsproducten zoals ontkalkers, roestverwijderaars, allesreinigers en ontvetters en institutionele wasproducten. Bij ontkalken vormt zich calciumzout wanneer calciumcarbonaat wordt opgelost door een zuur.
Hoe gemakkelijker dit zout oplosbaar is, hoe lager het risico op zoutafzettingen die de effectiviteit van het zuur verminderen. In badkamerreinigers wordt beweerd dat het de eigenschappen van een efficiënt ontkalkingsmiddel combineert met die van een biologisch afbreekbaar biocide.
4.6.6. Oplosmiddelgebruik
Mierenzuur kan worden gebruikt om polyamiden (bijv. nylon 66 en nylon 46) of zijde op te lossen om vezels en membranen te bereiden. Het is ook een nuttig bestanddeel in reinigingsoplossingen voor halfgeleiders.
5. Toxicologie van mierenzuur
Mierenzuur vertoont een reeks toxische effecten, afhankelijk van de blootstellingsroute (inademing, inname of huidcontact) en concentratie.
Acute toxiciteit:
- Huid en slijmvliezen: Mierenzuur is corrosief en kan necrose (weefselsterfte) veroorzaken bij contact met de huid en irritatie/corrosie van slijmvliezen op het punt van binnendringing (ogen, mond, neusholtes).
- Inname: Methanolmetabolisme kan toxische niveaus van mierenzuur genereren, wat leidt tot metabole acidose. Orale inname van mierenzuuroplossingen kan ernstige irritatie en corrosie van het maag-darmkanaal veroorzaken.
- Inademing: Inademing van mierenzuurdampen irriteert het ademhalingsstelsel, waarbij de ernst toeneemt met de concentratie. Hoge concentraties kunnen dodelijk zijn.
- Dermale absorptie: Mierenzuur kan gemakkelijk door de huid worden opgenomen, wat leidt tot systemische effecten.
De LD50 na orale toediening is naar verluidt 730 mg/kg bij ratten.
Bij ratten is de LC50 7,85 mg/l na 4 uur inademing van de damp. De overheersende symptomen van inhalatie zijn irritatie van de ogen, irritatie en corrosie van de neusslijmvliezen en hoornvliesvertroebeling.
Bij konijnen leidt intraveneuze toediening van gebufferd mierenzuur in het bereik van 0,46–1,25 g per kilogram lichaamsgewicht tot CNS-depressie; hogere doseringen veroorzaken convulsies. Subcutaan toegediende doses van 0,8 g/kg bij honden en meer dan 0,4 g/kg bij katten leiden tot wankelen, terwijl een dosering van 0,4 g/kg leidt tot slaperigheid bij katten.
Bij honden resulteren dodelijke doses die intraveneus worden toegediend in tonische en clonische convulsies.
Chronische blootstelling aan mierenzuur in lage concentraties in dierstudies toonde geen significante effecten op lichaamsgewicht of orgaangewicht. Het kan echter de glutathionniveaus in de lever en nieren verlagen.
Mierenzuur heeft geen genotoxisch potentieel getoond in verschillende in vitro en in vivo assays. Sommige studies suggereren echter een verstorend effect van lage pH bij hoge concentraties, wat nader onderzoek vereist.
Referentie
- Mierenzuur, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/full/10.1002/14356007.a12_013.pub3
