L-Ascorbinezuur: Eigenschappen, Reacties, Productie en Toepassingen
Wat is L-ascorbinezuur?
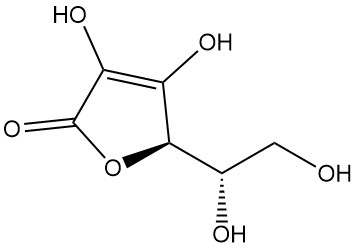
L-ascorbinezuur, ook bekend als (2R)-2-[(1S)-1,2-dihydroxyethyl]-3,4-dihydroxy-2H-furan-5-one, is de IUPAC-aanduiding voor vitamine C. Het is een wit of geurloos poeder of kristal met een zure smaak dat in de natuur voorkomt en antiscorbutische activiteit heeft, wat betekent dat het scheurbuik voorkomt, een ziekte die wordt veroorzaakt door een vitamine C-tekort.
L-ascorbinezuur werd voor het eerst geïsoleerd in 1928 en de structuur ervan werd vijf jaar later bepaald. Tegenwoordig is L-ascorbinezuur wereldwijd de meest geproduceerde vitamine, met een geschatte jaarlijkse productie van ongeveer 150.000 ton.
Een belangrijk kenmerk van L-ascorbinezuur is de omkeerbare oxidatie tot dehydro-L-ascorbinezuur. Dit redoxsysteem zorgt ervoor dat L-ascorbinezuur als reductiemiddel kan fungeren.
Van de vier diastereomeren van ascorbinezuur vertoont alleen D-araboascorbinezuur (ook bekend als isoascorbinezuur, erythorbinezuur en D-erythro-hex-2-eenzuur γ-lacton) een zwakke antiscorbutische activiteit (ongeveer 5% van die van L-ascorbinezuur).
Inhoudsopgave
1. Fysieke eigenschappen van L-ascorbinezuur
L-ascorbinezuur is een wit tot zeer lichtgeel kristallijn poeder dat zeer oplosbaar is in water (1 g in 3 ml), matig oplosbaar in ethanol, propyleenglycol en glycerol, en onoplosbaar in ether, chloroform, benzeen, petroleumether, oliën, vetten en vetoplosmiddelen.
Een samenvatting van de fysieke eigenschappen van l-ascorbinezuur wordt gegeven in de volgende tabel.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [50-81-7] |
| Formule | C6H8O6 |
| Moleculair gewicht | 176,13 g/mol |
| Smeltpunt | 190–192 °C (ontleding) |
| Dichtheid | 1,65 g/cm3 |
| Optische rotatie | [α]20H2O: +20,5° tot +21° (c = 1) |
| [α]20EtOH: +52° (c = 0,5) | |
| [α]20MeOH: +49,5° (c = 0,5) | |
| pH | 3 (5 g/L) 2 (50 g/L) |
| pK1 | 4,17 (3-OH) |
| pK2 | 11,57 (2-OH) |
| Redoxpotentiaal | E = +0,127 V (pH=5) |
2. Chemische eigenschappen van L-ascorbinezuur
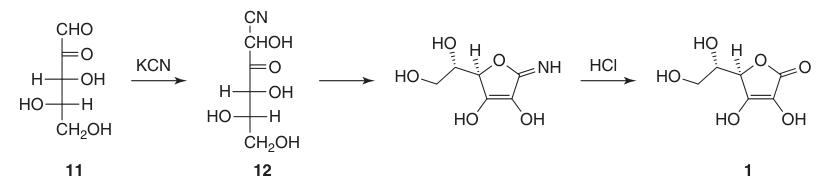
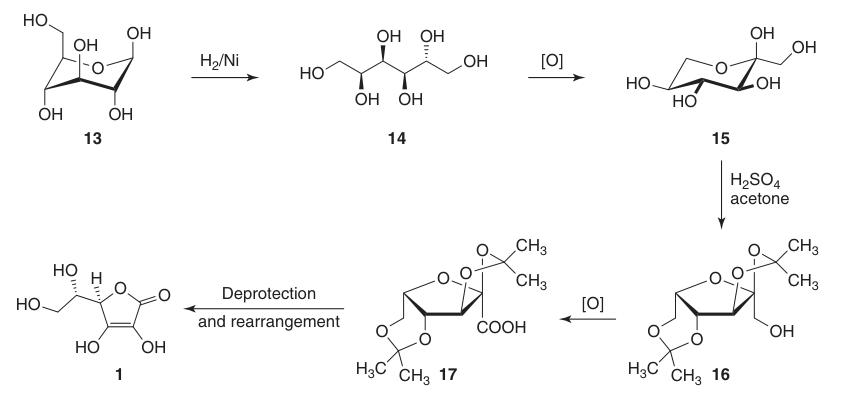
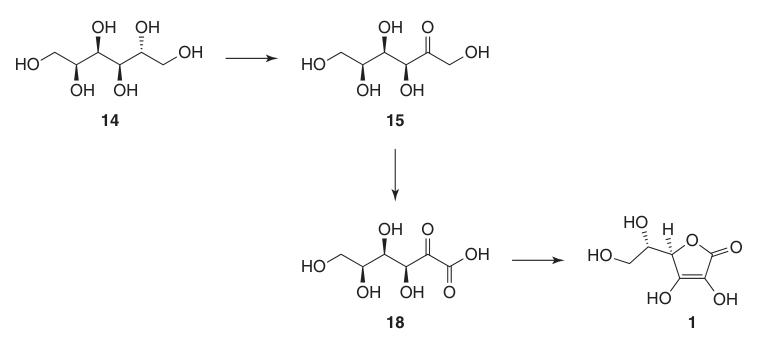
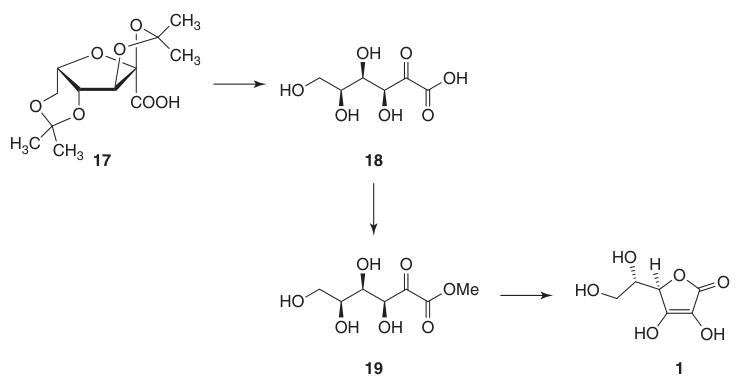
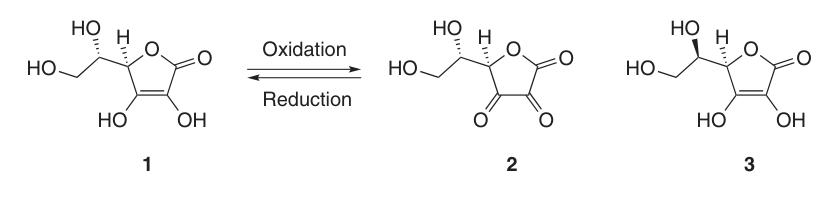
L-ascorbinezuur bestaat in ten minste vijf tautomere vormen. De meest voorkomende vorm, tautomeer (1), vertegenwoordigt de kristalstructuur en domineert in zure waterige oplossingen (pH = 2). Zowel de 2-OH- als de 3-OH-groep zijn zuur en vormen monobasische zouten met basen; dibasische zouten zijn echter instabiel.
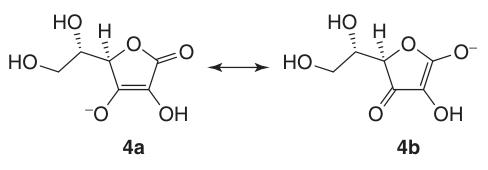
In natrium- en calciumascorbaat interageert het metaalion met het zuurstofatoom op positie 3 (4a). De negatieve lading op het ascorbaatmonoanion is gedelokaliseerd binnen het π-elektronensysteem, wat bijdraagt aan de stabiliteit van zijn lactonring in alkalische omgevingen.
L-ascorbinezuur ondergaat gemakkelijk isomerisatie tot L-isoascorbinezuur bij koken in methanolische kaliumhydroxide.
Vanwege zijn enediolstructuur fungeert L-ascorbinezuur als een krachtig reductiemiddel. De oxidatie van ascorbinezuur (1) levert dehydroascorbinezuur (2) op, dat langs het radicale anionintermediair semidehydroascorbinezuur (5) gaat.
Semidehydroascorbinezuur is een sterk zuur (pKa = 0,45) en een radicalenvanger die met zichzelf kan reageren om ascorbinezuur en verbinding (6) te regenereren of met andere vrije radicalen te reageren.
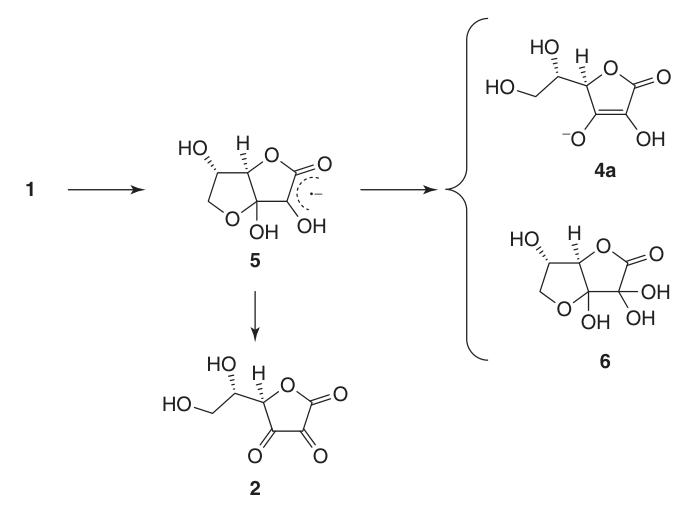
Overgangsmetalen zoals Cu en Fe katalyseren de autoxidatie van ascorbinezuur naar dehydroascorbinezuur (2). Deze metalen vormen een ternair intermediair complex met zuurstof, dat dissocieert om dehydroascorbinezuur (2), waterstofperoxide en het metaalion op te leveren.
Het autoxidatieproces wordt versneld boven pH 7 en kan worden geremd door metaalionen te complexeren met chelerende middelen zoals EDTA, metafosforzuur, citroenzuur of oxaalzuur.
Behandeling van ascorbinezuur met zuurstof in methanol met actieve kool vormt een stroperig methanoladduct, dat bij verdere verwerking dehydroascorbinezuur (2) oplevert als een kristallijn dimeer met een opbrengst van 64%.
Bij pH 2,5–5,5 in een waterige oplossing en bij 4 °C is verbinding (2) enkele dagen stabiel; reductiemiddelen zoals waterstofsulfide, dithiothreitol of cysteïne kunnen het echter kwantitatief terug omzetten in ascorbinezuur.
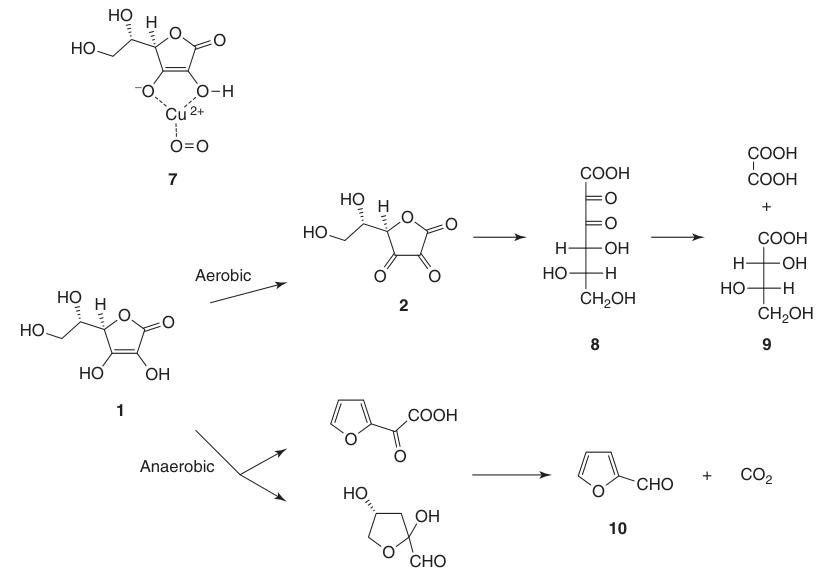
Terwijl dehydroascorbinezuur (2) de activiteit van vitamine C behoudt, leidt onomkeerbare opening van de lactonring om 2,3-diketogulonzuur (8) te vormen tot volledig verlies van deze activiteit.
L-ascorbinezuur ondergaat afbraak in waterige oplossingen onder zowel aerobe als anaerobe omstandigheden. De snelheid van ontleding hangt af van factoren zoals pH, temperatuur, licht, concentratie en de aanwezigheid van zware metaalkatalysatoren.
De aanwezigheid van zuurstof versnelt het afbraakproces aanzienlijk vergeleken met anaërobe omstandigheden. De uiteindelijke oxidatieproducten omvatten L-threonzuur (9) en oxaalzuur. Onder anaërobe omstandigheden leidt afbraak tot furfural (10) en CO2.
Vaste L-ascorbinezuur is zeer stabiel gedurende lange tijd bij afwezigheid van vocht en licht.
Bescherming tegen oxidatieve afbraak in waterige toepassingen kan worden bereikt door te coaten met vetten en polymeren of door chemische substitutie van de enediolhydroxylgroepen (L-ascorbaat 2-sulfaat, L-ascorbaat 2-fosfaat en 2-O-methylascorbinezuur).
3. Natuurlijke bronnen van vitamine C
Ascorbinezuur (vitamine C) is een wijdverspreide verbinding die wordt aangetroffen in planten en sommige dieren. Het komt vooral veel voor in groene planten, met de hoogste concentraties waargenomen in tropische vruchten en gladiolenbladeren. De aanwezigheid ervan in gist en niet-cyanobacteriële prokaryoten blijft onduidelijk.
Historisch gezien was de inname van vitamine C tijdens de wintermaanden sterk afhankelijk van wortelgroenten zoals aardappelen en kool. Tegenwoordig, met het hele jaar door toegang tot verse groenten en fruit, zijn de voedingsbronnen van vitamine C diverser. Opslag- en kookprocessen kunnen echter bijdragen aan de afbraak van vitamine C.
De distributie van vitamine C binnen plantenweefsels varieert. Opvallend is dat sommige planten, zoals Brassica-soorten en Elaeocarpus-soorten, vitamine C opslaan in gebonden vormen, respectievelijk bekend als ascorbigen en elaeocarpusine.
Vitamine C wordt ook aangetroffen bij dieren, maar in lagere concentraties vergeleken met planten. De hoogste concentraties worden aangetroffen in de endocriene organen van zoogdieren zoals koeien (hypofyse en bijnieren).
Bepaalde diersoorten, waaronder mensen, primaten, cavia’s, vliegende zoogdieren, sommige vogels, vissen en insecten, hebben niet het vermogen om vitamine C te synthetiseren en zijn afhankelijk van voedselinname.
| Voedselgroep | Vis C (mg/100 g) |
|---|---|
| Vis | 0–4 |
| Asperges | 7–25 |
| Vlees (rundvlees, varkensvlees) | 0–10 |
| Bonen | 5–30 |
| Melk (koe) | 1–2 |
| Broccoli | 20–100 |
| Fruit (appels, kersen, kiwi's, sinaasappels) | 4–180 |
| Groenten (broccoli, spruitjes, bloemkool, spinazie, rapen) | 20–90 |
| Wortelgroenten (wortels, aardappelen) | 2–20 |
| Granen (haver, rogge, tarwe) | <1 |
| Rijst | 0 |
| Dier | Aanbevolen supplementen |
|---|---|
| Leghennen | 100-200 |
| Vleeskuikens voor de mesterij (van begin tot eind) | 100-200 |
| Vleeskuikenouderdieren | 100-150 |
| Kalkoenen voor de mesterij (van begin tot eind) | 100-200 |
| Kalkoenfokkers | 100-200 |
| Biggen (prestarter en starter) | 100-200 |
| Varkensfokkers | |
| Zeugen en gelten | 200-300 |
| Beren | 200-500 |
| Kalf | 200-500 |
| Paarden (mg/hoofd/dag) | |
| Veulens | 500-750 |
| Race- en fokpaarden | 1000-2000 |
| Zalm en forel | 150-250 |
| Warmwatervissen (karper en tilapia) | 150-250 |
| Zeebrasem en zeebaars | 150-250 |
| Garnalen | 250-500 |
| Honden | 100-200 |
| Katten | 100-200 |
5.3. Andere toepassingen
Economische factoren beperken de toepassing van ascorbinezuur in de plantkunde voor zaadontkieming, ozonbescherming, oogsthulp, ziekteresistentie en groeiregulatie.
Kleinere toepassingen bestaan in de polymeer-, fotografische en cosmetische industrie.
Referentie
- Vitamins, 14. Vitamin C (l-Ascorbic Acid); Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.o27_o10.pub2
Ik ben een gepassioneerde organische chemicus en leer voortdurend over verschillende industriële chemische processen en chemische producten. Ik zorg ervoor dat alle informatie op deze website accuraat is en nauwgezet verwijst naar wetenschappelijke artikelen.