Hydrazine: Eigenschappen, Reacties en Toepassingen

Wat is Hydrazine?
Hydrazine is een anorganische verbinding met de formule N2H4. Het is een zeer giftige kleurloze vloeistof met een sterke ammoniakachtige geur.
Hydrazine wordt voornamelijk verkocht in de vorm van een waterige oplossing met een concentratie tot 64%, wat overeenkomt met hydrazinehydraat N2H4·H2O.
In 1875 deed EMIL FISCHER een voorspelling over de aanwezigheid van hydrazine H2N–NH2. In 1887 slaagde CURTIUS erin het te isoleren. Vervolgens slaagde DE BRUYN er in 1893 in om watervrije hydrazine te isoleren.
RASCHIG vond in 1907 het eerste commerciële productieproces uit, dat nog steeds wordt gebruikt in Japan, Rusland, China en Korea.
Het uitgebreide gebruik van hydrazine en zijn derivaten als blaasmiddelen voor plastic schuim leidde tot de opkomst van verschillende industriële toepassingen zoals ketelwaterbehandeling, polymerisatie-initiatoren, pesticiden, farmaceutische producten, fotografische chemicaliën en kleurstoffen.
Zelfs na een eeuw na de ontdekking ervan blijft de synthese van hydrazine een uitdaging, voornamelijk vanwege thermodynamische beperkingen. Het grootste deel van hydrazine wordt geproduceerd met behulp van aangepaste versies van het Raschig-proces, waarbij ammoniak wordt geoxideerd door hypochloriet.
Niettemin gebruiken nieuwere fabrieken die sinds 1980 zijn gebouwd het PCUK-proces, dat waterstofperoxide als oxidant gebruikt.
Inhoudsopgave
1. Fysische eigenschappen van hydrazine
Hydrazine is een kleurloze vloeistof met een ammoniakachtige geur. Het is volledig mengbaar met water en vormt zeer alkalische waterige oplossingen.
Met name specifieke eigenschappen zoals viscositeit en dichtheid bereiken hun maximale waarden wanneer de samenstelling 64% bedraagt, wat duidt op de aanwezigheid van de monohydraatvorm, N2H4·H2O, in zowel de vaste als de vloeibare fase.
Hydrazine vormt een azeotroop (kookpunt 120,5 °C) met water, waarbij het azeotrope mengsel 58,5 mol% hydrazine bevat.
Hydrazine is een endotherme verbinding, met een vormingswarmte van +50,6 kJ/mol. De explosiegrenzen in lucht variëren van 4,7% tot 100%. De bovengrens geeft aan dat watervrij hydrazine in staat is tot zelfexplosie.
Verdunnen met een inert gas zoals stikstof of water verkleint echter het ontvlambaarheidsbereik aanzienlijk door de onderste explosiegrens te verhogen. Bijgevolg kan hydrazinehydraat (bevat 30,9 vol% hydrazine) veilig worden gehanteerd bij atmosferische druk en 120 °C in afwezigheid van lucht.
Hieronder vindt u een overzicht van bepaalde fysische eigenschappen van hydrazine:
- Molaire massa = 32,05 g/mol
- smeltpunt = 2 °C
- kookpunt = 113,5 °C
- dichtheid = 1,0045 g/ml
- Breukindex = 1,4644 bij 25 °C
- viscositeit = 0,974 μPa.s
- pH (bij 65% wateroplossing) = 12,75
2. Chemische reacties van hydrazine
De chemische eigenschappen van hydrazine worden sterk beïnvloed door de volgende kenmerken: de endotherme aard, alkaliteit en sterke reductiemiddeleigenschappen.
2.1. Thermische ontleding
Aanzienlijke ontleding van hydrazine vereist een relatief hoge temperatuur (250 °C) bij afwezigheid van katalysatoren. De aanwezigheid van bepaalde katalysatoren zoals koper, kobalt, molybdeen en hun oxiden verlaagt echter de ontledingstemperatuur. Daarom is voorzichtig omgaan met hydrazine noodzakelijk.
2.2. Zuur-basereacties
Hydrazine gedraagt zich als een zwakke base en reageert met water:

Het N2H6+-kation wordt alleen waargenomen in zeer zure oplossingen of in de vaste toestand.
Hydrazine kan zouten vormen met zuren, waaronder explosieve zouten zoals nitraat, perchloraat en azide. Aan de andere kant kunnen commercieel verkrijgbare zouten zoals hydrochloride, hydrobromide en sulfaat op dezelfde manier worden behandeld als hydrazinehydraat.
2.3. Reductiemiddel
Hydrazine vertoont sterke reductiemiddeleigenschappen en reageert exotherm met zuurstof:

Veel toepassingen van hydrazine zijn gebaseerd op deze reactie. De oxidatie van hydrazine door lucht in alkalische oplossingen wordt gekatalyseerd door verschillende metalen. Daarom moeten hydrazine-oplossingen worden gedestilleerd in afwezigheid of deactivering van koper, polyvalente metalen of hun zouten. De oxiden van cadmium, magnesium, zink en aluminium zorgen voor stabilisatie tegen luchtoxidatie in hydrazine-oplossingen.
In zure oplossingen reageert hydrazine met halogenen:

Deze reacties zijn nuttig bij het bepalen van N2H4 (met behulp van jodium), het zuiveren van ruwe waterstofhalogeniden en het verwijderen van sporen halogenen in afvalwater. Dezelfde procedure kan worden gebruikt om sporen hydrazine zelf te verwijderen. Natriumhypochloriet of waterstofperoxide, in aanwezigheid van ijzer(III)- of koper(II)-zouten, zijn handige opties voor afval- of lekbehandeling.
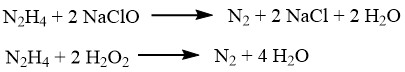
Hydrazine kan verschillende metaalionen of oxiden reduceren, zoals koper, zilver, goud, kwik, nikkel en platina, en ze omzetten in poedervormige metalen.
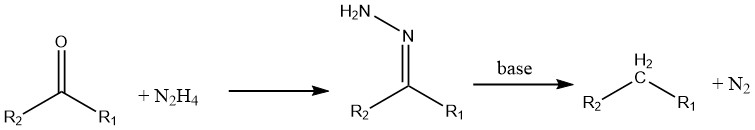
Ketonen en aldehyden ondergaan reductie in de aanwezigheid van hydrazine (bekend als de Wolff-Kishner-reactie).
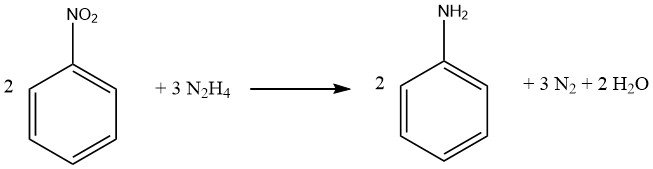
Aromatische nitroverbindingen kunnen worden gereduceerd tot de overeenkomstige amines met behulp van hydrazine en een hydrogeneringskatalysator zoals Raney-nikkel.
Hydrazine ondergaat oxidatie tot diimide in aanwezigheid van waterstofperoxide. Diimide reduceert vervolgens acetylenen tot cis-alkenen en hydrogeneert resterende dubbele bindingen in acrylonitril-butadieenrubber.

2.4. Diaminereacties
Hydrazine wordt veelvuldig gebruikt bij de synthese en productie van verschillende open-keten en heterocyclische stikstofverbindingen, waaronder hydrazo- en azoverbindingen, pyrazolen, triazolen, urazolen, tetrazolen, pyridazinen en triazinen.
3. Toepassingen van hydrazine
Het grootste deel van de beschikbare hydrazine wordt verkocht als een oplossing in water. Watervrije hydrazine wordt daarentegen voornamelijk gebruikt als raketbrandstof of als mono- of bipropellant voor satellieten en ruimtevaartuigen.
Ongeveer 80-90% van de hydrazineproductie wordt omgezet in organische derivaten. Andere toepassingen zijn gebaseerd op de rol als reductiemiddel, een energierijke verbinding of de waterstofopslagcapaciteit.
De belangrijke toepassingen van hydrazine en zijn derivaten omvatten hun gebruik als polymerisatie-initiatoren en blaasmiddelen voor geschuimde kunststoffen, evenals bij de productie van pesticiden. Ze worden ook gebruikt als synthetische bouwstenen, farmaceutische producten, drijfgassen en airbags voor auto’s.
3.1. Blaasmiddelen
De industriële productie van op hydrazine gebaseerde blaasmiddelen is substantieel, met een hydrazinehydraatconsumptie voor dit doel die in 1998 50.000 ton per jaar bereikte. Deze blaasmiddelen zijn voornamelijk hydrazo- of azoderivaten, waarbij de laatste worden verkregen door oxidatie van de eerste met behulp van chloor of waterstofperoxide.
Bij verhitting ontbinden blaasmiddelen, waarbij stikstof en andere gassen vrijkomen, die een schuimend effect in polymeren creëren, wat resulteert in de vorming van poriën of cellen. Er zijn verschillende commercieel geproduceerde op hydrazine gebaseerde blaasmiddelen beschikbaar, en hun ontledingstemperatuur is afhankelijk van factoren zoals deeltjesgrootte, pH en de aanwezigheid van activerende middelen zoals barium-, cadmium- of zinkzouten.
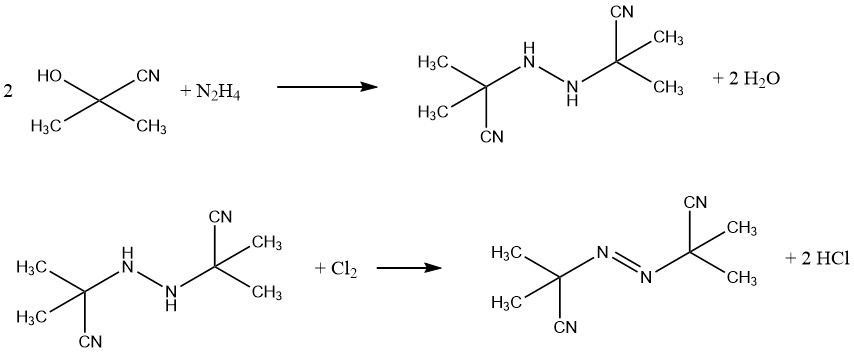
Een voorbeeld van een commercieel blaasmiddel is azobis(isobutyronitril) (AIBN), dat wordt gebruikt voor sponsrubberproducten en PVC-schuimen. Het fungeert ook als een bron van vrije radicalen bij polymerisatie-initiatie. AIBN wordt gesynthetiseerd uit acetoncyaanhydrine en hydrazine, gevolgd door oxidatie met chloor.
Azodicarbonamide is een ander belangrijk blaasmiddel dat wordt geproduceerd uit ureum en hydrazine.

Het intermediaire hydrazodicarbonamide kan direct worden verkregen uit ureum en natriumhypochloriet of via oxidatie met chloor of waterstofperoxide in aanwezigheid van een kleine hoeveelheid bromide-ionen in een zuur medium.
Azodicarbonamide is het meest gebruikte blaasmiddel vanwege het grote gasvolume dat vrijkomt bij ontleding en de veilige eigenschappen.
Om te voldoen aan de eisen van de productie van nieuwe rubber- of poreuze kunststofmaterialen, werden in de jaren 50 sulfonzuurhydraziden geïntroduceerd.
Deze hydraziden zijn beter dan eerder gebruikte anorganische blaasmiddelen (bijv. ammoniumnitriet, ammoniumbicarbonaat, natriumbicarbonaat) in termen van dispersie, hogere temperatuurtolerantie en verbeterde schuimcelstructuur.
Ze zijn ook kleurloos, geurloos en veilig, met ontledingsproducten die de verbranding niet ondersteunen. Sulfonzuurmono- en dihydraziden worden geproduceerd uit hydrazinehydraat en het overeenkomstige sulfonzuurchloride.
3.2. Airbags
Natriumazide wordt vaak gebruikt als gasprecursor in airbagtechnologie. Eén productieproces voor natriumazide omvat hydrazine en een alkylnitriet. Een ander hydrazinederivaat, 5-aminotetrazole, verkregen uit aminoguanidinezouten, wordt ontwikkeld voor dezelfde toepassing.
3.3. Vrije-radicalenpolymerisatie-initiatoren
Azoverbindingen, met name symmetrische azodinitrillen, worden veel gebruikt als vrije-radicalenpolymerisatie-initiatoren.
Deze azoverbindingen worden gesynthetiseerd uit hydrazine, een keton en waterstofcyanide (HCN). Het hydrazoderivaat wordt geoxideerd met behulp van chloor of waterstofperoxide in aanwezigheid van een bromidekatalysator.
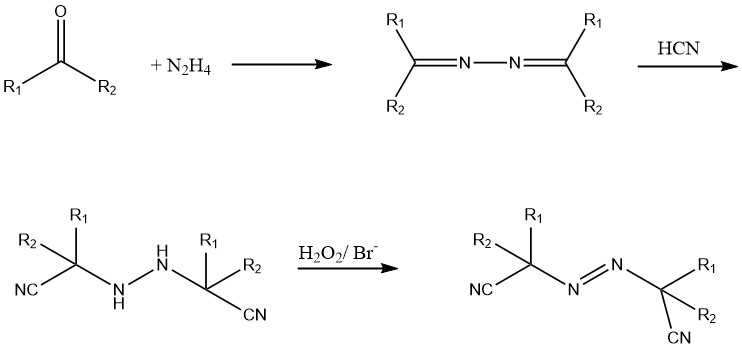
Wateroplosbare verbindingen zoals 2,2′-azo bis(2-aminopropaan) dihydrochloride en vloeibare azoverbindingen zoals diethyl 2,2′-azobisisobutyraat zijn momenteel in ontwikkeling.
3.4. Pesticiden
Pesticiden op basis van hydrazine vormen een aanzienlijk deel van de hydrazineconsumptie. Het eerste voorbeeld is maleïnehydrazide, gesynthetiseerd door maleïnezuuranhydride te laten reageren met hydrazine.
Een ander algemeen toepasbaar herbicide is 3-amino-1,2,4-triazool, verkregen uit cyanamide, hydrazinehydraat en mierenzuur. Dit herbicide wordt selectief gebruikt in wijngaarden en boomgaarden, met een consumptie die enkele duizenden tonnen per jaar bedraagt.
Talrijke op hydrazine gebaseerde verbindingen worden commercieel geproduceerd voor pesticidetoepassingen, voornamelijk heterocyclische verbindingen zoals triazinen, oxadiazolen, pyrazolen, pyridazinen en thiadiazolen.
3.5. Farmaceutica
Hoewel hydrazine een klein percentage van de totale hydrazineproductie vertegenwoordigt, is het gebruik ervan in farmaceutica aanzienlijk. Zo werd isoniazide, de hydrazide van isonicotinezuur, voor het eerst gebruikt in de jaren 50 voor de behandeling van tuberculose.
In de jaren 80 en 90 werden andere op hydrazine gebaseerde farmaceutica met de 1,2,4-triazoolgroep geïntroduceerd, die dienden als antidepressiva, antihypertensiva en antibacteriële of antischimmelmiddelen.
Recente ontwikkelingen hebben zich gericht op farmaceutica met de 4-amino-1,2,4-triazoolgroep, die een verbeterde efficiëntie vertonen.
3.6. Waterbehandeling
Hydrazine wordt gebruikt in waterbehandeling om staal te beschermen tegen corrosie in boilers. Wanneer hydrazine reageert met ijzer(III)oxide, vormt het magnetiet, dat dient als een beschermende laag tegen corrosie door water en zuurstof.
Resterende hydrazineconcentraties onder 0,1 ppm zorgen voor volledige corrosiebescherming. Commercieel verkrijgbare gekatalyseerde hydrazinehydraatformuleringen, bekend als geactiveerde hydrazine, zijn zelfs bij kamertemperatuur effectief.
3.7. Stuwstoffen
Hydrazine werd aanvankelijk op grote schaal gebruikt als raketbrandstof. Watervrije hydrazine is een uitstekende stuwstof, waarbij alleen waterstof de specifieke impuls ervan overtreft.
Huidige raketbrandstoffen omvatten watervrije hydrazine, monomethylhydrazine en asymmetrische dimethylhydrazine, die voornamelijk worden gebruikt als bipropellantbrandstoffen in raketten zoals Titan of Ariane.
Watervrije hydrazine dient ook als monopropellant voor satellieten en ruimtevaartuigen. De ontleding ervan over een katalysator produceert een mengsel van gassen.
Katalysatoren, vaak gebaseerd op iridium of ruthenium afgezet op aluminiumoxide, worden gecategoriseerd als spontaan (werkend bij kamertemperatuur) of niet-spontaan (werkend boven 100 °C).
3.8. Brandstofcellen
Er is uitgebreid onderzoek gedaan naar brandstofcellen die gebruikmaken van de oxidatie van hydrazine met zuurstof of waterstofperoxide. Hun gebruik is echter voornamelijk beperkt tot militaire toepassingen vanwege de kosten van hydrazinehydraat.
Referentie
- Hydrazine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a13_177
