Ftaalzuuranhydride: eigenschappen, reacties, productie en toepassingen
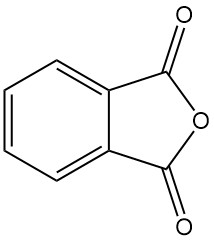
Wat is ftaalzuuranhydride?
Ftaalzuuranhydride [85-44-9], ook bekend als isobenzofuran-1,3-dion, is een organische verbinding met de formule C6H4(CO)2O. Het is een kleurloze tot witte, vaste stof in de vorm van naalden met een milde, kenmerkende geur die ontstaat door de dehydratie van ftaalzuur.
Ftaalzuuranhydride was het eerste anhydride van een dicarbonzuur dat commercieel werd gebruikt. Het is een belangrijke industriële chemische stof die wordt gebruikt voor de grootschalige productie van weekmakers voor kunststoffen.
A. Laurent ontdekte ftaalzuuranhydride voor het eerst in 1836 en sinds 1872 wordt het geproduceerd door BASF met behulp van het naftaleenoxidatieproces.
Inhoudsopgave
1. Fysieke eigenschappen van ftaalzuuranhydride
Ftaalzuuranhydride bestaat als kleurloze naalden of plaatjes met monokliene of rhombische kristallijne vormen. De fysieke eigenschappen van ftaalzuuranhydride staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [85-44-9] |
| Chemische formule | C8H4O3 |
| Moleculair gewicht | 148,12 g/mol |
| Dichtheid (vast bij 4 °C) | 1,527 g/cm3 |
| Specifieke dampdichtheid (1013 mbar) | 6,61 kg/m3 |
| Smeltpunt | 131,6 °C |
| Kookpunt (1013 mbar) | 295,1 °C |
| Smeltwarmte | 159,1 J/g |
| Verbrandingswarmte | 22.160,7 J/g |
| Vormingswarmte (naftaleen) | 12.058 J/g |
| Warmte van vorming (o-xyleen) | 8.625 J/g |
| Warmte van sublimatie | 601 J/g |
| Warmte van verdamping | 441,7 J/g |
| Vlampunt | 152 °C |
| Ontstekingstemperatuur | 580 °C |
| Ontvlambaarheid Limieten (1013 mbar) | Boven: 10,5 vol% Onder: 1,7 vol% |
| Onderste stofexplosiegrens | 25 g/m3 |
De dichtheid van vloeibaar ftaalzuuranhydride tussen 140 en 240 °C kan worden bepaald met behulp van de volgende vergelijking:
ρ/kg.m-3 = 1321,55-0,6697 (t/°C)-0,000905 (t/°C) 2
De oplosbaarheidsgegevens van ftaalzuuranhydride in verschillende oplosmiddelen worden gepresenteerd in Tabel 2.
Gerapporteerde gegevens over explosiegevaren van ftaalzuuranhydride in lucht laten aanzienlijke variaties zien. Explosies kunnen optreden bij concentraties onder de 100 g/m³, beïnvloed door onzuiverheden die aanwezig zijn in het monster. Recente industriële incidenten suggereren dat meer dan 35 g/m³ ftaalzuuranhydride in reactieproductgas kan leiden tot ontbranding bij contact met warmteoverdrachtszout als gevolg van gebroken reactorbuizen.
| Oplosmiddel | Temperatuur (°C) | Oplosbaarheid (g/100 g) |
|---|---|---|
| Water | 20 | 1,64 |
| Water | 50 | 1,74 |
| Water | 100 | 19,0 |
| Koolstofdisulfide | 20 | 0,7 |
| Mierenzuur | 20 | 4,7 |
| Pyridine | 20 | 80 |
| Benzeen | - | oplosbaar |
| Ethanol | 20 | oplosbaar |
| Di-ethylether | 20 | licht oplosbaar |
2. Reacties van ftaalzuuranhydride
Ftaalzuuranhydride toont de reactiviteit van cyclisch anhydride en aromatische verbindingen.
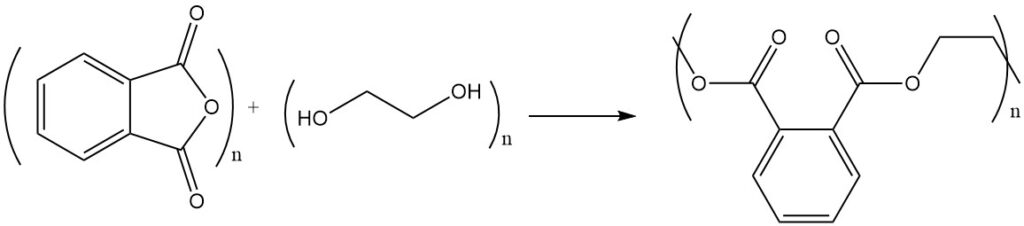
De reactie van ftaalzuuranhydride met alcoholen of diolen levert esters of polyesters op. Ftaalzuuranhydride reageert bijvoorbeeld met ethyleenglycol om polyester te vormen, een polymeer met herhalende estereenheden.
Onverzadigde polyesterharsen worden gevormd door polycondensatie met maleïnezuuranhydride of fumaarzuur.
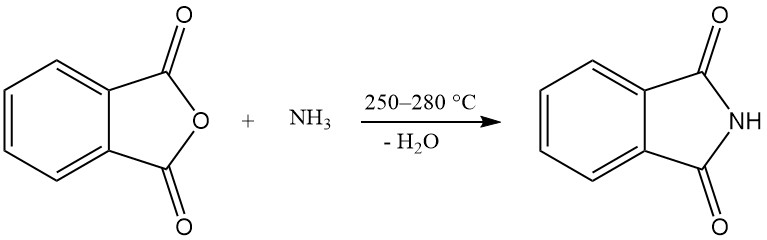
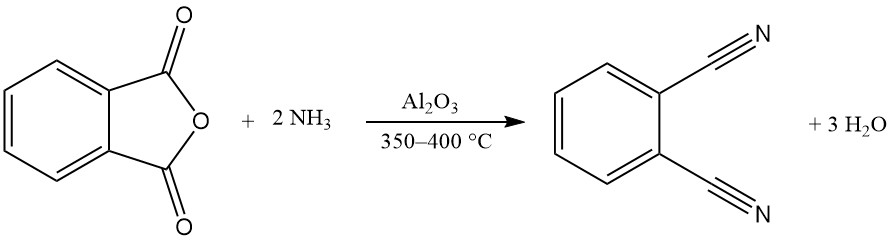
Een of beide carboxylgroepen van ftaalzuuranhydride kunnen reageren met ammoniak om ftaalimide of ftaalonitril te produceren.
Ftaleïne- en rhodaminekleurstoffen, waarvan sommige al meer dan een eeuw in productie zijn, worden verkregen door de reactie van ftaalzuuranhydride met fenolen, aminofenolen of quinaldinederivaten. Fluoresceïne wordt gesynthetiseerd uit ftaalzuuranhydride en resorcinol met behulp van zure katalysatoren.
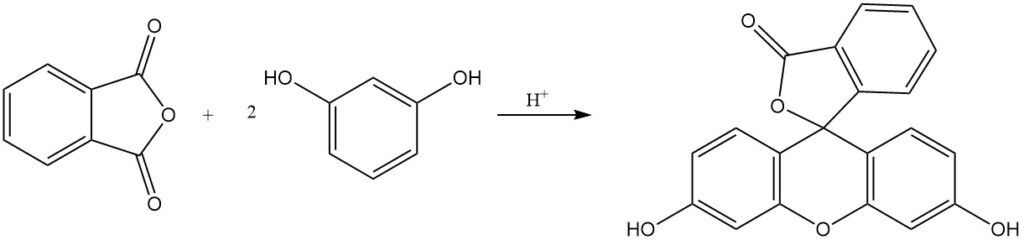
De reactie van ftaalzuuranhydride met fenol produceert fenolftaleïne in aanwezigheid van een zure katalysator.
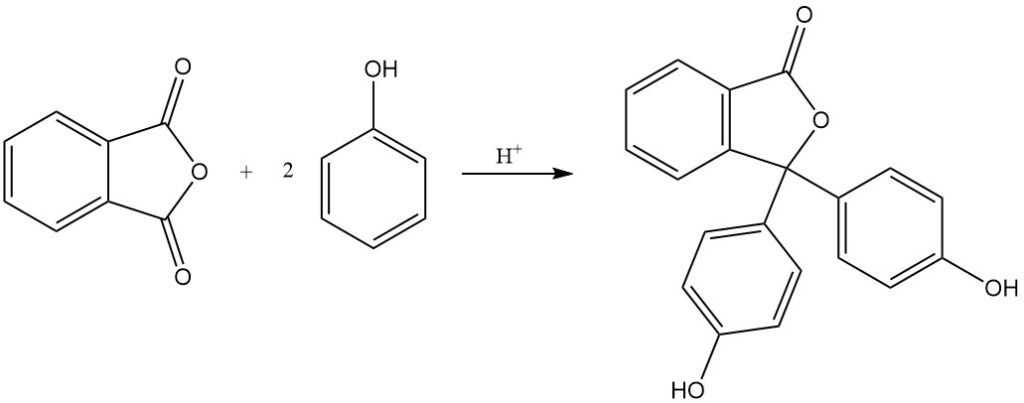
Wanneer ftaalzuuranhydride reageert met 4-aminofenol, ontstaat N-(4-hydroxyfenyl)ftaalimide.
De Friedel-Crafts-reactie van ftaalzuuranhydride met benzeenderivaten, gevolgd door ringsluiting, vormt antrachinonderivaten, die worden gebruikt om antrachinonkleurstoffen te maken.
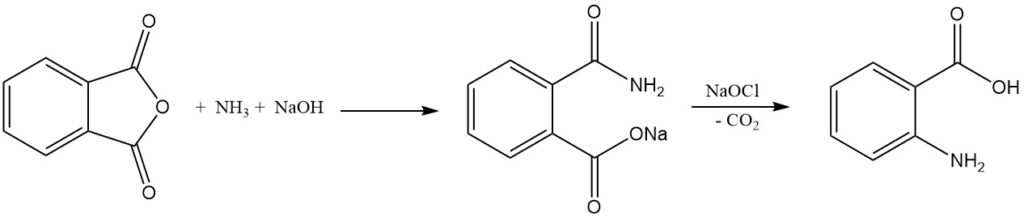
De industriële synthese van antrachinonzuur uit ftaalzuuranhydride omvat twee stappen. Ten eerste reageert ftaalzuuranhydride met ammoniak in aanwezigheid van natriumhydroxide om ftaalzuurzout te vormen, en vervolgens ondergaat het natriumzout van ftaalzuur een Hofmann-omlegging en decarboxylatie wanneer het wordt behandeld met hypochloriet om antrachinonzuur te geven.
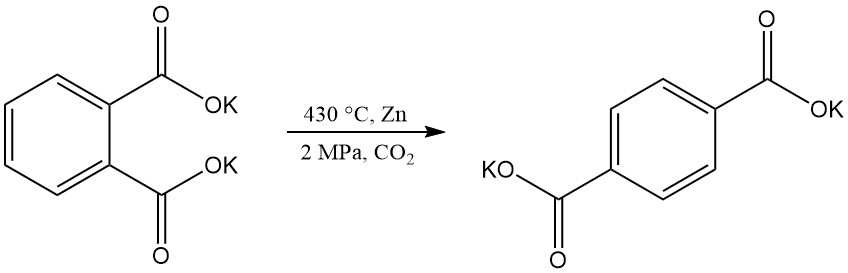
Tereftaalzuur kan worden geproduceerd door de herschikking van dikaliumftalaat, maar technische uitdagingen hebben dit proces overbodig gemaakt.
Elektrochemische hydrogenering van ftaalzuuranhydride levert 3,5-dihydroftaalzuur op, terwijl hydrogenering met een nikkelkatalysator ftalide oplevert.
3. Productie van ftaalzuuranhydride
Ftaalzuuranhydride wordt voornamelijk op industriële schaal geproduceerd door de gasfase-oxidatie van o-xyleen of naftaleen. Het kan ook worden bereid door oxidatie van naftaleen in een wervelbed of door oxidatie van o-xyleen in de vloeistoffase.
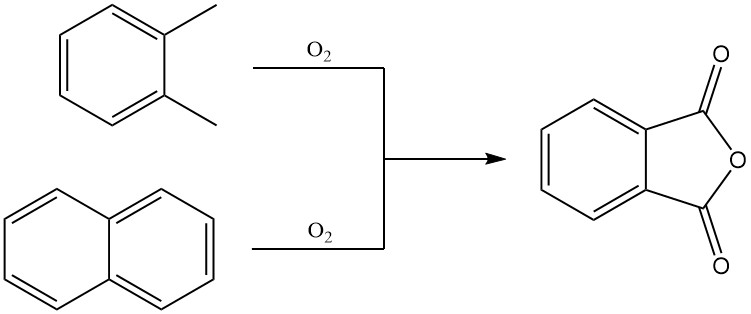
3.1. Productie van ftaalzuuranhydride door gasfaseoxidatie van o-xyleen of naftaleen
Voorverwarmd o-xyleen wordt gemengd met hete lucht en in een buisreactor gevoerd die een zeer selectieve katalysator bevat. De oxidatiereactie is exotherm en de gegenereerde warmte wordt gebruikt om stoom te produceren, waarbij overtollige stoom beschikbaar is voor extern gebruik.
De effluentgassen van de reactor worden voorgekoeld. Bij hoge ftaalzuuranhydrideconcentraties kan een deel van het vloeibare ftaalzuuranhydride direct worden verzameld in een condensor en de resterende productgasstroom komt in een schakelcondensorsysteem terecht.
Gevinde buizen in de schakelcondensors worden gekoeld door warmteoverdrachtsolie in een cyclisch proces. Tijdens de koelcyclus condenseert ftaalzuuranhydride als een vaste stof op de buizen en een daaropvolgende verwarmingscyclus smelt het afgezette ftaalzuuranhydride, dat vervolgens wordt verzameld in een opslagtank.
Na de scheiding van ftaalzuuranhydride moeten uitlaatgassen die bijproducten bevatten, worden gereinigd door middel van waterreiniging, katalytische verbranding of thermische verbranding.
Waterreiniging zorgt voor de concentratie van maleïnezuur (een bijproduct) uit de reinigingsoplossing, dat verder kan worden verwerkt tot fumaarzuur of maleïnezuuranhydride.
De combinatie van reiniging met maleïnezuuranhydrideproductie elimineert de lozing van vervuild afvalwater.
Het ruwe ftaalzuuranhydride wordt overgebracht naar een continu thermisch/chemisch behandelingssysteem dat elk ftaalzuurbijproduct terug omzet in ftaalzuuranhydride. Ten slotte wordt het behandelde ruwe ftaalzuuranhydride gezuiverd door een continu, tweetraps destillatiesysteem.
3.1.1. Commerciële processen
Het BASF-proces werkt met een breed scala aan o-xyleenladingen (tot 105 g/m³) en maakt gebruik van een afwerkingsreactor voor het verminderen van bijproducten en het verbeteren van de kwaliteit.
Dit proces biedt flexibele werking voor een geoptimaliseerde opbrengst, minder afval en een langere levensduur van de katalysator en vereist geen SO2-activering of een voorcondensor voor het verzamelen van ruw ftaalzuuranhydride.
Het geproduceerde ruwe ftaalzuuranhydride bevat een laag bijproduct, waardoor het is geoptimaliseerd voor een laag energieverbruik en een hoge netto-energie-export.
Het Wacker-proces maakt gebruik van o-xyleen, naftaleen of hun mengsels. Het gebruikt o-xyleenladingen van 90–100 g/m³ (STP) en richt zich op procesaanpassingen voor energiebesparing.
Het Nippon Shokubai VGR-proces onderscheidt zich door het recyclen van ontluchtingsgas, waardoor de zuurstofconcentratie wordt verlaagd tot <10 vol% voor veilige werking met een hoge o-xyleenlading (tot 85 g/m³ STP). Dit proces behaalt hoge opbrengsten die worden toegeschreven aan een gespecialiseerd katalysatorsysteem, en het kan ook naftaleen als grondstof gebruiken.
Het Alusuisse-Ftalital LAR-proces stelt o-xyleenladingen tot 134 g/m³ (STP) voor voor potentiële energie- en apparatuurgroottevermindering. Het gebruikt commercieel ladingen tot 80 g/m³ (STP) en gebruikt ring- of halfringvormige katalysatoren die zowel o-xyleen als naftaleen of hun mengsels kunnen verwerken.
Het Rhône-Poulenc-proces gebruikt o-xyleen als grondstof en onderwerpt het ruwe product aan chemische nabehandeling vóór de tweetrapsdestillatie. Het behandelt afvalgas door middel van verbranding.
Het ELF Atochem/Nippon Shokubai-proces maakt gebruik van de Nippon Shokubai-katalysator voor de verwerking van o-xyleen of naftaleen en gebruikt industriële invoerladingen tot 75 g/m³ (STP) voor o-xyleen.
3.1.2. Katalysator en reactiemechanisme
Moderne fabrieken gebruiken voornamelijk ringvormige katalysatoren in buisvormige reactoren die worden gekoeld door gesmolten zout voor energie-efficiëntie. Halve-schaaldragers zijn ook beschikbaar.
Typische katalysatoren bestaan uit een inerte keramische drager (silicaat, siliciumcarbide, enz.) bedekt met een dunne laag vanadium- en titaniumoxiden. Antimoon, rubidium, cesium, niobium en fosfor kunnen worden toegevoegd om de selectiviteit naar ftaalzuuranhydride te verbeteren.
Twee-zone katalysatoren die lage en hoge activiteitszones combineren zijn gebruikelijk, waarbij sommige processen drie zones gebruiken voor hoge o-xyleenladingen, en bepaalde katalysatoren vereisen SO2-activering voor een langere levensduur.
Het exacte reactiepad voor de vorming van ftaalzuuranhydride is niet volledig begrepen en hangt af van meetmethoden en experimentele opstellingen.
Een redoxmechanisme waarbij zuurstofatomen in het katalysatorrooster betrokken zijn, wordt algemeen aanvaard. Hoewel de intermediaire alcohol niet definitief is waargenomen, is de aanwezigheid ervan waarschijnlijk bij de omzetting van o-xyleen naar ftaalzuuranhydride.
Industriële o-xyleenconversie bereikt opbrengsten die 80% van het theoretische maximum overschrijden (ongeveer 110–112 kg ftaalzuuranhydride per 100 kg o-xyleen). De opbrengsten van naftaleenconversie zijn echter doorgaans lager (ongeveer 85% van het theoretische maximum, of 98 kg ftaalzuuranhydride per 100 kg naftaleen), vanwege extra bijproducten zoals naftochinon.
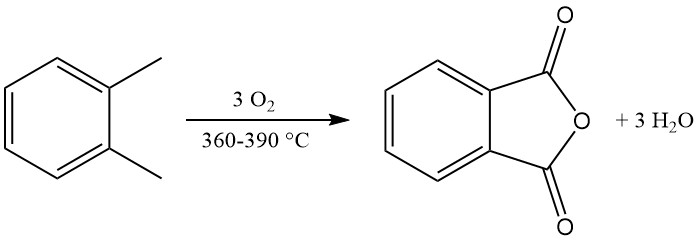
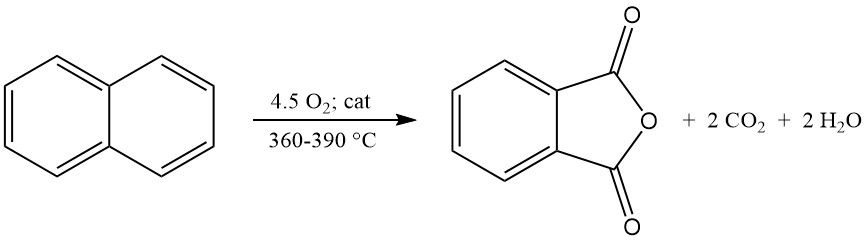
De exotherme oxidatiereactie genereert aanzienlijke warmte: 1300–1800 kJ/mol voor o-xyleen en 2100–2500 kJ/mol voor naftaleen. Deze warmte wordt vaak gebruikt voor stoomproductie.
De belangrijkste bijproducten van o-xyleenoxidatie zijn maleïnezuur en ftalide, en de naftaleenoxidatie produceert daarnaast naftochinon, wat meer zuivering vereist.
3.1.3. Zuivering van ftaalzuuranhydride
Om na de eerste reactiefase ftaalzuuranhydride met een hoge zuiverheid te verkrijgen, ondergaat het ruwe product vaak een thermische behandeling vóór de destillatie om onzuiverheden te verwijderen.
Eenvoudige warmtebehandeling (100–400 °C) is geschikt voor producten met een lage onzuiverheid die zijn gemaakt van o-xyleen. De behandeling is gericht op het verwijderen van water, laagkokende verontreinigingen (maleïnezuuranhydride, o-tolualdehyde) en ftalide.
Ftaalzuuranhydride dat wordt geproduceerd door de oxidatie van naftaleen, heeft extra chemische behandeling nodig vanwege de aanwezigheid van naftochinon als bijproduct.
Verschillende chemicaliën kunnen worden gebruikt voor de eliminatie van naftochinon, waaronder zwavelzuur, natriumhydroxide, boorzuur/zwavelzuurmengsel, kaliumdisulfide, natriumcarbonaat, kaliummaleïnezuur en alifatische polydiënen.
Destillatie wordt gebruikt als de laatste zuiveringsfase voor ruw ftaalzuuranhydride.
Het destillatieproces (Figuur 1) omvat doorgaans een continu systeem met meerdere kolommen.
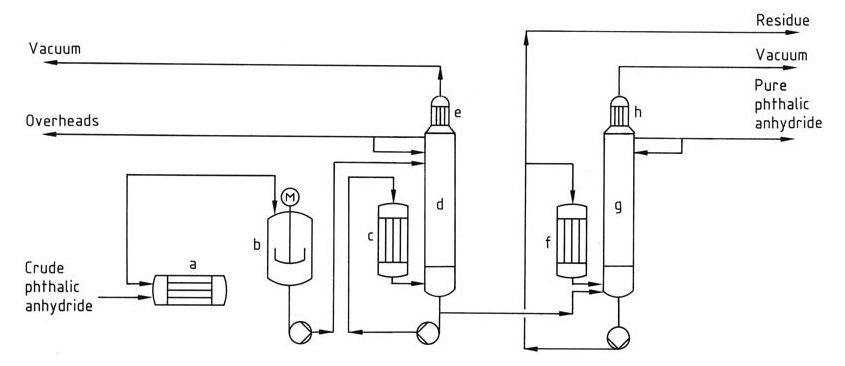
a) Verhitter voor ruw ftaalzuuranhydride; b) Voorontleder; c) Herverdamper; d) Stripperkolom; e) Condensor; f) Herverdamper; g) Destillatiekolom; h) Condensor
Eerst zet de predecomposer resterend ftaalzuur in het ruwe product om in ftaalzuuranhydride, en vervolgens concentreert en verwijdert de eerste kolom laagkokende onzuiverheden zoals maleïnezuuranhydride en benzoëzuur uit de kop. Tot slot zuivert de tweede kolom ftaalzuuranhydride door het te destilleren, terwijl het hoogkokende residu achterblijft.
3.2. Productie van ftaalzuuranhydride door oxidatie van naftaleen in een wervelbed
Ftaalzuuranhydride kan worden geproduceerd door oxidatie van naftaleen in een wervelbed. Een voorbeeld is het Badger-proces, dat nog steeds in gebruik is, en fabrieken die dit proces gebruiken, kunnen hun productiecapaciteit vergroten door zowel zuurstof als lucht te injecteren, wat een hogere naftaleenconcentratie mogelijk maakt.
Het vloeibare naftaleen wordt rechtstreeks geïnjecteerd en verdampt aan de onderkant van het bed om een gelijkmatige verdeling door de katalysator te garanderen en de atmosferische zuurstof wordt via een verdeelplaat aangevoerd om de reactie te vergemakkelijken.
Krachtige menging in het wervelbed handhaaft een uniforme temperatuur (345–385 °C) en de warmte die door de reactie wordt gegenereerd, wordt gebruikt voor hogedrukstoomproductie via koelbuizen.
Cyclonen en keramische filters worden gebruikt om de katalysator te scheiden en te recyclen, die kan worden geregenereerd met SO2.
Tot 60% van het ftaalzuuranhydride wordt teruggewonnen als vloeibaar condensaat, waarbij de rest wordt verkregen door desublimatie in schakelcondensatoren en uiteindelijk onder vacuüm wordt gedestilleerd om een zuiver product te produceren.
3.3. Productie van ftaalzuuranhydride door oxidatie van o-xyleen in de vloeistoffase
Ftaalzuuranhydride kan worden geproduceerd door oxidatie van o-xyleen in de vloeistoffase. In dit proces wordt een mengsel van azijnzuur, o-xyleen (>99% ortho-isomeergehalte vereist voor hoge opbrengst) en een op kobalt, mangaan en broom gebaseerde katalysator naar een cascadereactorsysteem gevoerd.
De reactie start onder druk met luchtinjectie en verloopt via volgende vaten. Water dat als bijproduct wordt gegenereerd, wordt in het eerste vat verwijderd door azeotropische destillatie met o-xyleen.
Ftaalzuurisomeren worden gescheiden en ftaalzuuranhydride wordt verkregen door kristallisatie. Vanwege de aanwezigheid van broom in de katalysator vereist het ruwe product een speciale voorbehandeling vóór de uiteindelijke zuivering door destillatie.
Sisas-proces is een proces in twee stappen dat oxidatie van o-xyleen in vloeibare fase tot ruw o-tolueenzuur omvat en ongereageerd o-xyleen wordt gerecycled. Vervolgens wordt het afgescheiden o-tolueenzuur geoxideerd in de gasfase om ftaalzuuranhydride te verkrijgen.
De totale molaire opbrengst van ftaalzuuranhydride op basis van o-xyleen kan oplopen tot 88%.
Het oxidatieproces in de vloeistoffase is een alternatief voor traditionele methoden, maar is niet wijdverbreid industrieel geaccepteerd vergeleken met katalytische oxidatie met een vast bed.
4. Toepassingen van ftaalzuuranhydride
De belangrijkste toepassing van ftaalzuuranhydride is de productie van weekmakers. De belangrijkste toepassingen van ftaalzuuranhydride zijn de productie van weekmakers (55%), onverzadigde polyesterharsen (14%), alkydharsen (15%) en andere chemische producten zoals kleurstoffen en pigmenten, detergenten, herbiciden en insecticiden, brandvertragers, sacharine en polyesterharsvernettingsmiddelen.
Het wordt wereldwijd veel gebruikt voor een extreem breed scala aan toepassingen, variërend van de kunststofindustrie tot de synthese van harsen, agrarische fungiciden en aminen.
5. Toxicologie van ftaalzuuranhydride
Ftaalzuuranhydride vertoont een lage acute toxiciteit, maar het kan bij inademing irritatie van de luchtwegen en sensibilisatie veroorzaken. Chronische blootstellingsstudies suggereren geen carcinogeen potentieel en beperkte gegevens over reproductietoxiciteit vereisen verder onderzoek.
Acute toxiciteit
Ftaalzuuranhydride vertoont een lage acute toxiciteit op basis van LD50-waarden:
- Oraal (rat): 1500–4000 mg/kg
- Inhalatie (rat): >210 mg/m³ h (stof)
- Dermaal (konijn): >10000 mg/kg
Huidcontact met ftaalzuuranhydride kan lichte irritatie veroorzaken, terwijl oogcontact irriterend is. Het kan ook huidsensibilisatie veroorzaken.
Subacute toxiciteit
Dieetblootstelling bij ratten (tot 3800 ppm) gedurende 28 dagen vertoonde geen significante effecten.
Gavage-onderzoeken bij ratten lieten nier- en maagmucosale toxiciteit zien bij doses van meer dan 1200 mg/kg/dag.
Inhalatieonderzoeken toonden ademhalingsirritatie bij verschillende dieren bij hoge concentraties (10000 mg/m³).
Herhaalde blootstelling door inademing (8,5 mg/m³) veroorzaakte irritatie van de luchtwegen en frequente longontstekingen bij ratten.
Genotoxiciteit
Er werden geen mutagene of chromosomale effecten waargenomen in in-vitrotests met en zonder metabolische activering.
Chronische toxiciteit en carcinogeniciteit
Langdurige dieetonderzoeken bij ratten en muizen bij hoge doses (tot 3600 mg/kg/dag) lieten geen verhoogde tumorvorming zien vergeleken met controles.
Reproductietoxiciteit
Beperkte studies met intraperitoneale injectie bij muizen suggereren potentiële misvormingsrisico’s bij hoge doses (≥55,5 mg/kg/dag) tijdens de zwangerschap. De blootstellingsroute en de dierlijke stam beperken echter de conclusie van deze bevindingen.
Referenties
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- Phthalic anhydride (PA): a valuable substrate in organic transformations. – https://pubs.rsc.org/en/content/articlehtml/2023/ra/d3ra03378c
- Process for the production of phthalic anhydride. – https://patents.google.com/patent/US4435580A/en
