Fenol: productie, reacties en toepassingen
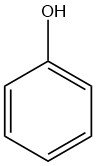
Wat is fenol?
Fenol, ook bekend als hydroxybenzeen, is een organische verbinding met de chemische formule C6H5OH. Het is een witte kristallijne vaste stof bij kamertemperatuur, maar fenol van technische kwaliteit kan vloeibaar zijn vanwege onzuiverheden. Het heeft een duidelijke geur, vaak beschreven als walgelijk zoet en teerachtig.
Fenol werd voor het eerst ontdekt in 1834 door RUNGE, die het met succes isoleerde uit steenkoolteer en het aanwees als carbolzuur.
Vervolgens verkreeg LAURENT het in kristalvorm in 1841, bepaalde de samenstelling ervan en noemde het aanvankelijk fenolzuur, wat later werd afgekort tot fenol.
In 1858 stelde KEKULE de moleculaire structuur van fenol voor. Vóór het einde van de 19e eeuw werd alle fenol gewonnen uit steenkool en voornamelijk gebruikt als ontsmettingsmiddel.
In 1897 voltooide HOFFMANN de eerste synthese van acetylsalicylzuur uit fenol in een zuivere en stabiele vorm. In de jaren 1900 steeg de vraag naar fenol met de commercialisering van fenolharsen na de Eerste Wereldoorlog, bisfenolen na de Tweede Wereldoorlog en polycarbonaten in de jaren 1960.
Inhoudsopgave
1. Productie van fenol
Fenol wordt industrieel geproduceerd via het Hock-proces, waarbij cumeen wordt geoxideerd. Het is het meest gebruikte synthetische pad, goed voor een productiesnelheid van meer dan 6,7 miljoen t/a fenol en ongeveer 4,1 miljoen t/a van het coproduct aceton. Het is een economisch concurrerend proces, ondersteund door de vraag naar aceton.
Omdat de vraag naar fenol naar verwachting in de toekomst nog sterker zal groeien, is er een voortdurende commerciële interesse in het ontdekken van nieuwe, coproductvrije technieken voor fenolsynthese, zoals de directe oxidatie van benzeen tot fenol.
De oxidatie van tolueen met benzoëzuur als tussenproduct wordt momenteel gebruikt voor de productie van fenol.
Desondanks wordt er nog steeds ongeveer 300.000 ton fenol uit steenkoolteer gewonnen.
Solutia heeft sinds ongeveer 1995 de directe oxidatie van benzeen tot fenol ontwikkeld met behulp van lachgas, hoewel deze aanpak nog niet op de markt is gebracht.
De conventionele synthetische routes, zoals het benzeensulfoneringsproces en de hydrolyse van chloorbenzeen met natronloog, zijn economisch niet langer belangrijk.
1.1. Productie van fenol door cumeenoxidatie (Hock-proces)
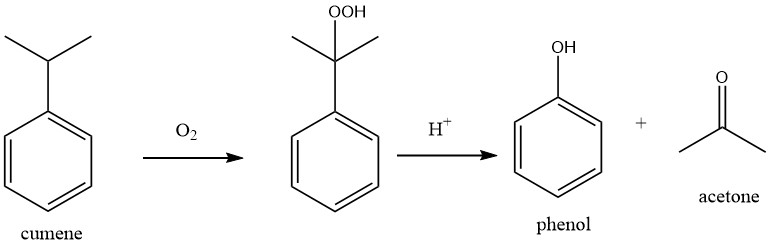
Het proces omvat twee fundamentele chemische reacties: cumeen wordt eerst onderworpen aan oxidatie met zuurstof om cumeenhydroperoxide (CHP) te produceren, dat vervolgens wordt gesplitst om fenol en aceton te vormen door een sterk mineraalzuur als katalysator te gebruiken.
Beide reacties worden gekenmerkt door een hoge exothermiciteit, met reactiewarmtes van -117 kJ/mol voor de oxidatie van cumeen en -252 kJ/mol voor de splitsing van het peroxide.
H. HOCK en S. LANG beschreven deze reacties voor het eerst in 1944. Het industriële cumeenoxidatieproces werd vervolgens ontwikkeld en gecommercialiseerd door The Distillers Co. in Groot-Brittannië en de Hercules Powder Company in de VS na de Tweede Wereldoorlog. In 1952 werd de eerste fabriek met een capaciteit van 8000 t/a opgericht in Shawinigan, Canada.
1.2. Productie van fenol door tolueenoxidatie
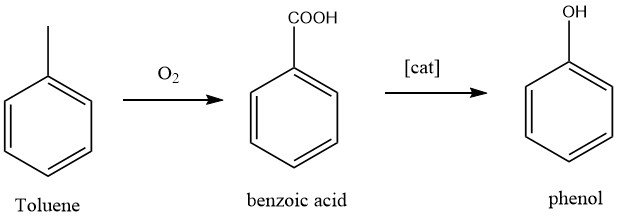
De California Research Corporation en Dow Chemical ontwikkelden een tweestapsproces voor de productie van fenol. In de eerste stap wordt tolueen geoxideerd tot benzoëzuur, een bekende reactie. In de tweede stap wordt benzoëzuur verder geoxideerd tot fenol.
De omzetting van tolueen in fenol is een volledige oxidatie van de methylgroep, resulterend in de bijproducten koolstofdioxide en water.
De oxidatie van tolueen wordt uitgevoerd in de vloeibare fase bij een temperatuurbereik van 100 – 150 °C en een manometerdruk van ongeveer 2 bar, met behulp van atmosferische zuurstof. De gebruikte oplosbare katalysator is kobaltnaftenaat in concentraties tussen 0,1 en 0,3%.
Het reactiemechanisme van de oxidatie van tolueen tot benzoëzuur is complex, met benzylalcohol en benzaldehyde als tussenproducten. Bijproducten zoals benzylbenzoaat en bifenyl worden gevormd, evenals mierenzuur, azijnzuur, koolstofdioxide en koolstofmonoxide.
Voor de oxidatie van benzoëzuur in de tweede stap wordt gesmolten benzoëzuur gebruikt als reactant en oplosmiddelmedium bij een temperatuur van ongeveer 230-240 °C bij atmosferische druk. Atmosferische zuurstof, stoom en oplosbaar koper(II)benzoaat worden gebruikt als katalysatoren, met magnesiumzouten toegevoegd als promotor.
Het netto resultaat van de gelijktijdige reacties in het systeem is de vorming van fenol.
Koper(II)benzoaat ontleedt thermisch tot koper(I)benzoaat en benzoylsalicylzuur, dat vervolgens wordt gehydrolyseerd tot benzoëzuur en salicylzuur in aanwezigheid van water of stoom. Het salicylzuur decarboxyleert snel om fenol en koolstofdioxide te geven.
Het Dow-proces werd gecommercialiseerd met de eerste fabriek die in het begin van de jaren 60 in Landar, British Columbia, werd opgestart, gevolgd door een tweede fabriek in Kalama, Washington, en een derde in Rosenburg, Nederland, die door DSM werd geëxploiteerd. In 1991 bracht Nippon Phenol een nieuwe fabriek online in Japan.
The Lummus Company introduceerde in 1978 een nieuw proces voor de oxidatie van benzoëzuur, uitgevoerd in de dampfase over een koperhoudende katalysator in een heterogene reactor.
Volgens Lummus produceert de reactie geen teer of niet-vluchtige residuen, waarschijnlijk vanwege de snelle verwijdering van fenol uit de reactiezone.
1.3. Fenol uit steenkool
Het terugwinnen van “natuurlijke” fenol uit steenkool is al lange tijd een commercieel proces voor de productie van fenol en wordt nog steeds beoefend. Dit proces is echter tegenwoordig onbelangrijk geworden als bron van fenol.
Fenol, evenals vele andere aromatische verbindingen, worden gewonnen uit de dampen van de carbonisatie van steenkool, waarbij steenkool wordt blootgesteld aan temperaturen boven 900 °C zonder lucht in een cokesoven, waardoor cokes als vast residu achterblijft en condenseerbare koolwaterstoffen en gassen als dampen.
De dampen worden gecondenseerd om steenkoolteer te vormen, dat kan worden gewassen met waterig zwavelzuur of fosforzuur om ammoniak terug te winnen, of gewassen met een wasolie om benzeen te verwijderen. Het resterende gas wordt ter plaatse als brandstof gebruikt en bestaat uit waterstof en methaan.
Continue distillatie wordt gebruikt om de steenkoolteer verder te verwerken. In de eerste kolom wordt lichte olie met benzeen, tolueen en xylenen gescheiden samen met water. In de tweede kolom wordt carbololie, die fenol en fenolische verbindingen bevat, gescheiden als de overhead, en wordt naftaleenolie als een zijsnede genomen.
Het onderste product van de tweede kolom wordt verder gefractioneerd om wasolie te produceren voor benzeenwinning uit het afgas, methylnaftaleenolie, antraceenolie en pek. Hoge refluxverhoudingen en een hoge mate van thermische integratie worden gebruikt met platenkolommen of kolommen met willekeurige pakkingen.
De carbololie, die ongeveer 2-3% van de steenkoolteer vormt en ongeveer 30-35% fenolische verbindingen zoals fenol en cresolen bevat, wordt onderworpen aan 8-9% natronloog in een extractie-eenheid. Fenol en cresolen, bekend als teerzuren, worden geëxtraheerd als zouten in de waterige fase. De ruwe fenolaatloog wordt stoomgedestilleerd om resterende koolwaterstoffen en pyridinebasen te scheiden.
De fenolaatloog wordt vervolgens behandeld met koolstofdioxide om de zure teersoorten uit hun zouten in de kolom te bevrijden. De waterige fase die natriumcarbonaat bevat, wordt verder behandeld om opgelost fenol te verwijderen.
De organische fase wordt door middel van batchdestillatie gefractioneerd in zuiver fenol (kookpunt: 181,8 °C), o-cresol (kookpunt: 191,0 °C), een mengsel van m- en p-cresolen (kookpunt: 202,0 – 203,0 °C) en een xylenolfractie (kookpunt tot 210 °C).
2. Chemische reacties van fenol
De chemische eigenschappen van fenol worden gekenmerkt door de wederzijdse invloed van de hydroxylgroep en de aromatische ring op elkaar.
2.1. Reacties met de O-H-binding
In tegenstelling tot alifatische alcoholen is fenol een zwak zuur en vormt het oplosbare zouten met sterke basen, wat nuttig is voor het terugwinnen ervan uit organische oplosmiddelen zoals steenkoolteer. De pKa-waarde in een waterige oplossing is 10,0. Het fenolaatanion wordt gestabiliseerd door het aromatische ringsysteem.
Fenol kan zelfs bij kamertemperatuur uit zijn zouten worden vrijgemaakt door behandeling met koolstofdioxide. Dicht bij het kookpunt kan fenol carbonzuren uit hun zouten verdringen om fenolaten te vormen.
De hydroxylgroep kan eenvoudig worden veresterd (bijv. tot fenylacetaat) of veretherd (bijv. difenylether).
2.2. Reacties van de aromatische ring
Het elektronenpaar in fenol is gedelokaliseerd over de aromatische ring, wat zorgt voor de zuurgraad. De overtollige elektronen in de ortho- en paraposities maken fenol zeer gevoelig voor elektrofiele substitutie. Bijvoorbeeld, broom in waterige oplossing reageert met fenol om 2,4,6-tribroomfenol te produceren in hoge opbrengst.
De Kolbe-reactie is een andere belangrijke reactie, waarbij koolstofdioxide wordt gekoppeld aan natriumfenoxide bij 125 °C om natriumsalicylaat te geven. Bij 125 °C substitueert koolstofdioxide in de orthopositie, terwijl bij temperaturen boven 250 °C de para-isomeer de voorkeur krijgt.
Andere reacties na elektrofiele substitutie zijn onder meer chlorering, sulfonering en nitrering.
2.3. Oxidatie in vloeibare fase
Oxidatie van organische stoffen door moleculaire zuurstof genereert verschillende tussenproducten, zoals cumeenhydroperoxide. Deze processen volgen een complex radicaalmechanisme.
Fenol kan dergelijke reacties remmen door te reageren met vrije radicalen om fenoxyradicalen te vormen, die relatief stabiel zijn en het ketenmechanisme niet voortplanten. Daarom moet elke indringing van fenol in oxidatieprocessen worden vermeden.
3. Toepassingen van fenol
De wereldwijde productiecapaciteit van fenol bedraagt meer dan 9 miljoen ton. Bisfenol A, een belangrijk derivaat van fenol, is goed voor ongeveer 37% van de wereldwijde productie.
Bisfenol A wordt veel gebruikt bij de productie van hoogwaardige polycarbonaten voor toepassingen in de automobielindustrie, cd’s en beglazing, evenals bij de productie van epoxyharsen.
De op één na grootste toepassing van fenol is de productie van fenolharsen met formaldehyde. Deze harsen worden voornamelijk gebruikt voor toepassingen in de onderafdichting in de automobielindustrie.
Daarnaast wordt fenol gebruikt voor de synthese van caprolactam door gebruik te maken van de cyclohexanol–cyclohexanonroute.
Er worden verschillende andere derivaten van fenol geproduceerd, waaronder alkylfenolen, difenolen, aniline en salicylzuur.
Omdat de automobielsector een belangrijke consument is van fenolderivaten, zoals polycarbonaten en fenolharsen, is de vraag naar fenol nog steeds grotendeels gebonden aan deze markt, die doorgaans cyclisch is.
Referentie
- Phenol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a19_299.pub3
