Ethanol: Eigenschappen, Reacties, Productie en Toepassingen
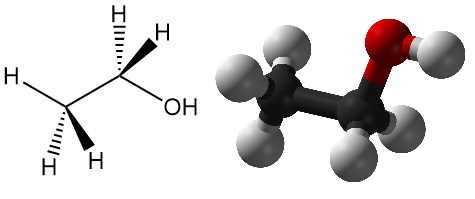
Wat is ethanol?
Ethanol, ook bekend als ethylalcohol, is een van de belangrijkste alcoholen, met de chemische formule CH3CH2OH. Het is een kleurloze, vluchtige vloeistof met een karakteristieke geur en wordt veel gebruikt in een breed scala aan toepassingen. Andere namen voor ethanol zijn alcoholspirit, wijnspirit, graanalcohol, absolute alcohol en ethylhydraat.
De term “alcohol” is afkomstig van de Arabische woorden “al” en “kohl”, verwijzend naar een fijngemalen antimoonpoeder dat wordt gebruikt voor cosmetische doeleinden. In de loop van de tijd evolueerde de betekenis om een hoge mate van fijnheid of zuiverheid aan te duiden, en werd uiteindelijk specifiek voor ethanol, “wijnspirit die tot de hoogste graad is gerectificeerd.”
Ethylalcohol is een bekend bestanddeel van alcoholische dranken, die worden geproduceerd door de fermentatie van fermenteerbare koolhydraten. De fermentatiebouillon zelf kan worden geconsumeerd als een drankje, zoals in het geval van bier of wijn, of de alcohol kan worden geconcentreerd om sterke drank te produceren met een hoger alcoholpercentage.
Bier bevat normaal gesproken 4-6% ethanol per volume, wijn bevat 12-14% en sterke drank kan variëren van 30-50% per volume. Andere alcoholische dranken hebben verschillende hoeveelheden ethanol.
Voor industriële en commerciële toepassingen anders dan alcoholische dranken, wordt ethanol gedenatureerd door stoffen toe te voegen zoals methanol, pyridine, formaldehyde of sublimaat. Gedenatureerde ethanol wordt gebruikt als oplosmiddel, grondstof voor chemische productie en brandstof.
De geschiedenis van ethanol gaat terug tot de oudheid. Gefermenteerd bier werd geconsumeerd in Babylon, terwijl de wijnproductie teruggaat tot ongeveer 3000 v.Chr. in het oude Egypte, waar het werd bereid en geconsumeerd door de farao’s.
Het distillatieproces is waarschijnlijk ontstaan tussen de 10e en 14e eeuw. In deze tijd werden de “spirituele” effecten van ethanol erkend, wat leidde tot de term “spiritus” voor alcoholische dranken. Vroege wijndistillaten werden voornamelijk gebruikt voor medicinale doeleinden.
Tot de 17e eeuw werd alcoholische fermentatie beschouwd als een bederfproces. De aard van fermentatie werd voor het eerst opgehelderd in de 19e eeuw met de ontdekking van de microscoop, die gistcellen onthulde als levende organismen. Het duurde echter ongeveer 150 jaar om de rol van deze organismen in het fermentatieproces te erkennen.
Inhoudsopgave
1. Fysieke eigenschappen van ethanol
Zuivere ethanol (absolute alcohol) is een vluchtige, ontvlambare, heldere en kleurloze vloeistof met een aangename geur. Het is mengbaar met water, ether, aceton, benzeen en enkele andere organische oplosmiddelen. Watervrije ethanol is hygroscopisch.
Ethanol vormt een azeotropisch mengsel met water, dat 95,57 gew.% ethanol en 4,43 gew.% water bevat. Daarom is de hoogste concentratie ethanol die kan worden verkregen door destillatie van een ethanol-watermengsel 95,57 gew.%. Azeotropische destillatie, met behulp van een tertiair oplosmiddel (bijv. benzeen), moet worden geïntroduceerd om absolute (watervrije) ethanol te produceren.
De belangrijke fysieke eigenschappen van watervrije ethanol worden vermeld in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| CAS-nummer | [64-17-5] |
| Chemische formule | C2H5OH |
| Moleculair gewicht | 46,7 g/mol |
| Vriespunt | -114,1 °C |
| Kookpunt | 78,32 °C |
| Kritische temperatuur | 243,1 °C |
| Kritische druk | 6383,48 kPa |
| Kritisch volume | 0,167 l/mol |
| Dichtheid | 0,7893 g/ml |
| Breukindex | 1,36143 |
| Oppervlaktespanning (bij 25 °C) | 23,1 mN/m |
| Viscositeit (bij 20 °C) | 1,17 mPa·s |
| Oplosbaarheid in water (bij 20 °C) | Mengbaar |
| Verdampingswarmte (bij normaal kookpunt) | 839,31 J/g |
| Verbrandingswarmte (bij 25 °C) | 29676,69 J/g |
| Smeltwarmte | 104,6 J/g |
| Brandgrenswaarden in lucht | Laag: 4,3 vol % Hoog: 19,0 vol % |
| Zelfontbrandingstemperatuur | 423 °C |
| Vlampunt | 14 °C (gesloten beker) |
| Soortelijke warmte (bij 20 °C) | 2,42 J/(g·°C) |
| Thermische geleidbaarheid (bij 20 °C) | 0,170 W/(m·K) |
| Dipoolmoment (vloeistof bij 25 °C) | 5,67 × 10-30 |
| Magnetische gevoeligheid (bij 20 °C) | 0,734 × 10-6 |
| Diëlektrische constante (bij 20 °C) | 25,7 |
2. Chemische reacties van ethanol
De chemische reactiviteit van ethanol wordt voornamelijk beïnvloed door de hydroxylgroep (-OH), die deelneemt aan talrijke industrieel belangrijke reacties zoals dehydratie, halogenering, estervorming en oxidatie.
Het waterstofatoom van de hydroxylgroep kan worden vervangen door een actief metaal, zoals natrium, kalium of calcium, om metaalethoxiden (ethylaten) te vormen met de ontwikkeling van waterstofgas.
CH3CH2OH + M → CH3CH2OM + 1/2 H2
Natriumethoxide, een veelgebruikt metaalethoxide, kan worden bereid door de reactie van absolute ethylalcohol met natrium of door absolute ethylalcohol te refluxen met watervrij natriumhydroxide. Commercieel gezien wordt water uit het reactiemengsel verwijderd door middel van azeotrope destillatie met benzeen.
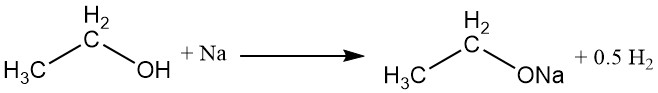
Natriumethoxide hydrolyseert gemakkelijk tot ethylalcohol, natriumionen en hydroxide-ionen.
Natriumethoxide wordt gebruikt als condensatie- en reductiemiddel bij organische synthese. Het reageert met zwavelmonochloride om di-ethylthiosulfiet te produceren. Daarnaast is natriumethoxide een reagens voor de commerciële productie van barbituraten, ethylorthoformiaat en andere chemicaliën.
Aluminium en magnesium kunnen ook reageren met ethanol om ethoxiden te vormen, maar deze reactie vereist katalyse door het metaal te amalgameren.
Goed gereinigde aluminiumvijlsels reageren met ethanol bij kamertemperatuur in aanwezigheid van kwikchloride. Deze reactie kan worden uitgevoerd in een autoclaaf bij verhoogde temperaturen zonder katalysator of met de toevoeging van natriumethoxide.
De hydroxylgroep van ethanol kan ook deelnemen aan andere reacties, zoals de ringopening van epoxiden om hydroxyethers te vormen en de toevoeging aan acetyleen om ethylvinylether te vormen. Deze reacties worden gekatalyseerd door zowel zure als basische omstandigheden.
De zuurgekatalyseerde additie van ethanol aan acetyleen of vinylether produceert acetalen, die ook worden geproduceerd door de zuurgekatalyseerde reactie van ethylalcohol met een aldehyde of keton.
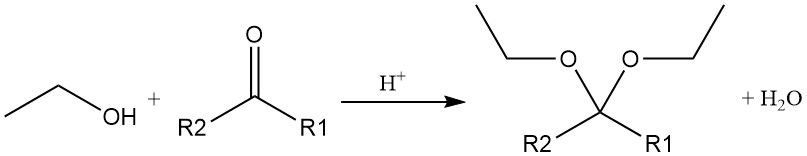
De hydroxylgroep kan worden vervangen door halogenen van anorganische zuurhaliden of fosforhaliden, wat leidt tot de vorming van ethylesters van het zuur en een ethylhalide. Fosfortrichloride en thionylchloride worden vaak gebruikt om ethylchloride te produceren, met triethylfosfiet en di-ethylsulfiet als bijproducten.
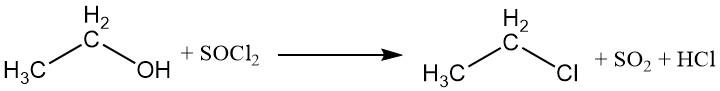
Halogeenzuren kunnen ook reageren met ethanol om alkylhaliden te produceren. De reactiviteit van de halogeenzuren varieert, waarbij waterstofjodide het meest reactief is. Ethylchloride kan worden bereid door de reactie tussen ethanol en waterstofchloride.
CH3CH2OH + HX → CH3CH2X + H2O
De reactie van ethanol met waterstofbromide levert ethylbromide op, wat een voorloper is voor het ethyl-Grignard-reagens en verschillende ethylamines (monoethylamine, diethylamine en triethylamine).
2.1. Verestering
Ethanol reageert met anorganische en organische zuren, zuuranhydriden en zuurhalogeniden om esters te produceren. Als een anorganisch zuur dat zuurstof bevat, zoals zwavelzuur of salpeterzuur, reageert met ethylalcohol, bevat de resulterende ester een koolstof-zuurstofbinding die kan worden gehydrolyseerd.
Organische esters worden gevormd door een dehydratatiereactie tussen ethanol en een organisch zuur. Deze reactie is omkeerbaar en bereikt langzaam evenwicht. Zure katalysatoren zoals zwavelzuur, zoutzuur, boortrifluoride en p-tolueensulfonzuur worden vaak gebruikt om het veresteringsproces te versnellen.
Ethanol reageert ook met zuuranhydriden of zuurhalogeniden om de overeenkomstige esters te vormen.
De directe omzetting van ethanol in ethylacetaat vindt naar men aanneemt plaats via aceetaldehyde en de daaropvolgende condensatie (Tishchenko-reactie). Een ethylacetaatopbrengst van ongeveer 24% kan worden bereikt met behulp van een koperoxidekatalysator die 0,1-0,2% thoria bevat bij 350 °C.
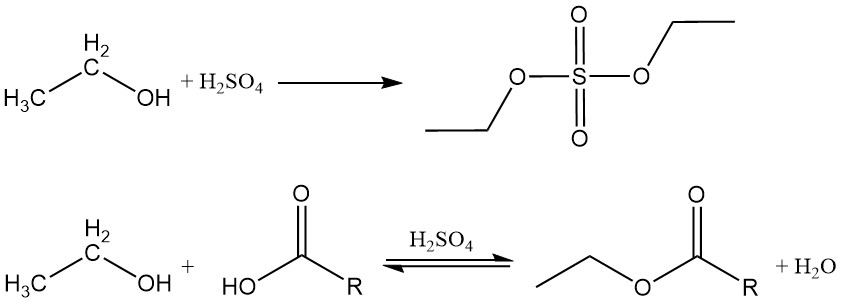
2.2. Dehydratie
Ethanol kan worden gedehydreerd om ethyleen of ethylether te produceren. Het specifieke gevormde product is afhankelijk van de reactieomstandigheden.
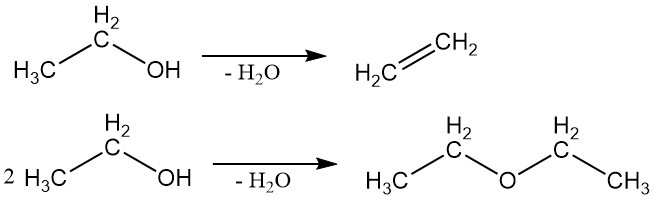
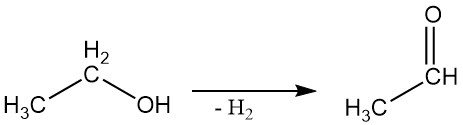
2.3. Dehydrogenering
Ethylalcohol kan worden gedehydrogeneerd tot acetaldehyde in een dampfasereactie met behulp van geschikte katalysatoren.
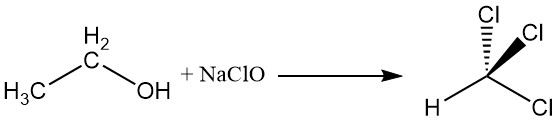
2.4. Haloformreactie
Ethylalcohol reageert met natriumhypochloriet om chloroform te produceren, een reactie die bekend staat als de haloformreactie.
3. Industriële productie van ethanol
Ethanol wordt geproduceerd door zowel synthetische als fermentatieprocessen. Een van de eerste synthetische routes betrof de reactie van ethyleen met zwavelzuur, een proces dat meer dan een eeuw geleden werd ontdekt.
De industriële productie van synthetische ethanol werd echter pas economisch haalbaar in de jaren 30, toen de Carbide and Chemical Corporation het indirecte hydratatieproces ontwikkelde.
Dit proces, waarbij ethyleen in zwavelzuur werd geabsorbeerd gevolgd door hydrolyse, is sindsdien grotendeels vervangen door de directe katalytische hydratatie van ethyleen, geïntroduceerd door Shell Chemical Company in 1948.
In de afgelopen decennia zijn er alternatieve methoden voor ethanolsynthese ontstaan, waarbij gebruik wordt gemaakt van op steenkool gebaseerde uitgangsmaterialen zoals methanol of synthesegas. Deze processen omvatten homologatie, carbonylering en de directe omzetting van synthesegas in ethanol.
Fermentatie van suiker, zetmeel of cellulose blijft echter de overheersende methode voor ethanolproductie, goed voor maximaal 90% van de wereldwijde productie.
3.1. Productie van ethanol door directe katalytische hydratatie van ethyleen
De hydratatie van ethyleen tot ethanol is een omkeerbare reactie. De evenwichtsconstante voor deze reactie wordt beïnvloed door temperatuur en druk. Hogere temperaturen bevorderen een hogere ethyleenconversie, maar verhogen ook de snelheid van nevenreacties, zoals de vorming van di-ethylether.
Kinetische studies zijn uitgevoerd op verschillende katalysatoren, waaronder fosforzuur-silicagel en blauw wolfraamoxide-silicagel. Deze studies hebben inzicht gegeven in de activeringsenergie en reactiesnelheid onder verschillende omstandigheden.
Verschillende procesvariabelen, waaronder druk, temperatuur en de molaire verhouding water-ethyleen, hebben invloed op de ethyleenconversie. Onder typische reactoromstandigheden (ongeveer equimolaire ethyleen-watertoevoer, 250–300 °C, 5–8 MPa) varieert de evenwichtsconversie van ethyleen van 7 tot 22%.
Naast de gewenste hydratatiereactie kunnen er nevenreacties optreden, die leiden tot de vorming van bijproducten. Bij lagere temperaturen kan di-ethylether worden geproduceerd, terwijl bij hogere drukken polymerisatie van ethyleen tot butenen en hogere olefinen kan plaatsvinden.
Het voorgestelde mechanisme voor ethyleenhydratatie omvat vier stappen:
- Een proton wordt toegevoegd aan het ethyleenmolecuul om een π-complex te vormen.
- Het π-complex wordt omgezet in een carbocation.
- Een watermolecuul wordt toegevoegd aan het carbocation.
- Een proton wordt verwijderd uit de geprotoneerde ethanol om ethanol te verkrijgen.
Katalysatoren
De hydratatie van ethyleen tot ethanol wordt over het algemeen gekatalyseerd door zure katalysatoren. Fosforzuur ondersteund op verschillende materialen, waaronder diatomeeënaarde (kieselgoer, celite), montmorilloniet, bentoniet, silicagel en opoka, is een van de meest gebruikte katalysatoren voor deze reactie.
Naast fosforzuur-gebaseerde katalysatoren zijn andere katalysatoren onderzocht, zoals zure oxiden, heteropolyzuren, zeolieten en zouten. Deze materialen bieden potentiële voordelen in termen van activiteit, selectiviteit en stabiliteit.
Onder reactieomstandigheden moet de drager bestand zijn tegen fosforzuur, maar het in grote hoeveelheden kunnen vasthouden; het moet ook voldoende mechanische sterkte en een voldoende lange levensduur hebben; en uiteindelijk moet het een actieve, selectieve katalysator voor de hydratatie bieden.
Om de katalysatorprestaties te optimaliseren, wordt de drager voorbehandeld met minerale zuren, zoals zoutzuur of zwavelzuur, om onzuiverheden zoals ijzer en aluminium te verwijderen, en geïmpregneerd met 50 tot 77% fosforzuur.
Warmtebehandeling bij verhoogde temperaturen (700–1100 °C) wordt vaak gebruikt om de binding van fosforzuur aan de drager te verbeteren. Hoewel deze behandeling de initiële activiteit en selectiviteit van de katalysator enigszins kan verminderen, kan het de stabiliteit en duurzaamheid op de lange termijn aanzienlijk verbeteren.
Productieproces
De katalytische hydratatie van ethyleen tot ethanol omvat een reeks stappen, zoals geïllustreerd in Figuur 1.
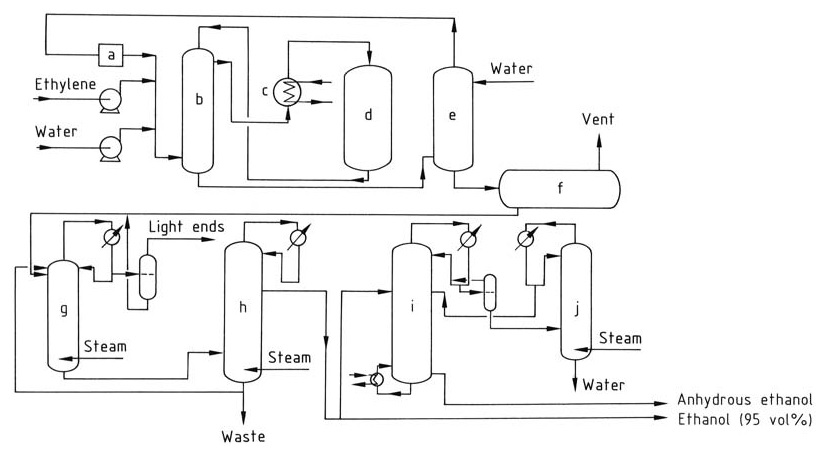
a) Circulatiecompressor; b) Warmtewisselaar; c) Oververhitter; d) Reactor; e) Wasmachine; f) Ruwe ethanoltank; g) Extractieve destillatiekolom; h) Concentratiekolom; i) Dehydratie; j) Concentratiekolom
Ethyleen en gedemineraliseerd water, in een molaire verhouding van 1:0,3 tot 1:0,8, worden verhit tot 250–300 °C bij 6–8 MPa door een warmtewisselaar en een oververhitter te passeren. De reactie is exotherm, waarbij warmte vrijkomt die kan worden teruggewonnen en gebruikt om de toevoerstroom voor te verwarmen.
De gasstroom wordt gewassen met water om eventuele resterende ethanol te verwijderen. Het gezuiverde gas wordt vervolgens opnieuw gecomprimeerd en teruggevoerd naar de reactor om de gewenste ethyleenconcentratie te behouden.
De reactieproducten worden gekoeld en gecondenseerd om de vloeibare en gasvormige fasen te scheiden. Het ruwe ethanolproduct dat in de wasbak wordt verzameld, bevat ongeveer 10–25% ethanol op gewicht en wordt verder gezuiverd door destillatie om een 95% ethanol-waterazeotroop te verkrijgen.
Om watervrije ethanol te produceren, kan de 95% ethanol worden gedehydrateerd met behulp van azeotropische destillatie.
Tijdens de katalytische hydratatie van ethyleen kan een deel van de fosforzuurkatalysator worden meegevoerd door de gasstroom. Om zuurophoping in de stroomafwaartse apparatuur te voorkomen, wordt een verdunde natriumhydroxideoplossing geïnjecteerd om het te neutraliseren.
Het fosforzuur dat verloren gaat door meevoering en verdamping, wordt aangevuld door het periodiek op het katalysatorbed te spuiten om een consistente katalysatorconcentratie te garanderen gedurende het hele reactieproces.
Di-ethylether, ongeveer 2%, is een veelvoorkomend bijproduct van de reactie en kan worden teruggewonnen en gezuiverd voor afzonderlijk gebruik of worden gerecycled naar de reactor. Acetaldehyde, een potentiële onzuiverheid, wordt omgezet in ethanol door hydrogenering om de vorming van ongewenste verbindingen zoals crotonaldehyde te voorkomen.
De procesapparatuur bestaat uit reactoren, warmtewisselaars, destillatiekolommen en bijbehorende leidingen. Reactoren zijn doorgaans gemaakt van staal met een koper- of koolstofvoering om te beschermen tegen corrosie door fosforzuur. Warmtewisselaars en leidingen die worden blootgesteld aan fosforzuur zijn ook gemaakt van koper of koperlegeringen.
Het proces genereert minimale afval. Afgevoerd etheen, dat minder dan 15% van de totale voeding uitmaakt, kan worden teruggevoerd naar de etheenfabriek of worden verbrand. Afvalwater van destillatie heeft een laag gehalte aan organische verbindingen en fosfaat (ongeveer 0,3 kg Na2HPO4 per kubieke meter) en kan eenvoudig worden afgevoerd.
3.2. Productie van ethanol door indirecte hydratatie van etheen
De indirecte hydratatie van etheen met behulp van zwavelzuur omvat twee primaire stappen: de absorptie van etheen en de hydrolyse van het geproduceerde sulfaat.
Etheen reageert met geconcentreerd zwavelzuur om ethylwaterstofsulfaat en di-ethylsulfaat te vormen, die vervolgens worden gehydrolyseerd met water om ethanol en di-ethylether te produceren.
Kinetische studies hebben aangetoond dat de absorptie- en hydrolysestappen een soortgelijk reactiemechanisme volgen als het directe hydratatieproces, maar worden beïnvloed door de oplosbaarheid van ethyleen in zwavelzuur.
De eindproducten van het indirecte hydratatieproces zijn ethanol en di-ethylether (5-10%). De opbrengst van di-ethylether kan worden gecontroleerd door de reactieomstandigheden aan te passen, zoals de verhouding van ethyleen tot zwavelzuur en de hydrolyseomstandigheden.
De ethylsulfaten kunnen worden getransesterificeerd met azijnzuur bij 104 °C om ethylacetaat te produceren. Ethylacetaat wordt vervolgens gewonnen door destillatie en gehydrolyseerd tot ethanol en azijnzuur. Dit proces biedt een voordeel ten opzichte van de traditionele hydrolysemethode door de noodzaak van zwavelzuurherconcentratie te vermijden.
Productieproces
Figuur 2 toont het stroomschema voor de productie van ethanol door indirecte hydratatie van ethyleen.
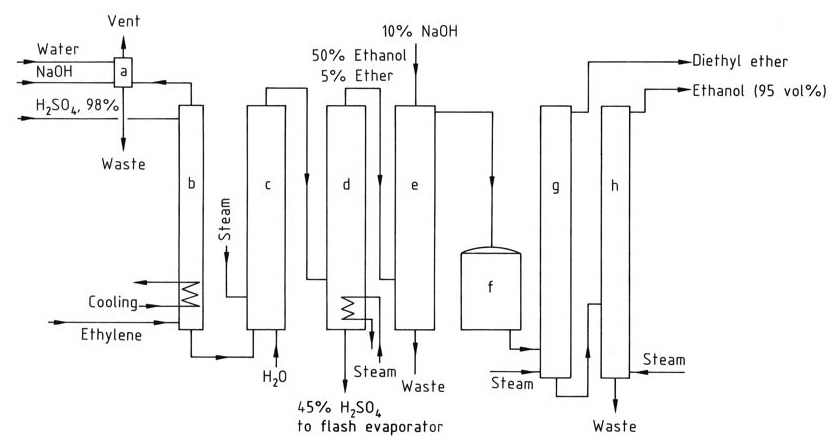
a) Waskolom voor restgas; b) Absorber; c) Hydrolyser; d) Stripkolom; e) Waskolom voor ruwe ethanol; f) Tank voor ruwe producten; g) Di-ethyletherdestillatiekolom; h) Ethanoldestillatiekolom
Het voedingsgas voor het indirecte hydratatieproces moet minimaal 35% ethyleen bevatten en mag geen hogere homologen bevatten die harsvorming kunnen veroorzaken. Inerte gassen zoals methaan en ethaan kunnen worden toegevoegd.
De absorptie van ethyleen neemt toe met de druk, die over het algemeen tussen 1 en 3,5 MPa ligt. Elke mol zwavelzuur kan tot 1,4 mol ethyleen absorberen. De absorptie wordt uitgevoerd in wastorens bij 65-85 °C, en temperaturen boven 90 °C moeten worden vermeden om harsvorming te voorkomen.
Het geabsorbeerde ethyleen reageert met zwavelzuur om ethylsulfaten te vormen na enkele uren roeren. De hydrolyse van deze sulfaten wordt uitgevoerd in twee fasen: een hydrolyse bij lage temperatuur (70 °C) om di-ethylsulfaat om te zetten en een daaropvolgende hydrolyse bij hoge temperatuur (100 °C) gedurende ongeveer 1 uur om de reactie te voltooien.
Het zwavelzuur wordt verdund tot 40-55 gew.% en ethanol en di-ethylether worden uit het reactiemengsel gewonnen via een stripkolom. Het productmengsel wordt vervolgens geneutraliseerd met natriumhydroxide en de di-ethylether wordt verwijderd in een aparte destillatiekolom.
De ethanol wordt verder gezuiverd door destillatie om een 95% ethanol-waterazeotroop te verkrijgen.
Het opnieuw concentreren van het verdunde zwavelzuur is een dure stap in het indirecte hydratatieproces, gekenmerkt door een hoog energieverbruik, corrosieproblemen en oxidatie van organische verbindingen (de vorming van teer).
Om deze uitdagingen te overwinnen, kan het werken bij lagere drukken onder 0,5 MPa en het toevoegen van zilversulfaat tot 7% aan het zwavelzuur de procesefficiëntie verbeteren en de reconcentreringsvereisten verminderen.
De keuze van bouwmaterialen is afhankelijk van de specifieke processtappen. Staal wordt vaak gebruikt voor absorptie- en destillatieapparatuur. Lood en zuurbestendige materialen zijn geschikt voor hydrolyse, terwijl silumin, tantaal, gietijzer en lood worden gebruikt voor zwavelzuurreconcentrering.
3.3. Andere methoden
Er zijn andere methoden ontwikkeld voor het synthetiseren van ethanol uit methanol en synthesegas. Deze processen zullen in de toekomst waarschijnlijk van industrieel belang zijn, omdat ze gebruikmaken van uitgangsmaterialen die beschikbaar zijn uit steenkool en niet afkomstig zijn van aardolie.
3.3.1. Homologatie van methanol
Homologatie, een proces waarbij de koolstofketen van een alcohol met één koolstofatoom wordt verlengd, is onderzocht als een alternatieve route voor ethanolsynthese. Methanol kan reageren met synthesegas (CO + H2) in aanwezigheid van een kobaltcarbonylkatalysator om ethanol te produceren.
Vroege pogingen tot methanolhomologatie resulteerden in lage ethanolopbrengsten en complexe productmengsels. Vooruitgang in katalysatorontwerp en reactieomstandigheden hebben echter de selectiviteit voor ethanol verbeterd.
Uit onderzoek is gebleken dat het gebruik van tetrahydrofuran als oplosmiddel of het toevoegen van jodium of jodide met organische fosfines de ethanolselectiviteit kan verbeteren.
3.3.2. Carbonylering van methanol en methylacetaat
Een andere aanpak voor het produceren van ethanol is de carbonylering van methanol tot azijnzuur, gevolgd door hydrogenering. Deze methode is gebaseerd op het Monsanto-proces voor de synthese van azijnzuur, waarbij een rhodiumcarbonyl-jodiumkatalysator wordt gebruikt.
Hoewel directe hydrogenering van azijnzuur tot ethanol mogelijk is, is hiervoor hogedrukapparatuur nodig en kan het corrosief zijn. Een meer praktische methode is de verestering van azijnzuur met ethanol om ethylacetaat te vormen, gevolgd door hydrogenolyse van ethylacetaat tot ethanol.
Er zijn verschillende variaties van het carbonyleringsproces ontwikkeld, waaronder het gebruik van methylacetaat als uitgangsmateriaal. Methylacetaat kan worden gecarbonyleerd tot azijnzuuranhydride, dat vervolgens reageert met ethanol en methanol om ethyl- en methylacetaten te produceren. Het ethylacetaat kan vervolgens worden gehydrogenolyseerd tot ethanol.
3.3.3. Omzetting van synthesegas in ethanol
Synthese door heterogene katalyse
Pogingen om synthesegas (CO + H2) om te zetten in ethanol hebben zich gericht op het aanpassen van bestaande katalysatoren die worden gebruikt voor methanolsynthese. Studies hebben aangetoond dat het toevoegen van alkalimetalen, kobalt of andere elementen de ethanolopbrengst kan verbeteren.
Onderzoeksinstellingen zoals het Institut Français du Pétrole hebben complexe katalysatoren ontwikkeld die meerdere elementen bevatten, waaronder koper, kobalt, chroom, kalium, lanthaan en andere. Deze katalysatoren kunnen alcoholmengsels produceren die een aanzienlijke hoeveelheid ethanol, methanol en hogere alcoholen bevatten.
Katalysatoren van platinagroepmetalen, zoals rhodium en lanthaantrioxide, hebben ook veelbelovende resultaten opgeleverd bij het omzetten van synthesegas in ethanol. Deze katalysatoren kunnen hoge ethanolselectiviteiten bereiken bij 200–240 °C en atmosferische drukomstandigheden.
Synthese door homogene katalyse
Homogene katalyse met rutheniumcomplexen is onderzocht voor de omzetting van synthesegas in ethanol. Rutheniumkatalysatoren kunnen in combinatie met organische fosforverbindingen ethanolselectiviteiten van meer dan 50% bereiken.
Verschillende oplosmiddelen en additieven, zoals tripropylfosfineoxide, tetrabutylfosfoniumbromide en alkyltrifenylfosfoniumbromiden, zijn onderzocht om de ethanolproductie te optimaliseren.
3.4. Productie van ethanol door fermentatie
Fermentatie, een biosyntheseproces, wordt al eeuwenlang gebruikt om verschillende producten te produceren, waaronder ethanol. Hoewel maïs de afgelopen decennia de belangrijkste grondstof is geweest, kunnen ook andere landbouwmaterialen, zoals melasse, granen, suikerriet, bieten, fruit, wei en sulfietafvalvloeistof, worden gebruikt.
Er wordt onderzoek gedaan naar de haalbaarheid van het fermenteren van afvalstoffen zoals vuilnis.
De geschiktheid van verschillende grondstoffen voor ethanolproductie hangt af van factoren zoals beschikbaarheid, kosten, suikergehalte en ethanolopbrengst. Sommige landbouwproducten, zoals aardappelen, kunnen economisch minder aantrekkelijk zijn vanwege de lage ethanolopbrengst en hoge transportkosten.
Fermenteerbare materialen kunnen grofweg worden onderverdeeld in drie typen:
- Suikers: Directe fermentatie van suikers verkregen uit suikerriet, suikerbieten, melasse of fruit is mogelijk.
- Zetmeel: Zetmeel uit granen, aardappelen of wortelgewassen vereist hydrolyse tot fermenteerbare suikers met behulp van enzymen uit mout of schimmels.
- Cellulose: Celluloserijke materialen, waaronder hout, landbouwresten en sulfietafvalvloeistof, moeten vóór de fermentatie worden omgezet in suikers met behulp van minerale zuren.
Fermentatie is de omzetting van suikers in ethanol en koolstofdioxide onder anaërobe omstandigheden. Hoewel verschillende micro-organismen suikers kunnen fermenteren, worden gisten, met name Saccharomyces cerevisiae, veel gebruikt vanwege hun hoge ethanoltolerantie en efficiëntie.
De fermentatie van glucose verloopt via het glycolysepad, een reeks enzymatische reacties die glucose afbreken tot pyruvaat, waarbij ATP (adenosinetrifosfaat) als energie wordt geproduceerd. Onder anaërobe omstandigheden wordt pyruvaat omgezet in acetaldehyde, dat vervolgens door alcoholdehydrogenase wordt gereduceerd tot ethanol.
Optimale fermentatieomstandigheden variëren afhankelijk van de giststam, grondstof en gewenste productspecificaties. Belangrijke factoren die de fermentatie beïnvloeden zijn:
- Temperatuur: De meeste gisten prefereren een temperatuurbereik van 25–30 °C voor optimale groei en ethanolproductie.
- pH: De pH moet binnen een specifiek bereik worden gehouden, meestal tussen 4,5 en 5,5, om optimale gistactiviteit te garanderen en bacteriële besmetting te voorkomen.
- Beschikbaarheid van voedingsstoffen: Gisten hebben een evenwichtige toevoer van voedingsstoffen nodig, waaronder stikstof, fosfor en micronutriënten, voor groei en efficiënte fermentatie.
- Suikerconcentratie: De suikerconcentratie moet binnen een geschikt bereik worden gehouden om remming van de gistgroei en ethanolproductie te voorkomen. Overmatige suikerconcentraties kunnen leiden tot osmotische stress en verminderde fermentatie-efficiëntie.
Fermentatie kan worden uitgevoerd in batch- of continue processen. Bij batchfermentatie wordt een bepaald volume medium met suiker en voedingsstoffen geënt met gist en mag het fermenteren tot de gewenste ethanolconcentratie is bereikt.
Bij continue fermentatie wordt een constante stroom medium in een fermentor gevoerd terwijl de gefermenteerde bouillon continu wordt verwijderd, wat zorgt voor een efficiëntere en consistentere ethanolproductie.
Er kunnen zich verschillende uitdagingen voordoen tijdens de fermentatie, waaronder bacteriële of schimmelverontreiniging en remming van gistactiviteit door hoge ethanolconcentraties, accumulatie van bijproducten en beperking van voedingsstoffen.
4. Toepassingen van ethanol
Ethanol wordt al sinds de oudheid gebruikt voor een breed scala aan toepassingen. Het wordt gebruikt als een component van alcoholische dranken, een oplosmiddel, een grondstof voor chemische synthese en een brandstof.
Historisch gezien werd ethanol afkomstig van fermentatie voornamelijk gebruikt voor dranken en speciale chemicaliën, terwijl chemisch gesynthetiseerde ethanol werd gebruikt voor de industrie. Bepaalde landen, zoals Brazilië en India, gebruiken echter fermentatie-ethanol voor industriële toepassingen.
Om het gebruik van ethanol in industriële processen tegen lagere kosten te vergemakkelijken, hebben veel landen belastingvrije beleidsmaatregelen geïmplementeerd voor industriële en gedenatureerde ethanol. Deze beleidsmaatregelen omvatten vaak financiële, administratieve en chemische controles om misbruik van belastingvrije ethanol voor dranken te voorkomen.
Op basis van deze regelgeving wordt industriële ethanol gecategoriseerd in vier typen: volledig gedenatureerde alcohol, gepatenteerde oplosmiddelen en speciale industriële oplosmiddelen, speciaal gedenatureerde alcohol en pure (absolute) ethanol.
Ethanol wordt vaak toegevoegd aan benzine als brandstofadditief, meestal in verhoudingen die variëren van 5% tot 85% ethanol (bekend als E5 tot E85) of als een benzine-extender. Vanwege het vermogen om te worden geproduceerd uit een aantal grondstoffen, zoals maïs, suikerriet en cellulosematerialen, wordt ethanol steeds populairder als brandstofbron.
Naast het gebruik in traditionele alcoholische dranken, wordt ethanol ook gebruikt bij de productie van verschillende gearomatiseerde likeuren en als basis voor veel cocktails.
Ethanol is een veelgebruikt oplosmiddel, na water, voornamelijk bij de productie van toiletartikelen, cosmetica, reinigingsmiddelen, ontsmettingsmiddelen, farmaceutische producten, oppervlaktecoatings en voedsel- en geneesmiddelenproducten.
Hoewel zowel synthetische als gefermenteerde ethanol als oplosmiddel kunnen worden gebruikt, heeft gefermenteerde ethanol over het algemeen de voorkeur, vooral in Europa, voor toepassingen met betrekking tot menselijke consumptie of lichaamsgebruik.
Ethanol is een krachtig ontsmettingsmiddel dat veel wordt gebruikt in ziekenhuizen, laboratoria en andere zorginstellingen om bacteriën, virussen en andere schadelijke micro-organismen te doden. Het wordt ook gebruikt bij de productie van handontsmettingsmiddelen en ontsmettingssprays.
Ethanol wordt gebruikt als grondstof voor de productie van verschillende chemicaliën, waaronder acetaldehyde, butadieen, di-ethylether, ethylacetaat, ethylamines, ethyleen, glycolethers en andere producten die worden gevormd door reacties met ethyleenoxide of epoxiden en azijn.
Sommige landen, zoals Brazilië, hebben op ethanol gebaseerde chemische industrieën opgezet voor de productie van chemicaliën zoals acetaldehyde die traditioneel worden afgeleid van petrochemicaliën in landen met overvloedige ruwe oliebronnen.
Brazilië was ’s werelds grootste producent van ethanol uit suiker, met meer dan 95% van de totale productie in 1985-1986. Het grootste deel van de in Brazilië geproduceerde ethanol wordt gebruikt als brandstof, terwijl een kleiner deel wordt gebruikt als chemische grondstof.
In 1978 gebruikte India meer dan 50% van zijn totale ethanolproductie voor de chemische productie van producten zoals acetaldehyde, azijnzuur, azijnzuuranhydride, DDT, organische acetaten, aceton, butanol, polyethyleen, polyvinylchloride en styreen.
5. Toxicologie van ethanol
Ethanol vertoont acute orale toxiciteit bij ratten, met LD50-waarden variërend van 11,5 tot 13,7 g/kg. Vergelijkbare LD50-waarden van 9,5, 9,6, 9,9 en 6 g/kg zijn respectievelijk gemeld bij muizen, cavia’s, konijnen en honden.
Ethanol kan milde tot ernstige irritatie in het konijnenoog veroorzaken, afhankelijk van de gebruikte concentratie en hoeveelheid. Het is echter niet significant irriterend voor intacte huid.
Inhalatie van ethanol kan leiden tot irritatie van de slijmvliezen, opwinding, ataxie, slaperigheid, narcose en uiteindelijk de dood door ademhalingsfalen. Dodelijke concentraties voor muizen, cavia’s en ratten variëren van 20.000 tot 40.000 ppm na enkele uren blootstelling. Concentraties onder de 6000 ppm kunnen over het algemeen worden verdragen zonder intoxicatiesymptomen.
Herhaalde orale toediening van ethanol aan jonge ratten in een dosis van 10 g/kg/dag gedurende 12 weken resulteerde in een lage gewichtstoename en leververvetting. Bij apen die een dieet kregen met 40% van de totale calorieën als ethanol, werden verstoringen in het triglyceriden-, cholesterol- en fosfolipidenmetabolisme waargenomen, samen met vettige degeneratie in de lever en het myocardium.
Toediening van ethanol aan drachtige ratten in niveaus van 5 ml/kg verhoogde embryonale sterfte en vertraagde foetale ontwikkeling. Er werden echter geen grote misvormingen in de foetus geïnduceerd.
Ethanoldoses van 1–1,5 g/kg veroorzaakten dominante letale mutaties bij mannelijke muizen, maar niet bij vrouwelijke muizen. In de Ames-test vertoonde ethanol geen mutagene activiteit. Er werd echter een toename in chromatidebreuk waargenomen in menselijke fibroblastculturen, wat waarschijnlijk een cytotoxisch effect is in plaats van een teken van mutageniteit.
Ethanol wordt voornamelijk in de lever gemetaboliseerd via drie enzymsystemen:
- Alcoholdehydrogenase
- Catalase fungeert als een peroxidase en is gekoppeld aan een systeem dat zuurstofrijk water levert
- Een microsomaal ethanol-oxiderend systeem dat NADPH als co-enzym nodig heeft
Ongeveer 80% van de geabsorbeerde ethanol wordt in eerste instantie gemetaboliseerd tot acetaldehyde, gevolgd door verdere oxidatie tot azijnzuur. Azijnzuur wordt vervolgens afgebroken tot koolstofdioxide en water. De oxidatie van acetaldehyde tot azijnzuur is over het algemeen sneller dan de oxidatie van ethanol tot acetaldehyde.
Ethanolinname bij mensen kan verschillende symptomen veroorzaken, afhankelijk van de concentratie, zoals vermeld in Tabel 2. Individuele reacties op ethanol kunnen echter aanzienlijk verschillen.
| Symptoom | Ethanolconcentratie in bloed, % |
|---|---|
| Begin van onzekerheid | 0,06 - 0,08 |
| Langzaam begrip | 0,10 |
| Stupor | 0,11 - 0,15 |
| Dronkenschap | 0,16 |
| Ernstige intoxicatie | 0,2 - 0,4 |
| Dood | 0,4 - 0,5 |
Bij personen die lijden aan alcoholisme, wordt leververvetting vaak toegeschreven aan verhoogde vetzuursynthese van acetaat, verhoogd lipidetransport van perifere vetdepots naar de lever en verminderde vetzuuroxidatie.
Vetinfiltratie van het myocard en chronische leptomeningitis worden ook gemeld bij chronisch alcoholisme en worden geassocieerd met specifieke symptomen.
De ACGIH-, OSHA- en MAK-blootstellingslimieten voor ethanol zijn allemaal vastgesteld op 1000 ppm (1900 mg/m³).
Referenties
- Ethanol; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a09_587.pub2
- Ethanol; Kirk‐Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/10.1002/0471238961.0520080112150719.a01.pub2
