Benzylamine: Eigenschappen, Productie en Toepassingen
Benzylamine is een organische verbinding met de chemische formule C6H5CH2NH2. Het is een kleurloze vloeistof met een karakteristieke aminegeur. Het is een primaire amine met een benzeenring eraan vast.
Inhoudsopgave
1. Fysische eigenschappen van benzylamine
| Eigenschap | Waarde |
|---|---|
| Synoniemen | α-aminotolueen, fenylmethylamine |
| Chemische formule | C7H9N |
| Moleculair gewicht | 107,16 g/mol |
| Fysiek uiterlijk | Kleurloze vloeistof met een zwakke amine-achtige geur |
| Oplosbaarheid | Mengbaar met water, alcohol en di-ethylether |
| Kookpunt | 184,5 °C bij 101,3 kPa 90 °C bij 1,6 kPa |
| Stolpunt | < -30 °C |
| Dampspanning | ca. 60 Pa bij 20 °C ca. 130 Pa bij 30 °C 520 Pa bij 50 °C |
| Verdampingswarmte | 49 kJ/mol |
| Verbrandingswarmte | 4058,7 kJ/mol bij 101,3 kPa en 20 °C |
| Breukindex bij 20 °C | 1.5401 |
| Dichtheid bij 20 °C | 0,9813 |
| Diëlektrische constante | 4,6 bij 20,6 °C |
| Elektrolytische dissociatieconstante in water | 2,35 × 10-5 bij 20 °C |
| Viscositeit | 1,78 mPa·s bij 21,2 °C 0,295 mPa·s bij 178,2 °C |
| Oppervlaktespanning | 38,82 × 10-5 N/cm bij 21,1 °C 31,70 × 10-5 N/cm bij 88 °C |
| Zelfontbrandingstemperatuur | 390 °C |
| Vlampunt | 65 °C |
| Explosiegrens | 0,9% (onder) tot 14% (boven) |
| Dipoolmoment (20 °C) | 1,18 D (puur), 1,25 D in tolueen, 1,29 D in hexaan, 1,30 D in cyclohexaan, 1,33 D in benzeen |
| Dynamische viscositeit | 0,01596 g cm-1 s-1 bij 25 °C |
| Absorptiemaximum lmax in water | 255,9 nm (e 249 L mol-1 cm-1) |
| Magnetische gevoeligheid | −75,3 × 10-6 cm3/mol |
2. Chemische reacties van benzylamine
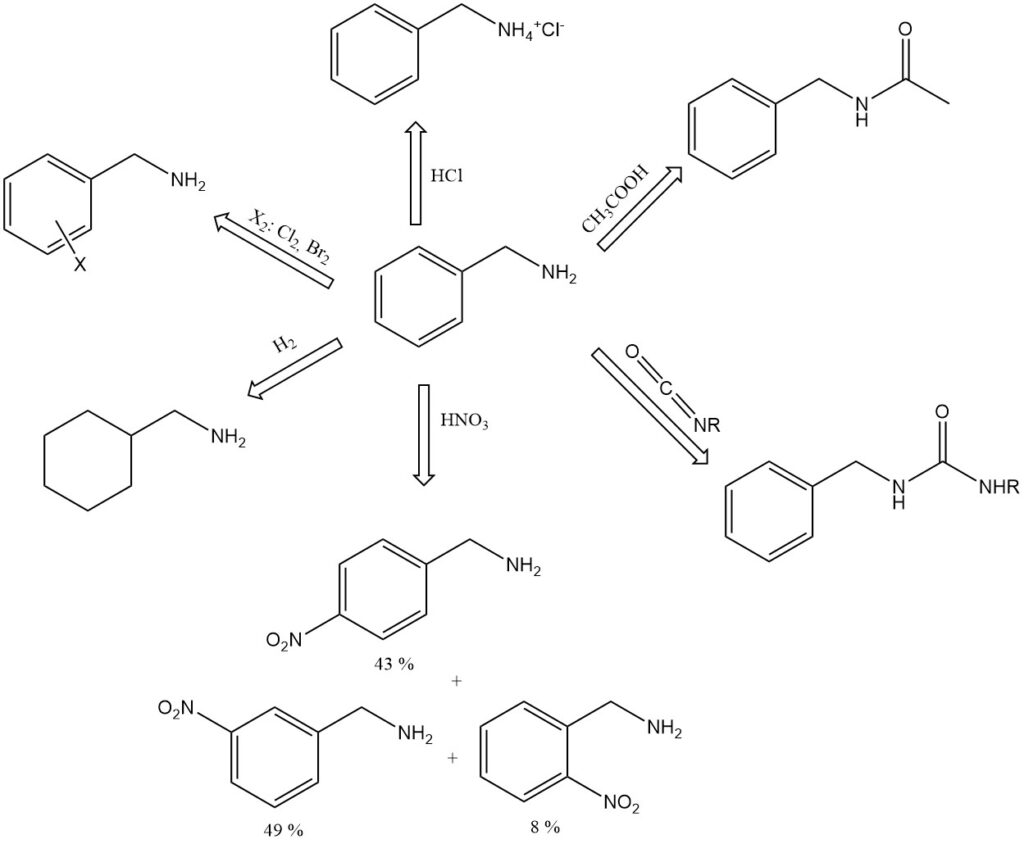
Benzylamine is een sterkere base dan zijn toluidine-isomeren en is sterk alkalisch, zelfs wanneer verdund met wat water (pH 11,6 in 100 g/l water).
Het vormt additieverbindingen met fenol (1:3, smeltpunt: 15,3 °C), p-cresol (1:1, smeltpunt: −6 °C) en mierenzuur (1:1, smeltpunt: 81 °C). Voorbeelden van benzylaminezouten zijn onder meer het hydrochloride, C6H5CH2NH+3 Cl−, smeltpunt: 260 °C (ontleding), en het picraat, smeltpunt: 194 °C.
Benzylamine absorbeert koolstofdioxide uit de lucht om een vast carbaminezuurzout te vormen.
Wanneer het wordt gekookt met ijsazijnzuur, vormt benzylamine N-acetylbenzylamine.
Benzylamine reageert met isocyanaten om gesubstitueerde ureumverbindingen, C6H5CH2NHCONHR.
Salpeterzuur nitreert benzylamine op de aromatische kern om 8% ortho-, 49% meta- en 43% para-nitrobenzylamine te geven.
Katalytische hydrogenering van benzylamine geeft hexahydrobenzylamine, C6H11CH2NH2.
Benzylamine kan aromatische reacties ondergaan op de benzeenring, zoals alkylering, acylering, sulfonering en halogenering.
3. Productie van benzylamine
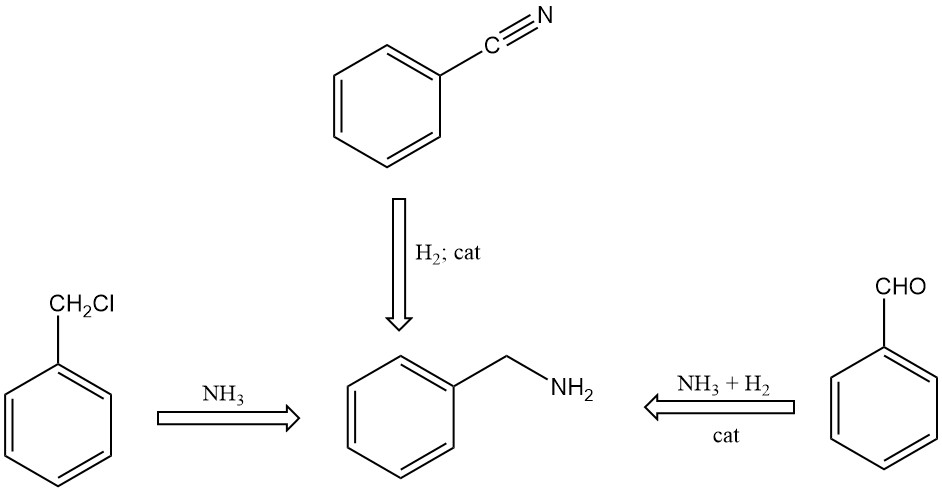
Er zijn verschillende methoden voor het synthetiseren van benzylamine:
- Reactie van benzylchloride met ammoniak in een waterige oplossing
- Katalytische hydrogenering van benzonitril
- Reactie van benzaldehyde met ammoniak in aanwezigheid van waterstof en katalysatoren, met behulp van organische oplosmiddelen in het reactiemengsel
Benzylamine wordt als volgt geproduceerd via de benzaldehyderoute:
- Combineer 8 kg Raney-nikkel (equivalent aan ongeveer 4 kg 100% Ni), 10 g ijsazijn, 110 kg ammoniak en een mengsel van 250 kg methanol en 500 kg benzaldehyde in een stalen autoclaaf van 1200 l.
- Hydrogeneer het mengsel bij 100 °C en 15 MPa gedurende 3 tot 5 uur, waarbij de waterstof ongeveer elke 10 minuten wordt aangevuld. Nadat het waterstofverbruik is gestopt, houdt u het reactievat nog eens 30 minuten op dezelfde temperatuur en druk.
- Scheid de katalysator van de reactieproducten met behulp van een drukfilter. Het filtraat bevat ongeveer 470 kg benzylamine voor een opbrengst van 93%, samen met sporen van benzylalcohol, dibenzylamine, Schiff-base (N-benzalbenzylamine), methanol, reactiewater en ammoniak, voor een opbrengst van 93%.
- Vacuümdestillatie wordt gebruikt om benzylamine van de benodigde technische zuiverheid te verkrijgen.
Benzylamine is ook geïdentificeerd in de bladeren en bloemen van de plant Reseda media.
4. Toepassingen van benzylamine
Benzylamine wordt gebruikt bij de productie van synthetische textiel, verf en corrosie-inhibitoren. Het wordt ook gebruikt als tussenproduct bij de productie van farmaceutische producten en pesticiden. In deze gevallen wordt benzylamine vaak gebruikt als beschermde stikstof.
Benzylamine is een veelzijdig tussenproduct en bouwsteen in verschillende toepassingen, waaronder coatings en gewasbescherming.
Het wordt gebruikt bij de industriële productie van talloze farmaceutische producten, waaronder alniditan, lacosamide, moxifloxacine en nebivolol.
Benzylamine wordt ook gebruikt om het militaire explosief hexanitrohexaazaisowurtzitane (HNIW) te produceren.
5. Toxicologie van benzylamine
Benzylamine is gemakkelijk biologisch afbreekbaar, maar het is schadelijk voor het waterleven, met een zwak effect (Duitse klasse voor gevaren in het watermilieu: 1, WGK 1).
Acute toxiciteit van benzylamine varieert tussen organismen:
- Pseudomonas fluorescens (bacteriën): EC0 500 mg
- Scenedesmus quadricauda (algen): 96-uurs EC10 6 mg
- Daphnia magna: 48-uurs EC50 60 mg
- Leuciscus idus (vis): 48-uurs EC0 20 mg
- Pimephals promelas (vis): 96-uurs EC50 102 mg
Benzylamine kan brandwonden aan de huid en ogen veroorzaken en kan leiden tot sensibilisatie. Spoel bij blootstelling aan benzylamine onmiddellijk met water en was de huid met zeep. Een 5% waterige oplossing van azijnzuur moet beschikbaar zijn om de besmette huid te neutraliseren. Verdun bij inname met drinkwater en spoel de mond. Gebruik bij inademingsrisico ABEK-filters in ademhalingsmaskers (DIN 3181).
Benzylamine toonde een negatief resultaat in de Ames-test, wat aangeeft dat er geen mutageen effect is. De acute orale en percutane LD50-waarden voor ratten zijn respectievelijk 1130 mg/kg en 1340 mg/kg. In Zwitserland is het geclassificeerd als toxiciteitsklasse 3.
Ratten overleefden een periode van twee weken na 3 uur blootstelling van het hele lichaam aan benzylamine via inhalatie, maar 17% van de ratten stierf na 5 uur blootstelling.
Referenties
- Benzylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_009.pub2
- https://products.basf.com/global/en/ci/benzylamine.html
