Benzonitril: eigenschappen, reacties, productie en toepassingen
Benzonitril is een organische verbinding met de formule C7H5N. Het is een kleurloze vloeistof met een zoete bittere amandelgeur. Het wordt voornamelijk gebruikt als voorloper van de hars benzoguanamine.
Inhoudsopgave
1. Fysieke eigenschappen van benzonitril
De volgende tabel vat de fysieke eigenschappen van benzonitril samen.
| Eigenschap | Waarde |
|---|---|
| Formule | C7H5N |
| Moleculaire massa | 103,1 g/mol |
| Kleur | kleurloze vloeistof |
| Geur | amandelachtige geur |
| Kookpunt | 190,7°C |
| Smeltpunt | -12,8°C |
| Relatieve dichtheid (water = 1) | 1,0 g/cm3 (20 °C) |
| Breukindex | 1,53056 (15 °C) |
| Oplosbaarheid in water, g/100 ml bij 22 °C | 0,1-0,5 |
| Oplosbaarheid in organische oplosmiddelen | Mengbaar |
| Damp druk, Pa bij 25°C | 102 |
| Relatieve dampdichtheid (lucht = 1) | 3,6 |
| Vlampunt | 75°C |
| Warmtecapaciteit | 1,840 J/g/K |
| Verdampingswarmte | 46 kJ/mol |
| Vormingswarmte | -155 kJ/mol |
| Verbrandingswarmte | 3063 kJ/mol |
| Zelfontbrandingstemperatuur | 550°C |
| Explosieve grenzen, vol% in lucht | 1,4-7,2 |
| Octanol/water-partitiecoëfficiënt als log Pow | 1,56 |
2. Chemische reacties van benzonitril
Benzonitril is een kleurloze vloeistof die stabiel is in lucht en licht.
Het is een krachtig oplosmiddel dat poly(vinylchloride), poly(vinylacetaat)harsen, polystyreen, poly(methacrylaat) en nitrocellulose oplost. Het lost echter geen polyethyleen, polyamide, poly(vinylalcohol) of fluorpolymeren op.
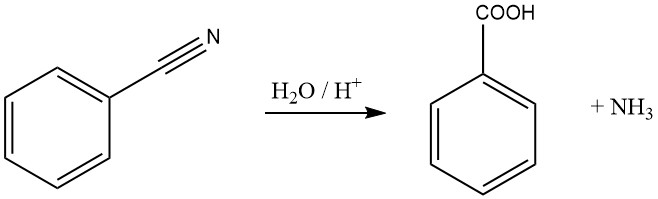
Benzonitril kan worden gehydrolyseerd tot benzoëzuur en ammoniak in aanwezigheid van een sterke base of zuur.
Hydrogenering van benzonitril produceert benzylamine en dibenzylamine.

De reactie van benzonitril met een Grignard-reagens, zoals methylmagnesiumbromide (CH3MgBr), in aanwezigheid van droge ether levert een additieproduct op, dat bij zure hydrolyse acetofenon oplevert.

De reactie verloopt als volgt:
- Het Grignard-reagens voegt zich bij de koolstof-stikstof drievoudige binding in benzonitril, waardoor een imine ontstaat.
- Het imine wordt gehydrolyseerd door zuur, waardoor de koolstof-stikstofbinding wordt verbroken en een keton ontstaat.
3. Productie van benzonitril
Benzonitril wordt geproduceerd door de dampfase-ammoxidatie van tolueen, wat de reactie is van tolueen met ammoniak in aanwezigheid van zuurstof.

De reactie wordt doorgaans uitgevoerd bij hoge temperaturen (450 °C) en druk (10-20 atm) over een katalysator, zoals een wolfraam-mangaancomplex. De reactie is zeer exotherm, met een reactiewarmte van -256 kJ/mol.
De traditionele katalysatoren voor de ammoxidatie van tolueen zijn vanadium en molybdeen, maar deze katalysatoren hebben last van een lage selectiviteit en ernstige ontleding van ammoniak. Een wolfraam-mangaancomplexkatalysator vertoont betere prestaties, met een selectiviteit van maximaal 87,4%.
De reactie wordt uitgevoerd in een vastbedreactor. De concentratie tolueen in de toevoerstroom is doorgaans 1,5 vol %. De verhouding van ammoniak tot tolueen is 4:1 met een contacttijd van 2,4 s. De reactie zet 97% van het tolueen en 30% van de ammoniak om. Het ruwe product, dat ammoniak, waterstofcyanide, tolueen en hoogkokende stoffen bevat, wordt gezuiverd door destillatie.
Benzonitril kan ook worden geproduceerd uit benzoëzuur en ammoniak. Deze reactie wordt uitgevoerd in de dampfase bij 400-410 °C over alumina of in de vloeibare fase bij 225-245 °C.

Andere methoden voor het produceren van benzonitril omvatten:
- Vloeistoffase-ammoxidatie van tolueen in aanwezigheid van een kobalt- of mangaanbromidekatalysator
- Dehydrogenatieve condensatie van benzylalcohol of benzaldehyde met ammoniak
- De hogetemperatuurreactie van tolueen met lachgas
- Cyanering van benzeen met cyanogeenchloride of dicyaan
4. Toepassingen van benzonitril
Benzonitril is een veelzijdige chemische stof met een verscheidenheid aan toepassingen. Het is een voorloper van veel andere chemicaliën, waaronder benzoguanamine, dat wordt gemaakt door de reactie van benzonitril met dicyaandiamide in aanwezigheid van een sterke base.
Benzoguanamine reageert met formaldehyde of alcoholen om een hittebestendige thermohardende hars te produceren die wordt gebruikt in verschillende toepassingen, waaronder coatings, kleefstoffen en composieten.
Andere toepassingen van benzonitril zijn:
- Oplosmiddel voor verschillende organische verbindingen
- Reagens in organische synthese
- Tussenproduct in de productie van farmaceutische producten en pesticiden
- Vlamvertrager
- Smaakstof
5. Toxicologie en gevaren
5.1. Toxicologie
Benzonitril is weliswaar minder toxisch dan alifatische nitrillen, maar kan wel door de huid worden opgenomen, wat kan leiden tot nadelige effecten zoals weefselconvulsies en zenuwverlamming.
De volgende toxicologische gegevens bieden inzicht in de mogelijke gevaren:
Orale blootstelling:
- Rat: LDLo (dodelijke dosis, laag) – 720 mg/kg
- Muis: LD50 (dodelijke dosis, 50% mortaliteit) – 971 mg/kg
Inhalatieblootstelling:
- Rat: LCL0 (dodelijke concentratie, laag) – 950 ppm
- Muis: LC50 (dodelijke concentratie, 50% mortaliteit) – 1800 mg/m³
Intraperitoneale (i.p.) blootstelling:
- Muis: LD50 – 400 mg/kg
Subcutane (s.c.) blootstelling:
- Konijn: LDL0 (dodelijke dosis, laag) – 200 mg/kg
Huidblootstelling:
- Konijn: LD50 – 1250 mg/kg
- Huidirritatie: Matig
5.2. Gevaren
Benzonitril levert bepaalde acute gevaren op die zorgvuldige overweging vereisen:
Brand en Explosie:
De stof is brandbaar en geeft bij brand zowel irriterende als potentieel giftige dampen of gassen af. Bij temperaturen boven de 75 °C bestaat het risico op de vorming van explosieve damp/luchtmengsels.
Open vlammen moeten strikt worden vermeden. Voor werkzaamheden boven de 75 °C is het raadzaam om een gesloten systeem te gebruiken met voldoende ventilatie.
Brandbestrijdingsmaatregelen moeten het gebruik van geschikte blusmiddelen omvatten, zoals poeder, AFFF (aqueous film-forming foam), schuim en koolstofdioxide. In geval van brand wordt aanbevolen om containers koel te houden door waternevel toe te passen.
Mistvorming voorkomen: Het is cruciaal om voorzorgsmaatregelen te nemen om de vorming van nevel te voorkomen, aangezien blootstelling aan dergelijke nevels kan leiden tot schadelijke gezondheidseffecten.
5.3. Symptomen van blootstelling
Blootstelling aan benzonitril kan leiden tot de volgende symptomen:
Inademing: Verwarring, hoofdpijn, moeizame ademhaling, misselijkheid, bewusteloosheid, braken en zwakte zijn mogelijke symptomen. Er moet voldoende ventilatie, lokale afzuigsystemen of persoonlijke ademhalingsbescherming worden gebruikt om inademingsrisico’s te beperken. Als er blootstelling optreedt, moet de getroffen persoon in de frisse lucht worden gebracht en moet er rust worden geboden. In ernstige gevallen kan kunstmatige beademing nodig zijn en moet er onmiddellijk medische hulp worden gezocht.
Huid: Contact met de huid kan roodheid veroorzaken. Om blootstelling van de huid te voorkomen, worden beschermende handschoenen en kleding aanbevolen. In geval van contact moet besmette kleding worden verwijderd en moet het aangetaste huidgebied grondig worden afgespoeld met veel water of een douche. Medische hulp wordt geadviseerd.
Ogen: Roodheid en pijn zijn mogelijke ooggerelateerde symptomen. Er moet geschikte oogbescherming worden gedragen, zoals een veiligheidsbril in combinatie met ademhalingsbescherming. Bij oogcontact moeten de ogen enkele minuten lang met veel water worden gespoeld. Als de persoon contactlenzen draagt, moeten deze worden verwijderd voordat er wordt afgespoeld. Onmiddellijke medische hulp is noodzakelijk.
Inslikken: Inslikken-gerelateerde symptomen kunnen vergelijkbaar zijn met die welke het gevolg zijn van blootstelling door inademing. Om inname te voorkomen, is het essentieel om niet te eten, drinken of roken tijdens werk met benzonitril. Als het wordt ingenomen, moet de mond worden gespoeld en moet de persoon rusten. Er moet onmiddellijk medische hulp worden gezocht.
Het is van het grootste belang om de juiste veiligheidsmaatregelen te volgen bij het werken met benzonitril, inclusief het voorkomen van blootstelling, het juiste gebruik van persoonlijke beschermingsmiddelen (PBM) en snelle medische hulp in geval van blootstellingsgerelateerde symptomen of incidenten.
Referenties
- “Benzoic Acid and Derivatives”, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a03_555
- http://www.ilo.org/dyn/icsc/showcard.display?p_card_id=1103&p_version=2&p_lang=en
