Aminofenol: eigenschappen, productie, reacties en toepassingen

Aminofenolen hebben een aanzienlijk commercieel belang gekregen, zowel als op zichzelf staande stoffen als cruciale componenten in de chemische en kleurstoffensector.
Deze verbindingen bezitten amfotere eigenschappen die kenmerken vertonen van zwakke zuren of zwakke basen, waarbij de basische aard doorgaans overheerst.
Met name 2-aminofenol en 4-aminofenol kunnen gemakkelijk oxidatie ondergaan, een kenmerk dat bijdraagt aan hun primaire toepassingen als fotografische ontwikkelaars. 3-aminofenol blijft echter relatief stabiel bij blootstelling aan lucht en oxideert niet.
Inhoudsopgave
1. Fysieke eigenschappen van aminozuren
De basisstructuren van aminofenol bestaan in drie verschillende isomere configuraties, bepaald door de ruimtelijke rangschikking van de hydroxyl- en aminogroepen grenzend aan de benzeenring. Deze verbindingen stollen doorgaans tot kristallijne structuren bij normale kamertemperatuur.
De op de markt verkrijgbare aminofenolverbindingen zijn doorgaans onzuiver vanwege mogelijke verontreiniging door oxidatiebijproducten. Als gevolg hiervan kunnen ze tinten vertonen die variëren van geelbruin tot rozepaars, waarbij de 2- en 4-aminofenol kwetsbaarder zijn voor deze kleurverandering in vergelijking met de 3-isomeer.
1.1. Fysieke eigenschappen van 2-aminofenol
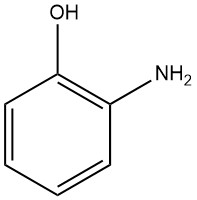
2-Aminofenol, ook bekend als 2-hydroxyaniline of 2-amino-1-hydroxybenzeen, heeft de chemische formule C6H7NO, een molaire massa van 109,13 g/mol. Wanneer het wordt gekristalliseerd uit water of benzeen, vormt het witte orthorombische bipyramidale naalden.
Het smeltpunt van deze kristallen is 174 °C en hun dichtheid is ongeveer 1,328 g/cm³ (1,29 g/cm³ wordt ook in sommige bronnen genoemd). Onder verminderde druk (1,47 kPa) sublimeert 2-aminofenol snel bij 153 °C zonder ontleding.
Wat betreft de zuur-base-eigenschappen zijn de dissociatieconstanten als volgt: pK1 is 4,72 bij 21 °C in water en 4,66 bij 25 °C in een oplossing van 1% ethanol in water; pK2 is 9,66 bij 15 °C en 9,71 bij 22 °C in water.
De verbinding kan verschillende zouten vormen, waaronder het hydrochloridezout, dat eruitziet als naalden en een smeltpunt heeft van 207 °C; het formiaatzout, dat smelt bij 120 °C; het oxalaatzout, dat ontleedt bij 167,5 °C; en het acetaatzout, dat smelt bij 150 °C.
2-Aminofenol is zeer oplosbaar in aceton, acetonitril, dimethylsulfoxide, ethanol en ethylacetaat, oplosbaar in heet water en di-ethylether en licht oplosbaar in chloroform, benzeen, tolueen en koud water.
1.2. Fysische eigenschappen van 3-aminofenol

3-Aminofenol, ook wel 3-hydroxyaniline of 3-amino-1-hydroxybenzeen genoemd, heeft de chemische formule C6H7NO met een molaire massa van 109,13 g/mol. Deze verbinding vormt witte prisma’s bij kristallisatie uit water of tolueen en het smeltpunt ligt tussen 122 en 123 °C.
De orthorombische kristallen vertonen een tetramoleculaire rangschikking en hebben een dichtheid van ongeveer 1,195 g/cm³ (alternatieve waarden van 1,206 en 1,269 zijn ook gerapporteerd). Wanneer onderworpen aan verlaagde druk (1,47 kPa), kookt 3-aminofenol bij 164 °C met lichte ontleding.
Wat betreft de zuur-base-eigenschappen zijn de dissociatieconstanten als volgt: pK1 is 4,17 bij 21 °C in water en 4,31 bij 25 °C in een oplossing met 1% waterige ethanol; pK2 is 9,87 bij 22 °C in water.
3-Aminofenol kan verschillende zouten vormen, waaronder het hydrochloridezout, dat de vorm heeft van prisma’s en smelt bij 229 °C; het hydrobromidezout, ook prismatisch, met een smeltpunt van 224 °C; het hydrojodidezout, ook prismatisch, met een smeltpunt van 209 °C; het sulfaatzout dat voorkomt als platen of naalden en smelt bij 152 °C; en het oxalaatzout, met een smeltpunt van 275 °C.
3-Aminofenol is zeer oplosbaar in aceton, acetonitril, dimethylsulfoxide, ethanol, ethylacetaat en heet water, oplosbaar in koud water en di-ethylether en licht oplosbaar in chloroform, benzeen en tolueen.
1.3. Fysische eigenschappen van 4-Aminofenol
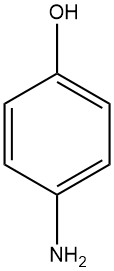
4-Aminofenol, bekend als 4-hydroxyaniline of 4-amino-1-hydroxybenzeen, heeft een chemische formule van C6H7NO met een moleculair gewicht van 109,13 g/mol. Het neemt de vorm aan van witte platen bij kristallisatie uit water en heeft een smeltbereik van 189 tot 190 °C (ontleding vindt plaats).
De kristallen bestaan in twee verschillende vormen. De stabielere “α”-vorm (verkregen uit alcohol, water of ethylacetaat) heeft een orthorombische piramidale structuur met vier moleculen in elke eenheidscel. Het heeft een dichtheid van ongeveer 1,290 g/cm³ (alternatief wordt 1,305 g/cm³ gerapporteerd).
De minder stabiele “β”-vorm (kristallisatie uit aceton) presenteert zich als naaldvormige kristallen, die na verloop van tijd veranderen in de “α”-vorm. De kristallen van de “β”-vorm zijn orthorombisch bipyramidaal of piramidaal en vertonen een hexamoleculaire rangschikking.
Bij verlaagde druk (40 Pa) sublimeert 4-aminofenol bij 110 °C met lichte ontleding. Kookpunten onder verschillende drukken zijn als volgt: 284 °C (101,3 kPa), 174 °C (1,47 kPa), 167 °C (1,07 kPa), 150 °C (0,4 kPa) en 130,2 °C (0,04 kPa), waarbij ontleding gewoonlijk plaatsvindt.
De zuur-base-dissociatieconstanten voor deze verbinding zijn als volgt: pK1 is 5,50 bij 21 °C in water, 4,86 bij 30 °C in water en 5,48 in een oplossing die 1% waterige ethanol bevat bij 25 °C; pK2 is 10,30 bij 22 °C in water en 10,60 bij 30 °C in water.
Verschillende zouten van 4-aminofenol kunnen worden gevormd, waaronder het hydrochloridezout, dat zich presenteert als prisma’s en ontleding ondergaat bij het bereiken van 306 °C; het hydrosulfaatzout, dat verschijnt als naalden met een smeltpunt van 272 °C; het oxalaatzout, dat smelt bij 183 °C; het acetaatzout, dat smelt bij 183 °C; het chlooracetaatzout vormt naalden met een smeltpunt van 148 °C; en het trichlooracetaatzout, in de vorm van naalden met een smeltpunt van 166 °C.
4-Aminofenol is zeer oplosbaar in dimethylsulfoxide, oplosbaar in aceton, acetonitril, ethylacetaat en heet water en di-ethylether, licht oplosbaar in ethanol, di-ethylether, tolueen en koud water en onoplosbaar in benzeen en chloroform.
2. Chemische reacties van aminozurenfenolen
Gedetailleerde discussies over de chemische eigenschappen en reacties van aminofenolen zijn uitgebreid gedocumenteerd in gevestigde referenties van het veld. Een beknopt overzicht wordt hier gegeven.
De aanwezigheid van een aminogroep in de benzeenring onderdrukt de zuurgraad van fenolen, waarbij 4-aminofenol het meest uitgesproken effect vertoont. Aminofenolen fungeren als zwakke basen en vormen zouten met zowel organische als anorganische zuren.
Aminofenolen zijn amfolyten zonder zwitterionstructuur. Ze bestaan als neutrale moleculen, ammoniumkationen of fenolaatanionen, afhankelijk van de pH van de oplossing.

Afwijkingen van theoretische zuur-base titratiecurven hebben echter geleid tot de hypothese van half-zoutcomplexkationen B2+, gevormd door het associëren van een ammoniumkation, B+, met een neutraal molecuul, B. Dit fenomeen is vooral merkbaar in 4-aminofenol en wordt ook gedemonstreerd door andere isomeren.
Aminofenolen zijn chemisch reactief en nemen deel aan reacties waarbij zowel de aromatische aminogroep als de fenolische hydroxylgroep betrokken zijn, evenals benzeenringsubstitutie.
Oxidatie leidt tot de ontwikkeling van levendig gekleurde polymere quinoïdestructuren. 2-Aminofenol ondergaat een reeks cyclisatiereacties.
2.1. Alkylering van aminofenolen
Alle mono-, di- en trimethylaminofenolen kunnen worden gevormd. Monoalkylering vindt plaats bij verhitting van de aminofenol met een geschikte alkylhalide, een alcohol in aanwezigheid van Raney-nikkel of aldehyden en ketonen als alternatieven voor alcohol.
Directe alkylering van de hydroxylgroep om methoxyanilines (anisidines) of ethoxyanilines (fenetidines) te produceren is ingewikkeld vanwege de reactiviteit van de aminogroep, wat vaak gemengde gealkyleerde producten oplevert.
Methylering van 3-aminofenol onder alkalische omstandigheden levert 3-methoxyaniline op, hoewel een meer gebruikelijke aanpak bescherming van de aminogroep omvat, gevolgd door methylering van 3-acetylanilines en daaropvolgende hydrolyse.
Andere anisidines en fenetidines worden doorgaans indirect geproduceerd door nitro-analoogreductie:

2.2. Acylatie van aminofenolen
Acylatie van aminofenolen, waarbij azijnzuuranhydride in alkali of pyridine, acetylchloride en pyridine in tolueen of keteen in ethanol wordt gebruikt, levert in het algemeen N-geacyleerde producten op. Overmatig gebruik van reagentia, met name met 2-aminofenol, leidt tot O,N-gediacyleerde producten.
Aminofenylcarboxylaten (O-geacyleerde aminofenolen) worden doorgaans geproduceerd via de reductie van overeenkomstige nitrofenylcarboxylaten, een proces dat van bijzonder belang is voor 4-aminofenolderivaten.
Migratie van de acylgroep van O naar N-posities wordt waargenomen in zowel 2- als 4-aminofenolgeacyleerde producten.
Een voorbeeld van herschikking is de vorming van 2-hydroxyfenylcarbamaat door 2-aminofenylethylcarbonaat langzaam te behandelen in verdund zuur. De paraderivaten vertonen geen enkele transformatie.

2.3. Vorming van diazoniumzouten
De aromatische aminogroepen van aminofenolen kunnen worden omgezet in diazoniumzouten door behandeling met natriumnitriet onder zure waterige omstandigheden. Er kunnen uitdagingen ontstaan met gemakkelijk oxideerbare of matig oplosbare aminofenolen.
Kristallijne diazoniumzouten worden geïsoleerd met behulp van hydrochloride- of sulfaatvormen van de relevante aminofenol onder watervrije omstandigheden. Deze diazoderivaten worden op grote schaal gebruikt in de kleurstoffenindustrie.
2.4. Cyclisatiereacties van aminofenolen
Vanwege de nabijheid van de amino- en hydroxylgroepen in 2-aminofenol is dit isomeer bijzonder gevoelig voor cyclisatie- en condensatiereacties. Oxidatie door ijzer(III)chloride, enzymen, licht of autoxidatie op dunne silicaplaten levert 2-aminofenoxazine-3-on op (4).
Vervolgens wordt het geoxideerd met ijzer(III)cyanide of verhit met kaliumhydroxide in ethanol, wat resulteert in een vijfringstructuur, trifenoxdioxazine (benzoxazinophenoxazine) (5).

2-Aminofenol en zijn derivaten dienen als waardevolle startmaterialen voor de synthese van fenoxazonen, fenoxazinen, benzoxazolen en thiobenzoxazolen, waarbij de meeste van deze reacties verhitting op 200 – 300 °C met een geschikte katalysator inhouden.
2.5. Condensatiereacties
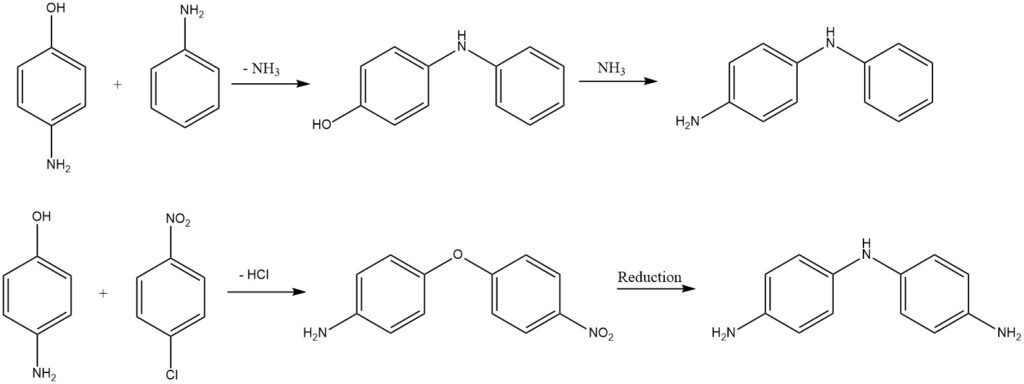
Gesubstitueerde difenylamines of difenylethers worden verkregen uit aminofenolen door de eliminatie van ammoniak of waterstofchloride.
2.6. Reacties van de benzeenring
Zowel amino- als hydroxylgroepen functioneren als elektronendonerende groepen, wat leidt tot de vorming van verschillende gesubstitueerde derivaten. Gecontroleerde interacties tussen aminofenolen en chloor of broom in gletsjerazijnzuur leveren een spectrum aan gehalogeneerde producten op.
Geconcentreerd zwavelzuur of oleum, met of zonder warmte, genereert aromatische sulfonzuren. De sulfonzuurgroep komt voornamelijk in de ortho- of parapositie ten opzichte van de hydroxylgroep terecht. Verdere behandeling met oleum resulteert in disulfonverbindingen.
Carboxylering van m-aminofenol levert p-aminosalicylzuur op.
3. Productie van aminozuren
Aminofenolen worden gesynthetiseerd via twee primaire routes: reductie van nitrofenolen of substitutiereacties. Reductie kan worden bereikt met behulp van ijzer of waterstof in aanwezigheid van een katalysator. Tegenwoordig is de laatste methode de voorkeurskeuze voor de productie van 2- en 4-aminofenol.
3.1. Productie van aminozuren door reductie van nitroverbindingen
3.1.1. IJzerreductie
De reductie van nitrofenolen met behulp van ijzerdraaisels vindt plaats in een licht zure oplossing of suspensie. Na reductie wordt de ijzer-ijzeroxideslib gescheiden van de oplossing. Om de oplosbaarheid in water te verbeteren, wordt natriumhydroxide toegevoegd, wat natriumaminofenolaat oplevert.
Vanwege de gevoeligheid voor oxidatie in waterige oplossing worden verschillende zuiveringsmethoden geadviseerd. Vervolgens worden aminofenolen uit zure oplossingen neergeslagen door neutralisatie van basen, terwijl vaak reductiemiddelen worden toegevoegd.
Niettemin genereert de reductie van 2-nitrofenol met ijzer onoplosbare kleurlakken als bijproducten, waardoor de opbrengst afneemt. Als gevolg hiervan is de industriële betekenis van ijzerreductie voor 2-nitrofenol beperkt.
3.1.2. Katalytische reductie
Katalytische reductie vindt voornamelijk plaats in oplossing, emulsie of suspensie in autoclaven of drukvaten. Na toevoeging van de katalysator wordt waterstof onder druk in het vat gebracht. Voorkeursoplosmiddelen omvatten water en methanol, waarbij water wordt aangevuld met alkalihydroxide, alkalicarbonaat of zuur.
Katalysatoren zoals nikkel – met name Raney-nikkel – of ondersteunde edelmetalen zoals platina of palladium op actieve kool, of hun oxiden, worden gebruikt.
Het toevoegen van niet-mengbare organische oplosmiddelen aan water kan de levensduur van de katalysator verlengen, het verbruik verlagen en de productkwaliteit verbeteren.
Normaal gesproken is een waterstofdruk van 2 MPa optimaal, hoewel atmosferische of hogere drukken tot 6 MPa kunnen worden gebruikt. Reactietemperaturen blijven onder de 100 – 110 °C.
3.1.3. Nitrobenzeenreductie
Zuur mediumreductie van nitrobenzeen levert 2- en 4-aminofenol op via herschikking van het intermediaire fenylhydroxylamine. Het hoofdproduct is 4-aminofenol, naast bijproducten 2-aminofenol, aniline en 4,4′-diaminodifenylether.
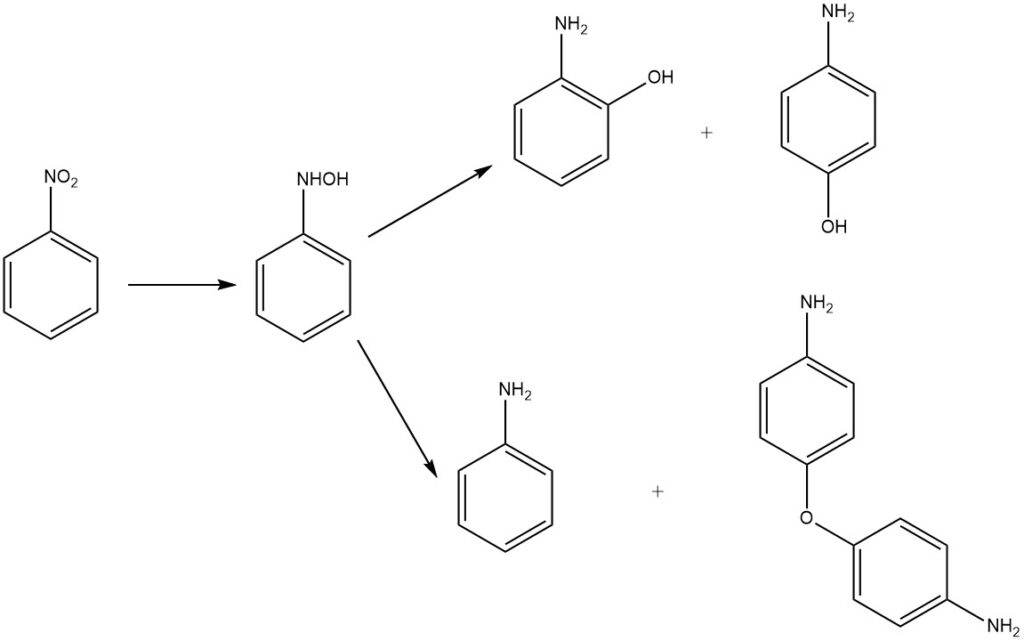
Historisch gezien dienden metalen in verdund zwavelzuur als reductiemiddelen. Tegenwoordig worden waterstof en edelmetaalkatalysatoren zoals palladium of platina gebruikt. Extra katalysatoren omvatten molybdeen en platinasulfide en een gemengde platina-rutheniumkatalysator, vaak in oxidevorm of ondersteund op actieve kool.
Verdund waterig mineraalzuur fungeert als reactiemedium en een tweestapsproces met Raney-koper reduceert selectief nitrobenzeen tot fenylhydroxylamine, dat zich herschikt tot 4-aminofenol bij toevoeging van verdund zwavelzuur.
Bevochtigingsmiddelen, met name quaternaire ammoniumzouten met aanzienlijke alkylgroepen, verhogen de opbrengst van aminofenol. Meestal vindt de reactie plaats onder 100 °C en kan atmosferische of hogere druk worden gebruikt. Waterstoftoevoeging vindt plaats naarmate het wordt verbruikt en inerte organische oplosmiddelen kunnen de opbrengst verhogen.
Bij een alternatieve methode stopt de nitrobenzeenreductie bij 88%, waardoor een tweefasenmengsel ontstaat dat niet-gereageerde nitrobenzeen en de edelmetaalkatalysator bevat. Fasescheiding is voldoende voor de opwerking, waarbij de nitrobenzeenfase wordt gerecycled.
De waterige zwavelzuurfase bevat 4-aminofenol en aniline, dat na neutralisatie wordt verwijderd. Zuivering en kristallisatie leveren 4-aminofenol op.
3.1.4. Elektrolytische reductie
Elektrolytische reductie biedt een minder vervuilend alternatief voor metaalzuursystemen, maar de industriële implementatie blijft beperkt. Elektrolyse van nitrobenzeen, fenylhydroxylamine of azoxybenzeen in zure oplossingen levert specifiek 4-aminofenol op.
3.2. Substitutie
De substitutie van amino- of hydroxylgroepen in plaats van verschillende andere groepen is niet van significant industrieel belang voor de productie van 2- en 4-aminofenol. Dit type reactie is echter bruikbaar bij het synthetiseren van derivaten van 2- en 4-aminofenol.
Daarentegen levert de eenvoudige reductieroute niet zomaar 3-aminofenol op. De productie ervan omvat voornamelijk de reactie tussen 3-aminobenzeensulfonzuur en natriumhydroxide of de reactie van resorcinol met ammoniak.
Substitutie van de sulfonzuurgroep in 3-aminobenzeensulfonzuur wordt bereikt door een natronloogfusieproces (duurt 5 tot 6 uur bij 240 tot 245 °C), gevolgd door vacuümdestillatie om het product te zuiveren.
Een alternatieve methode omvat de reactie van resorcinol met ammoniak, mogelijk in aanwezigheid van diammoniumfosfaat en arseenpentoxide of ammoniumsulfiet, wat resulteert in de vorming van 3-aminofenol.
Bovendien kan 3-aminofenol worden verkregen door de hydrolyse van 3-aminoaniline.
3.3. Zuivering van aminofenolen
Aminofenolen worden gezuiverd door sublimatie bij verhoogde temperaturen en verlaagde druk.
Voor 3-aminofenol is vacuümdestillatie een geschikte zuiveringsmethode, waarbij de toevoeging van zwaveldioxide tijdens de destillatie of het verzamelen van het destillaat onder een laag van een inerte vloeistof met een lagere dichtheid, zoals water, helpt om een kleurloos product te verkrijgen.
Een alternatieve zuiveringsaanpak omvat het behandelen van de waterige oplossingen van aminofenolen met actieve kool. Tijdens dit proces dient de toevoeging van stoffen zoals natriumsulfiet, natriumdithioniet of dinatriumethyleendiaminotetraacetaat om de kwaliteit en stabiliteit van de producten te verbeteren, terwijl zware metaalionen worden gechelateerd die oxidatie kunnen vergemakkelijken.
De toevoeging van natriumdithioniet, hydrazine of natriumhydrosulfiet wordt ook aanbevolen tijdens de precipitatie of kristallisatie van aminofenolen.
Voor aminofenolen, met name 4-aminofenol geproduceerd door katalytische reductie, kunnen verontreinigingen vaak worden verminderd of geëlimineerd door verschillende procedures te gebruiken. Deze methoden omvatten behandeling met 2-propanol, alifatische, cycloalifatische of aromatische ketonen, aromatische aminen, tolueen of laagmoleculaire alkylacetaten, evenals het gebruik van fosforzuur, hydroxyazijnzuur, hydroxypropionzuur of citroenzuur.
Extractie met methyleenchloride, chloroform of nitrobenzeen kan ook effectief zijn bij het verminderen of verwijderen van verontreinigingen.
4. Toepassingen van aminozuren
Zowel 2-aminofenol als 4-aminofenol zijn krachtige reductiemiddelen, waardoor ze waardevol zijn als fotografische ontwikkelaars, bekend onder commerciële namen zoals Atomal en Ortol voor 2-aminofenol, en Activol, Azol, Certinal, Citol, Paranol, Rodinal, Unal en Ursol P voor 4-aminofenol.
Deze stoffen worden afzonderlijk of in combinatie met hydrochinon toegepast. De oxalaatvorm van 4-aminofenol wordt op de markt gebracht onder de merknaam Kodelon.
De veelzijdigheid van aminofenolen maakt ze essentiële tussenproducten bij de synthese van bijna alle soorten vlekken en kleurstoffen. Bovendien wordt 2-aminofenol specifiek gebruikt voor het verbeteren van de tinten van leer, bont en haar, variërend van grijze en bruine tinten tot geelbruine tinten.
Voor diverse doeleinden dient 3-aminofenol als haarkleurstof en als koppelingsmiddel in haarverfformuleringen. Ondertussen is 4-aminofenol integraal aan farmaceutische synthese, draagt het bij aan de productie van houtbeitsen die een roosachtige tint aan hout geven en fungeert het als een verfmiddel voor bont en veren.
Gezien de nabijheid van de amino- en hydroxylgroepen op de benzeenring, samen met hun aanleg voor condensatie met geschikte reactanten, is 2-aminofenol een belangrijke voorloper in de synthese van heterocyclische systemen zoals oxyquinolinen, fenoxaminen en benzoxazolen die worden gebruikt als ontstekingsremmers.
Met betrekking tot 3-aminofenol omvatten de toepassingen ervan de stabilisatie van chloorhoudende thermoplasten, hoewel de belangrijkste rol is als tussenproduct voor de productie van 4-amino-2-hydroxybenzoëzuur, een tuberculostatisch middel.
Op dezelfde manier worden derivaten van stikstof-gesubstitueerde 4-aminofenolen al lang erkend vanwege hun antipyretische en pijnstillende eigenschappen, wat aanzienlijk bijdraagt aan het gebruik van 4-aminofenol.
5. Toxicologie van aminozuren
Aminofenolen worden geclassificeerd als irriterende stoffen. Hun toxiciteitsclassificatie varieert van licht tot matig; langdurige of herhaalde blootstelling kan echter leiden tot verschillende bijwerkingen, waaronder algemene jeuk, huidgevoeligheid, dermatitis en allergische reacties.
Blootstelling aan 2- en 4-aminofenol kan leiden tot de spontane productie van immunogene conjugaten. Een andere mogelijke zorg is de vorming van methemoglobine, wat resulteert in cyanose.
Inademing van 4-aminofenol kan deze reactie veroorzaken en ook leiden tot bronchiale astma. Opvallend is dat 3-aminofenol een minder groot gevaar vormt in vergelijking met de andere isomeren. De irritatie die wordt veroorzaakt door gesulfoneerde derivaten is milder in vergelijking met niet-gesulfoneerde verbindingen.
2-aminofenol heeft neuroactieve eigenschappen en veroorzaakt piekontladingen wanneer het in het cerebroventrikel van ratten wordt ingebracht. Aan de andere kant is 4-aminofenol nefrotoxisch en remt het de proximale tubulaire functie aanzienlijk.
In rattenniermitochondriën worden ademhaling, oxidatieve fosforylering en ATPase-activiteit geremd door 4-aminofenol. Hoewel 3-aminofenol niet zo gevaarlijk is, vertonen zowel 2-aminofenol als 4-aminofenol teratogene effecten bij hamsters.
De impact van 4-aminofenol strekt zich uit tot remming van DNA-synthese en verandering van DNA-structuur in menselijke lymfoblasten. Bovendien zijn aminofenolen geïdentificeerd als genotoxische middelen, zoals blijkt uit de inductie van zusterchromatide-uitwisselingen en micronucleustests.
Het is duidelijk dat voorzichtig omgaan met deze verbindingen essentieel is en langdurige blootstelling moet worden geminimaliseerd. Snel verwijderen van besmette kleding en grondig wassen van het aangetaste gebied met stromend water gedurende minimaal 10 minuten zijn aanbevolen procedures.
Referenties
- Aminofenolen; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_099
- Aminofenolen; Kirk-Othmer Encyclopedia of Chemical Technology. – https://onlinelibrary.wiley.com/doi/abs/10.1002/0471238961.0113091413092003.a01.pub2
