4-Nitrofenol: Eigenschappen, Productie en Toepassingen
4-Nitrofenol, ook bekend als p-nitrofenol of 4-hydroxynitrobenzeen, is een aromatische verbinding met de chemische formule C6H5NO3. Het is een gele tot kleurloze kristallijne vaste stof met een zoete, fenolische geur. Het is oplosbaar in water, ethanol en andere organische oplosmiddelen.
Inhoudsopgave
1. Fysieke eigenschappen van 4-nitrofenol
P-nitrofenol heeft een metastabiele α-vorm die in kristallijne vorm kan worden waargenomen wanneer tolueen wordt verhit boven 63 °C. De stabielere β-vorm wordt verkregen wanneer tolueen wordt afgekoeld onder 63 °C. P-nitrofenol is niet vluchtig met stoom, maar is beter oplosbaar in water dan zijn ortho-isomeer.
Enkele van de fysieke eigenschappen van 4-nitrofenol worden weergegeven in de volgende tabel:
| Eigenschap | Waarde |
|---|---|
| Chemische formule | C6H5NO3 |
| Molaire massa | 139,11 g/mol |
| Uiterlijk | Gele, naaldachtige kristallijne vaste stof |
| Smeltpunt | 114 °C |
| Kookpunt | 216 °C |
| Oplosbaarheid in water (100 °C) | 30% |
| Oplosbaarheid in water (25 °C) | 16 g/L |
| Dichtheid | 1,48 g/cm³ |
| pKa | 7,15 |
| Vlampunt | 105 °C |
| Ontledingstemperatuur natriumzout | 156 °C |
2. Chemische reacties van 4-nitrofenol
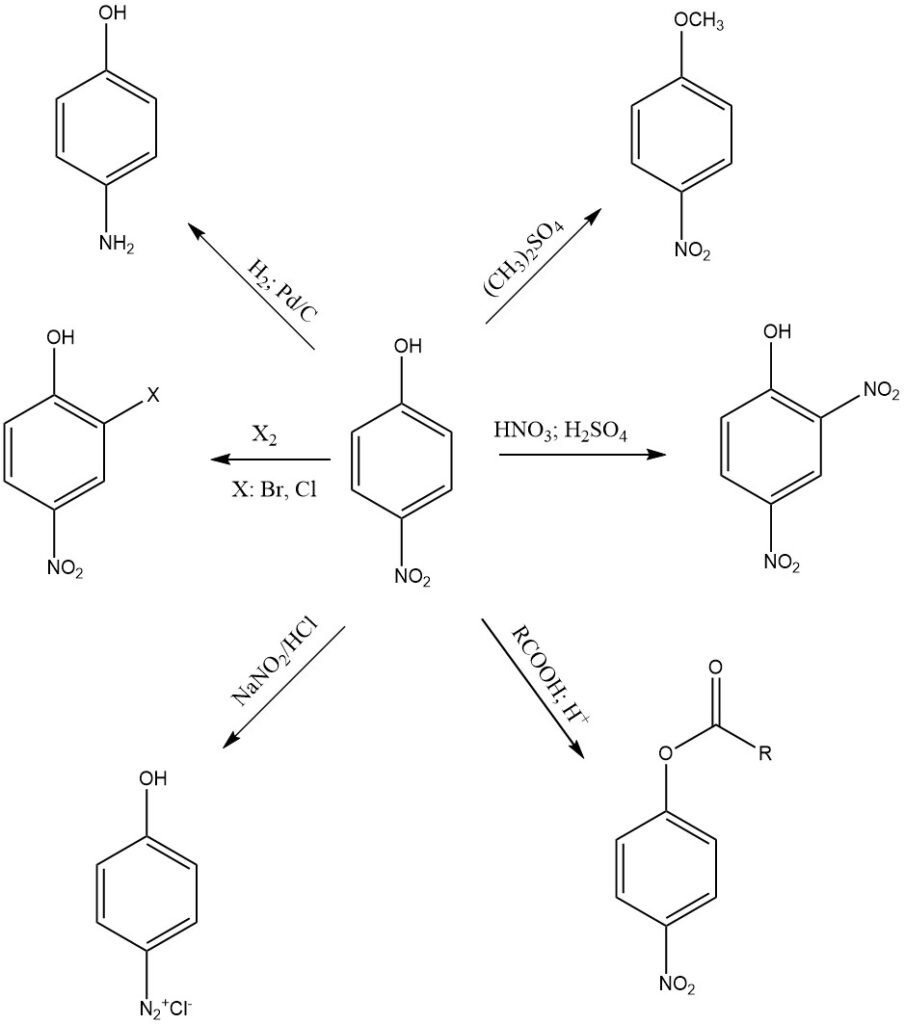
4-nitrofenol is een relatief stabiele verbinding. De reactiviteit ervan wordt veroorzaakt door de aanwezigheid van nitro- en hydroxylgroepen op de aromatische ring, waardoor het een verscheidenheid aan chemische reacties kan ondergaan, zoals hieronder:
Een van de meest voorkomende reacties van 4-nitrofenol is de reductie van de nitrogroep tot amine. 4-nitrofenol kan onder verschillende omstandigheden worden gereduceerd tot 4-aminofenol. Veelvoorkomende reductiemiddelen zijn natriumdithioniet, zink en ijzer in geconcentreerd HCl of waterstofgas.
4-nitrofenol kan worden gealkyleerd om een verscheidenheid aan derivaten te vormen. Veelvoorkomende alkyleringsmiddelen zijn dimethylsulfaat en methyljodide. Gealkyleerde 4-nitrofenolderivaten worden vaak gebruikt als tussenproducten bij de synthese van andere organische verbindingen.
4-Nitrofenol kan verestering ondergaan, waarbij het reageert met carbonzuren om esters te vormen. Deze reactie wordt doorgaans gekatalyseerd door zuur, zoals zwavelzuur.
4-nitrofenol wordt genitreerd in aanwezigheid van salpeterzuur en zwavelzuur om 2,4-dinitrofenol te vormen. Verder levert nitratie picrinezuur op, wat een krachtiger explosief is dan 2,4-dinitrofenol, en het wordt gebruikt in verschillende industriële en militaire toepassingen.
4-Nitrofenol kan ook deelnemen aan diazotiseringsreacties, een proces waarbij de aminogroep (-NH2) van 4-aminofenol wordt omgezet in een diazoniumzout (-N2+X–). Deze reactie wordt gebruikt bij de synthese van verschillende kleurstoffen en aromatische verbindingen met diazogroepen.
4-nitrofenol is zuur vanwege de hydroxylgroep. Het reageert met sterke basen zoals natriumhydroxide om 4-nitrofenolaationen te vormen.
4-nitrofenol ondergaat ook aromatische ringreacties zoals halogenering, sulfonering, acylering en alkylering, met name in de orthopositie van de (-OH)-groep.
3. Productie van 4-Nitrofenol
3.1. Productie van 4-Nitrofenol door Hydrolyse van 4-chloornitrobenzeen
4-chloornitrobenzeen wordt verhit in een autoclaaf met 8,5% natriumhydroxideoplossing. De exotherme reactie bereikt 170 °C en wordt 8 uur gehandhaafd. De oplossing wordt vervolgens gekoeld en aangezuurd om 4-nitrofenol te verkrijgen met een opbrengst van 95%.

Het proces produceert 4-nitrofenol met een hoge zuiverheid en omvat de volgende stappen:
- Basische hydrolyse van het 4-chloornitrobenzeen
- Concentratie van het reactiemedium
- Verzuring om de 4-nitrofenolverbinding uit het zout te verkrijgen
- Vloeistof/vloeistofdecantatie om de waterige fase te verwijderen die na verzuring is verkregen
- Kristalisatie van de 4-nitrofenolverbinding
- Scheiding van het product
De concentratiestap verwijdert vluchtige onzuiverheden en de decantatiestap verwijdert in water oplosbare onzuiverheden. De kristallisatiestap zuivert het 4-nitrofenol verder door alle resterende onzuiverheden te verwijderen.
Dit proces produceert een 4-nitrofenol met een laag gehalte aan vetoplosbare onzuiverheden (zoals 4-chloornitrobenzeen) en in water oplosbare onzuiverheden (zoals natriumchloride en natriumsulfaat). 4-Nitrofenol is ook vrij van zwavelhoudende onzuiverheden, wat voordelig is voor daaropvolgende katalytische hydrogeneringsreacties.
3.2. Productie van 4-nitrofenol door nitrering van fenol
Fenol wordt omgezet met salpeterzuur in aanwezigheid van zwavelzuur om een mengsel van 2-nitrofenol en 4-nitrofenol te produceren. Het mengsel wordt vervolgens gedestilleerd om de twee isomeren te scheiden. Het 4-nitrofenol dat uit de destillatiestap wordt verkregen, wordt verder gezuiverd door kristallisatie of herkristallisatie.

Een efficiënter proces voor het produceren van 4-nitrofenol uit fenol in een salpeterzuurmedium is een methode die twee stappen omvat: nitrosatie en nitratie. In de nitrosatiestap reageert fenol met salpeterigzuur om p-nitrosofenol te produceren.
In de nitratiestap reageert p-nitrosofenol met salpeterzuur om 4-nitrofenol te produceren. Het proces wordt uitgevoerd in een salpeterzuurmedium met een concentratie in het bereik van 5 tot 30% op gewicht, en de temperatuur wordt gehandhaafd in het bereik van 0-10 ° C tijdens de nitrosatie en 15-30 ° C tijdens de nitratie.
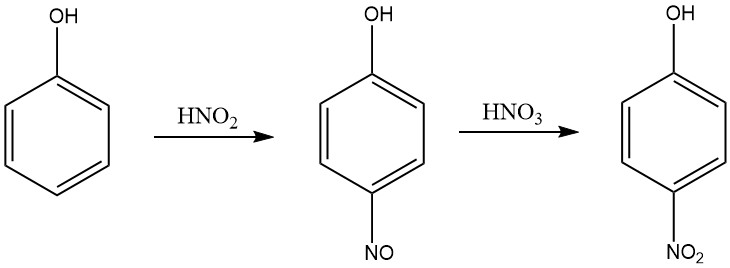
Het salpeterigzuur wordt geproduceerd in het waterige salpeterzuur door toevoeging van stikstofoxiden, zoals stikstofoxide, stikstoftetroxide of stikstoftrioxide. De 4-nitrofenol wordt gescheiden van het reactiemengsel door kristallisatie.
Dit proces is voordelig omdat het 4-nitrofenol produceert met een laag ortho-isomeergehalte.
4. Toepassingen van 4-nitrofenol
De reductie van 4-nitrofenol tot 4-aminofenol wordt minder gebruikt omdat processen om nitrobenzeen direct te reduceren gebruikelijker zijn.
4-Nitrofenol reageert met dialkylthiofosforchloriden bij 125 °C in chloorbenzeen om een groep insecticiden te vormen, waaronder parathion. Maar deze verbinding is vervangen door minder giftige alternatieven zoals methylparathion en verwante stoffen.
4-Nitrofenol reageert met 4-chloor-3-nitrobenzotrifluoride om fluorodifen te vormen, dat verwant is aan nitrofen. Dit herbicide wordt gebruikt om geboorde rijstgewassen te behandelen.
4-Nitrofenol wordt gebruikt in andere toepassingen, waaronder:
- Farmaceutica: 4-nitrofenol wordt gebruikt als tussenproduct bij de synthese van paracetamol (ook bekend als acetaminofen), een veelgebruikt vrij verkrijgbaar pijnstiller en koortsverlager.
- Fungiciden: 4-nitrofenol is een voorloper voor sommige fungiciden, zoals dinocap en binapacryl.
- Kleurstoffen: 4-nitrofenol wordt gebruikt om verschillende kleurstoffen te produceren, waaronder gele, oranje en rode kleurstoffen.
- Leerlooien: 4-nitrofenol wordt gebruikt om leer donkerder te maken.
5. Toxicologie van 4-nitrofenol
| Blootstelling | LD50 |
|---|---|
| Dermaal, cavia | >1 g/kg |
| Oraal, muis | 282 mg/kg |
| Oraal, rat | 202 mg/kg |
| Huid, rat | 1024 mg/kg |
| Inhalatie, rat | > 4,7 mg/l/4H |
| Huid sensibilisatie, cavia | Geen gesensibiliseerd |
- Acute effecten: Inademing of inname van 4-nitrofenol kan hoofdpijn, slaperigheid, misselijkheid en cyanose (blauwe kleur op lippen, oren en vingernagels) veroorzaken. Contact met de ogen kan irritatie veroorzaken.
- Chronische effecten: Er is geen informatie beschikbaar over de chronische effecten van 4-nitrofenol bij mensen of dieren door inademing of orale blootstelling.
- Reproductieve/ontwikkelingseffecten: Er is geen informatie beschikbaar over de reproductieve of ontwikkelingseffecten van 4-nitrofenol bij mensen.
- Kankerrisico: Er is geen informatie beschikbaar over de carcinogene effecten van 4-nitrofenol bij mensen. Er was geen bewijs van carcinogene activiteit bij muizen die gedurende 18 maanden via de huid werden blootgesteld aan 4-nitrofenol in een onderzoek van het National Toxicology Program (NTP).
Referenties
- Nitro Compounds, Aromatic, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
- Process for preparation of a nitrophenol. – https://patents.google.com/patent/US20080045756A1/en
- Preparation of p-nitrophenols. – https://patents.google.com/patent/US3510527A/en
- https://www.epa.gov/sites/default/files/2016-09/documents/4-nitrophenol.pdf
- https://fscimage.fishersci.com/msds/96371.htm
