2-Methyl-1-propanol: Eigenschappen, Productie en Toepassingen
Wat is 2-methyl-1-propanol?
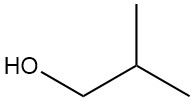
2-methyl-1-propanol, ook bekend als isobutanol of isobutylalcohol, is een organische verbinding met de chemische formule (CH3)2CHCH2OH. Het is een kleurloze vloeistof met een karakteristieke geur die voorkomt in natuurlijke producten en in fusel-oliën.
Isobutanol is een product van melasse fermentatie (ongeveer 74% van het totale alcoholgehalte). Historisch gezien werd isobutanol geïsoleerd uit fusel-oliën. De ontwikkeling van de isobutyloliesynthese, een proces dat analoog is aan methanolsynthese uit koolmonoxide en waterstof, maakte echter grootschalige productie mogelijk.
In de jaren 2010 vond er een significante verschuiving plaats waarbij de propyleenhydroformylering (oxosynthese) de huidige dominante productiemethode werd vanwege de efficiëntie en kosteneffectiviteit. Dit heeft geleid tot een significante toename van de omvang van de isobutanolmarkt.
Inhoudsopgave
1. Fysieke eigenschappen van 2-methyl-1-propanol
2-methyl-1-propanol (isobutanol) is een kleurloze vloeistof met een karakteristieke geur. De dampen zijn irriterend voor slijmvliezen en kunnen bij hoge concentraties een narcotisch effect hebben. Deze alcohol is mengbaar met gangbare organische oplosmiddelen.
Tabel 1 vat de belangrijkste fysieke eigenschappen van 2-methyl-1-propanol samen:
| Eigenschap | Waarde |
|---|---|
| Molaire massa | 74,12 g/mol |
| Smeltpunt | -107,9 °C |
| Kookpunt | 107,9 °C |
| Dichtheid bij 20 °C (d20) | 0,8027 g/ml |
| Breukindex bij 20°C (n20) | 1,3959 |
| Viscositeit bij 20°C | 4,0 mPa·s |
| Soortelijke warmte (30-80 °C) | 2,5263 J·g-1·K-1 |
| Verdampingswarmte | 578,83 J/g |
| Verbrandingswarmte | 35,981 kJ/g |
| Kritische druk | 48 hPa |
| Kritische temperatuur | 265 °C |
| Oppervlaktespanning (kamertemperatuur) | 23,0 mN/m |
| Diëlektrische constante (kamertemperatuur) | 18,8 |
| Verdampingsgetal (ether = 1) | 24 |
| Oplosbaarheid in water |
20°C: 8,5 gew.% 30°C: 7,5 gew.% |
| Oplosbaarheid van water in isobutanol |
20°C: 15 gew.% 30°C: 17,3 gew.% |
| Vlampunt | 28 °C |
| Ontstekingsgrenzen in lucht | 1,7-10,9 vol.% |
| Ontstekingstemperatuur | 430 °C |
2. Chemische eigenschappen van 2-methyl-1-propanol
2.1. Dehydratie
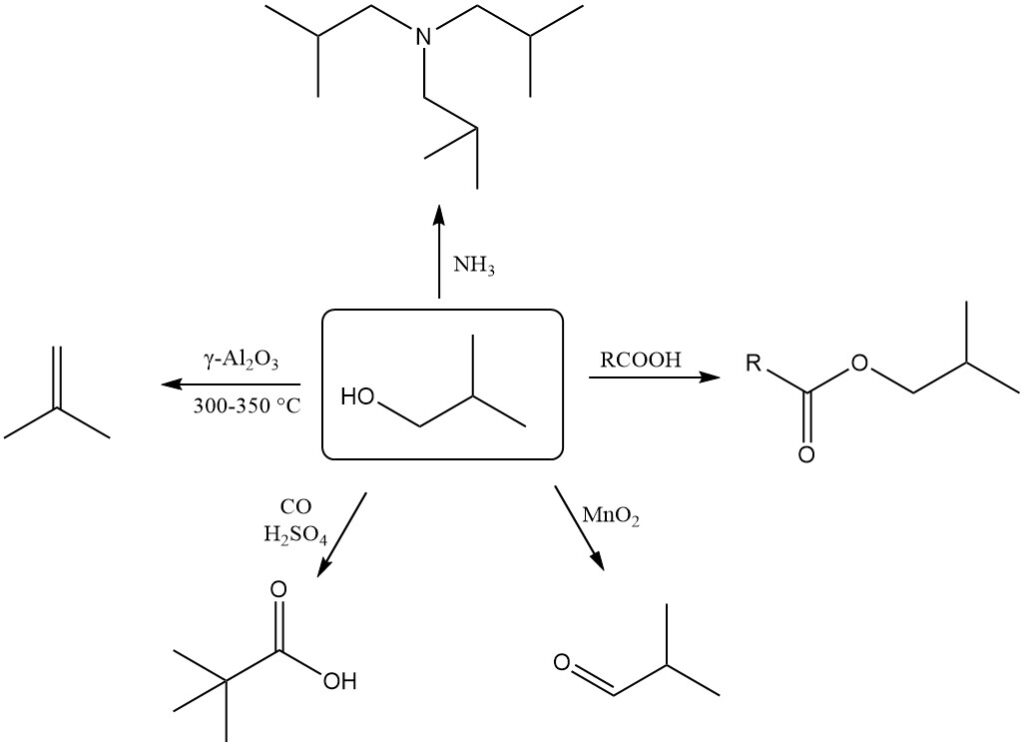
2-methyl-1-propanol ondergaat gemakkelijk dehydratie om 2-methylpropeen (isobuteen) te vormen. Deze reactie vereist een γ-Al2O3-katalysator bij 300-350 °C en bereikt een bijna kwantitatieve conversie met meer dan 90% selectiviteit voor isobuteen.
2.2. Oxidatie
2-methyl-1-propanol kan worden gedehydrogeneerd tot 2-methylpropanal (isobutanal) met behulp van oxidatiemiddelen zoals mangaandioxide of geschikte katalysatoren bij hogere temperaturen.
De Koch-Haaf-reactie zet 2-methyl-1-propanol om in trimethylazijnzuur in aanwezigheid van koolmonoxide en zwavelzuur met een hoge opbrengst (89%).
Oxidatie van isobutanol met dichromaat in aanwezigheid van zwavelzuur produceert isoboterzuur.
2.3. Alkylering
2-Methyl-1-propanol kan worden gebruikt voor alkyleringsreacties met ammoniak of aminen om verschillende alkylaminen te vormen.
2.4. Verestering
2-Methyl-1-propanol reageert met anorganische en organische zuren in aanwezigheid van katalysatoren om isobutylesters te vormen, evenals met zuurchloriden en zuuranhydriden.
3. Productie van 2-methyl-1-propanol
Drie belangrijke industriële processen voor de productie van 2-methyl-1-propanol (isobutanol) zijn als volgt:
- Propeenhydroformylering (oxosynthese)
- Katalytische hydrogenering van koolmonoxide
- Homologisatiereactie
3.1. Productie van 2-methyl-1-propanol door propeenhydroformylering (oxosynthese)
De oxosynthese is de meest efficiënte en kosteneffectieve methode voor grootschalige productie van isobutanol. Het omvat het laten reageren van propeen met synthesegas (een mengsel van koolmonoxide en waterstof) onder hoge druk en temperatuur, met behulp van een geschikte katalysator zoals rhodium- of kobaltcarbonylcomplexen.
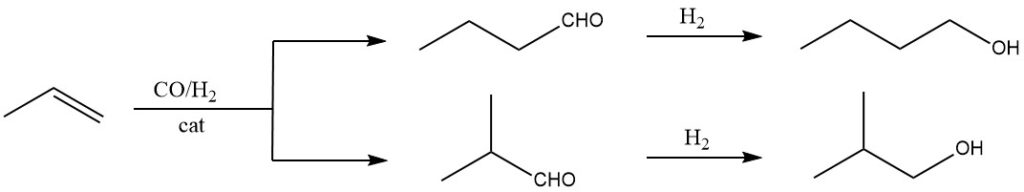
Het vormt een mengsel van alcoholen (1-butanol en 2-methyl-1-propanol). Dit is momenteel de dominante methode voor de synthese van isobutanol vanwege de hoge efficiëntie, kosteneffectiviteit en gemakkelijk verkrijgbare startmaterialen.
Raadpleeg voor meer informatie het artikel over 1-butanol.
3.2. Productie van 2-methyl-1-propanol door katalytische hydrogenering van koolmonoxide
Hoewel de CO-H2-gebaseerde methanolsynthese in de jaren 1920 commercieel succes boekte, werden analoge processen voor hogere alcoholen beperkt toegepast. Ondanks de aanvankelijke belofte zijn deze processen grotendeels verdwenen uit het industriële landschap.
Van deze historische pogingen is de BASF-isobutanololiesynthese van bijzonder belang. Dit proces maakte gebruik van een KOH-gemodificeerde methanolsynthesekatalysator onder hoge druk (30 MPa) en verhoogde temperatuur (430 °C) om CO en H2 om te zetten in een productmengsel dat ongeveer 50% methanol, 11-14% 2-methyl-1-propanol (isobutanol) en andere componenten bevatte.
BASF stopte echter in 1952 met de isobutanololiesynthese toen er meer economische alternatieven opkwamen. De oxosynthese en petrochemische routes boden superieure efficiëntie en kosteneffectiviteit voor zowel isobutanol als het waardevolle secundaire product, 2-methylpropeen.
3.3. Productie van 2-methyl-1-propanol door homologisatiereactie
Dit proces omvat het verlengen van de koolstofketen van een kortere alcohol zoals methanol of ethanol of alkaan om isobutanol te produceren. Hoewel technisch mogelijk, zijn geschikte homologisatiereacties voor isobutanolproductie niet erg efficiënt of commercieel levensvatbaar vergeleken met propeenhydroformylering.
Pogingen om directe butanolproductie te bereiken uit gemakkelijk verkrijgbare methanol en ethanol via homologisatiereacties hebben geen significante resultaten opgeleverd. Ondanks uitgebreide onderzoeksinspanningen is isobutanol slechts in kleine hoeveelheden verkregen als bijproduct.
Andere processen omvatten de hydratatie van 2-methylpropeen met 65% zwavelzuur om isobutanol te vormen.

4. Toepassingen van 2-methyl-1-propanol
2-methyl-1-propanol wordt vaak vergeleken met 1-butanol vanwege hun vergelijkbare toepassingen en wordt in verschillende industrieën gebruikt vanwege de lagere kosten en unieke eigenschappen.
Oplosmiddelen en additieven:
- Kosteneffectieve vervanger voor 1-butanol: 2-methyl-1-propanol dient als oplosmiddel, verdunningsmiddel en additief in nitrocellulose en synthetische harsen, reinigingsmiddelen en drukinkten.
- Harscompatibiliteit: Het is in staat om ketonharsen, ftalaatharsen, ureumharsen en melamine-formaldehydeharsen en wordt commercieel gebruikt, hoewel het minder effectief is als oplosmiddel voor fenol-formaldehydeharsen vergeleken met 1-butanol.
Esters:
- Isobutylacetaat: Deze ester wordt gebruikt als oplosmiddel voor vetten, gechloreerd rubber, polystyreen en cumaronharsen.
- Weekmakers: Ftaalzuur-, adipinezuur- en dicarbonzuuresters, evenals de fosforzuurester van 2-methyl-1-propanol, worden gebruikt als weekmakers, met name voor PVC en zijn copolymeren en voor cellulosederivaten.
Fenoxy Herbiciden:
Chlorofenoxyazijnzuuresters: De isobutylesters van 2,4-dichloor- en 2,4,5-trichloorfenoxyazijnzuur hebben een herbicide werking.
Andere toepassingen:
- Benzine-antivries: 2-methyl-1-propanol bezit antivrieseigenschappen in benzine.
- Ammoniumfosfaatextractie: Het gebruik ervan als extractiemiddel bij het terugwinnen van ammoniumfosfaat draagt bij aan de veelzijdigheid ervan.
5. Toxicologie van 2-methyl-1-propanol
2-methyl-1-propanol vertoont een lage acute orale en dermale toxiciteit, maar een matige aquatische toxiciteit. Effecten omvatten oog- en huidirritatie.
Acute toxiciteit:
- Lage orale toxiciteit: LD50 bij ratten is 2460 mg/kg (laagste gepubliceerde waarde).
- Lage dermale toxiciteit: LD50 bij konijnen is 3400 mg/kg.
- Matige aquatische toxiciteit: LC50 voor vissen is 1330 mg/l (96 uur).
- Narcose waargenomen bij muizen bij hoge inhalatieblootstelling (6400 ppm).
Lokale effecten:
- Matige tot ernstige oogirritatie bij konijnen.
- Matige huidirritatie bij konijnen (blootstelling 24 uur).
Chronische effecten:
- Langdurige studies suggereren mogelijke carcinogeniciteit bij ratten (beperkte gegevens).
- Mutageen in E. coli-bacteriën.
Menselijke blootstelling:
- Geen oogirritatie waargenomen bij mensen bij lage inhalatieblootstelling (100 ppm).
- Gemengde dampblootstelling (butylacetaat en 2-methyl-1-propanol) veroorzaakte vacuolaire keratitis bij werknemers (veroorzakende stof onduidelijk).
- Aanbrengen op de huid veroorzaakte lichte erytheem en hyperemie bij mensen.
Blootstellingslimieten:
- TLV (drempelwaarde): 50 ppm (TWA), 75 ppm (STEL) [ACGIH]
- MAK (maximaal toegestane concentratie): 100 ml/m³ [Duitsland]
- TRGS 900 (grenswaarde beroepsmatige blootstelling): 100 ml/m³ [Duitsland]
Referentie
- Butanols; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a04_463.pub3
