2-Chloorethanol: Eigenschappen, Reacties, Productie en Toepassingen

2-Chloorethanol, ook bekend als ethyleenchloorhydrine, is een organische chemische verbinding met de formule HOCH2CH2Cl. Het is een kleurloze vloeistof met een aangename geur die in het verleden een belangrijk tussenproduct was dat werd gebruikt om ethyleenoxide te produceren, maar dat is niet langer het geval.
Inhoudsopgave
1. Fysieke eigenschappen van 2-chloorethanol
Verdunde oplossingen van 2-chloorethanol in water hebben een enigszins zoete, aangename geur. Het is een ontvlambare vloeistof die een azeotroop kan vormen met water dat kookt bij 97,8 met 42% H2O wt. Ethyleenchloorhydrine is mengbaar met water, ethanol, aceton en benzeen.
De algemene fysieke eigenschappen van 2-chloorethanol staan vermeld in Tabel 1.
| Eigenschap | Waarde |
|---|---|
| CAS-registratienummer | [107-07-3] |
| Moleculair gewicht | 80,52 g/mol |
| Smeltpunt | -69 °C |
| Kookpunt | 129 °C |
| Dichtheid bij 20 °C | 1,2133 g/ml |
| Breukindex | 1,44 |
| Viscositeit (η) | 3,43 mPa.s |
| Dampspanning | 700 Pa (bij 20 °C) |
| Vlampunt | 57 °C |
| Zelfontbrandingstemperatuur | 425 °C |
| Explosief Limiet | 5–16% |
2. Chemische reacties van 2-chloorethanol
2-chloorethanol ondergaat reacties die kenmerkend zijn voor zowel alcoholen als alkylchloriden. De meest voorkomende reactie van 2-chloorethanol is dehydrochlorering om ethyleenoxide te vormen, dat industrieel werd gebruikt maar minder belangrijk werd vanwege alternatieve methoden.
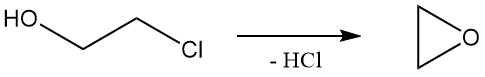
De relatieve snelheid van solvolyse van ethyleenchloorhydrine in water bij 97 °C is 1,0.
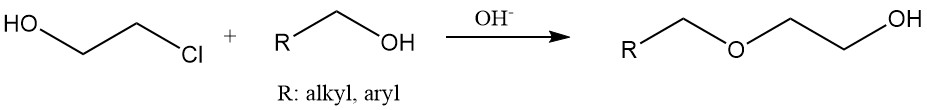
Hydroxyethylethers worden geproduceerd door 2-chloorethanol te laten reageren met alcoholen of fenolen onder basische omstandigheden. Hydroxyethylcellulose en gemodificeerd zetmeel worden geproduceerd door deze materialen te behandelen met ethyleenchloorhydrine.
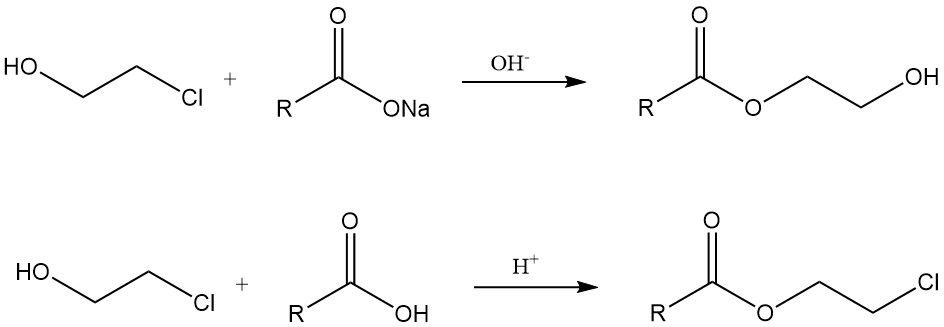
Chloorhydrinen reageren met metaalcarboxylaten in aanwezigheid van een base om hydroxyethylesters te geven. Aan de andere kant worden β-chlooresters gevormd door reacties met carbonzuren onder zure omstandigheden of uit zuurchloriden.
Cyclisch carbonaat kan worden geproduceerd door de reactie van 2-chloorethanol met koolstofdioxide in aanwezigheid van een amine.
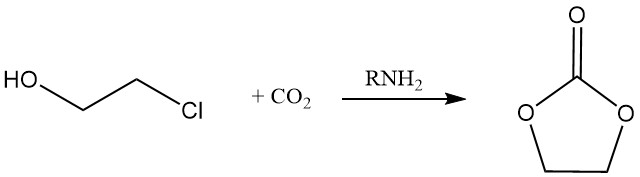
Een vergelijking van de reactiesnelheid van ethyleenchloorhydrine met verschillende aminen geeft de volgende volgorde: n-amylamine > cyclohexylamine > aniline. De reactie van ethyleenchloorhydrine met ammoniak geeft monoethanolamine. Quaternaire ammoniumverbindingen worden gevormd uit ethyleenchloorhydrine en tertiaire aminen.
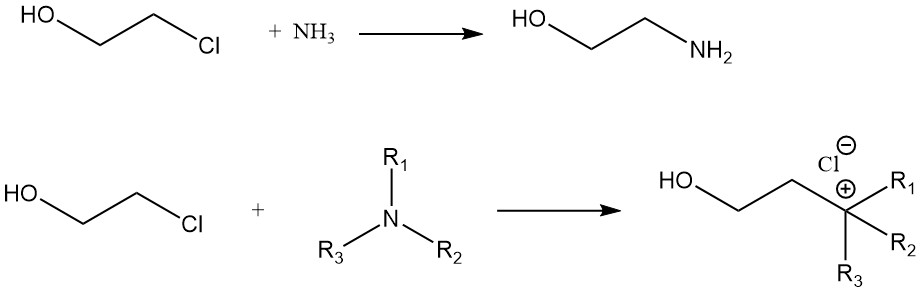
Andere 2-chloorethanolreacties omvatten de vorming van nitrillen uit cyaniden, acetalen uit aldehyden, oxazolidinonen uit cyanaten en de oxidatie van ethyleenchloorhydrine tot monochloorazijnzuur.
De reactie van 2-chloorethanol met fosgeen vormt 2-chloorethylchloorformiaat.
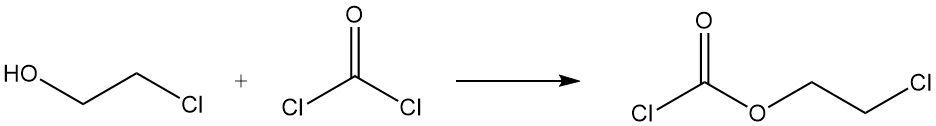
3. Productie van 2-chloorethanol
Al in 1904 produceerde BASF 2-chloorethanol door ethyleen en CO2 te laten reageren in een waterige bleekpoederoplossing.
Tegenwoordig wordt 2-chloorethanol geproduceerd door de hypochlorering van ethyleen met hypochloorzuur, dat wordt gevormd door de omkeerbare reactie van chloor en water, wat resulteert in een beperkte efficiëntie.
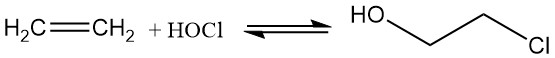
Cl2 + H2O ⇌ HOCl + HCl ; K = 4.2 x 10-4
De reactie tussen ethyleen en hypochloorzuur is sneller dan de reactie van ethyleen en chloor om dichloorethaan te vormen, dus wanneer het ethyleen aan het waterige systeem wordt toegevoegd, wordt bij voorkeur chloorhydrine geproduceerd.
Een minimale hoeveelheid dichloorethaan wordt gevormd met goed roeren in de gasfase als de 2-chloorethanolconcentratie niet hoger is dan 6-8%. Echter, toenemende HCl-concentratie vermindert beschikbare HOCl, wat leidt tot significante dichloorethaanvorming nadat HCl groter is dan 3%.
Vanwege de lage wateroplosbaarheid van dichloorethaan (0,869 g/100 ml bij 20 °C) vormt het een aparte fase, waarbij zowel chloor als ethyleen wordt opgelost voor verdere dichloorethaanvorming.
Laboratoriumonderzoeken en reactoroptimalisatie
Een laboratoriumonderzoek onderzocht hypochloreringsparameters met behulp van enkelvoudige kolom- en recycle-reactoropstellingen. De resultaten tonen aan dat temperaturen van 35-50 °C en een ethyleenoverschot van 50% de voorkeur hadden voor efficiënte dichloorethaanstripping.
Een opbrengst van 88% van 2-chloorethanol werd bereikt met behulp van continue werking bij een ethyleenchloorhydrineconcentratie van 6,4%, een temperatuur van 35 °C, een ethyleen:chloorverhouding van 1,42 en 71 g/u chloortoevoer.
De productie van 2-chloorethanol voor ethyleenoxide is vervangen door directe ethyleenoxidatie met zilverkatalysatoren. Propyleenoxide en epichloorhydrine worden echter nog steeds gemaakt door de directe oxidatie van de oorspronkelijke olefine.
Bij de productie van ethyleenchloorhydrine op industriële schaal werden chloor, ethyleen en water gelijktijdig omhoog geïntroduceerd via gepakte torens. Deze reactoren minimaliseren het ethyleen-chloorcontact en maximaliseren het contact tussen koolwaterstof en vloeibare fase.
De toevoerleidingen zijn strategisch gepositioneerd om volledige chlooroplossing te garanderen vóór de introductie van ethyleen. Sommige fabrieken gebruiken aparte mengkolommen voor chloor en water vóór de ethyleenreactietoren.
De resulterende productstroom bevat een 4,5-5,0% 2-chloorethanoloplossing met opbrengsten van 85-89% omgezet ethyleen. Dichloorethaan en bis(2-chloorethyl)ether zijn kleine bijproducten.
4. Toepassingen van 2-chloorethanol
2-chloorethanol werd voornamelijk gebruikt voor de synthese van ethyleenoxide, maar het vindt nog steeds diverse toepassingen in verschillende industrieën.
2-chloorethanol wordt gebruikt als katalysator voor olefinemetabolisme en cycloalkenering-openende polymerisatie in de vorm van adducten met wolfraam- of molybdeenhalogeniden en organoaluminiumverbindingen.
Het wordt gebruikt bij de productie van kleurstoffen, farmaceutica, biociden, weekmakers en thiodiglycol.
Het wordt gebruikt als grondstof bij de productie van gemodificeerde cellulose (hydroxyethylcellulose) en zetmeel, en om verschillende materialen op te lossen, waaronder celluloseacetaat en ethylcellulose die worden gebruikt in coatings en films. Het vindt toepassing in textieldruk voor het oplossen van kleurstoffen en in processen zoals het ontwassen van oliën, het raffineren van hars, het extraheren van pijnboomlignine en zelfs het reinigen van machines.
5. Toxicologie van 2-chloorethanol
Ethyleenchloorhydrine brengt aanzienlijke gezondheidsrisico’s met zich mee. Veilige behandeling vereist bescherming van de huid, ogen en luchtwegen vanwege de hoge dermale toxiciteit en matige orale en inhalatietoxiciteit.
2-chloorethanol kan worden opgenomen via de huid, inademing en inname. Acute blootstelling kan dodelijk zijn via huidcontact of inademing. Symptomen zijn onder meer oogschade, ademhalingsmoeilijkheden, maag-darmklachten en orgaanschade.
Toxiciteitsgegevens:
- Oraal: matig toxisch, met LD50-waarden rond de 60-95 mg/kg bij ratten.
- Huid: kan worden opgenomen via de huid, waarbij mogelijk schadelijke niveaus worden bereikt. Lokale irritatie is minimaal.
- Oog: Contact kan ernstige schade of zelfs blindheid veroorzaken. Onmiddellijk spoelen is cruciaal.
- Inademing is dodelijk bij verzadigde dampconcentraties. De geschatte LC50 ligt tussen 16 en 62 ppm.
- Er is geen bewijs van reproductieve of ontwikkelingseffecten in dierstudies.
- Mutageniteit: Positieve en negatieve resultaten in verschillende tests suggereren de mogelijkheid van basepaarsubstitutiemutaties.
- Carcinogeniteit: Er is geen bewijs van carcinogeniteit in dierstudies. Gegevens bij mensen zijn niet doorslaggevend.
2-Chloorethanol wordt geclassificeerd als ontvlambaar, acuut toxisch via verschillende routes en veroorzaakt ernstige oogschade. Beroepsmatige blootstellingslimieten variëren per agentschap, variërend van 1–5 ppm.
Referentie
- Chlorohydrins; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a06_565.pub2
