Produzione di ammine aromatiche
Le ammine aromatiche sono prodotte da tre tipi di reazioni:
- Riduzioni: utilizzando elementi metallici come Ferro (Fe), Zinco (Zn), Stagno (Sn), Alluminio (Al) o i loro sali corrispondenti; composti contenenti zolfo; procedure elettrochimiche; e idrogenazione catalitica.
- Sostituzioni nucleofile: che implicano lo scambio di sostituenti come gruppi alogeni, idrossilici, alcossilici e solfonici.
- Riarrangiamenti e degradazioni: tra cui trasformazioni come i riarrangiamenti della benzidina e Beckmann, insieme alle degradazioni di Schmidt e Hofmann.
Va notato che i primi due tipi di reazione sono più importanti. I riarrangiamenti e le degradazioni chimiche raramente danno luogo a prodotti di reazione puri con rese elevate.
Sommario
1. Produzione di ammine aromatiche mediante riduzione di composti nitro
Le ammine aromatiche vengono prodotte mediante riduzione di composti aromatici carbonio-azoto contenenti stati di ossidazione dell’azoto che vanno da +3 a +2. In particolare, la riduzione dei composti nitro è stata ampiamente utilizzata su scala industriale grazie alla preparazione precisa di materiali di partenza che può essere ottenuta in una vasta gamma di composti.
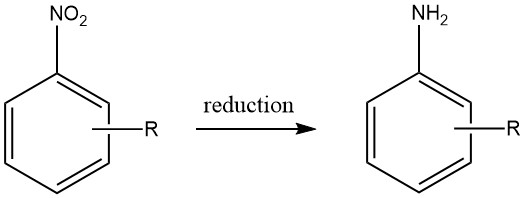
Tuttavia, la fattibilità economica della produzione di altri composti azotati aromatici come materiali di partenza validi per le ammine aromatiche è limitata, limitando così la loro utilità pratica.
1.1. Riduzione chimica
Durante il processo di riduzione chimica che converte i composti nitro aromatici in ammine aromatiche, l’atomo di idrogeno che si lega all’atomo di azoto in genere proviene dal solvente, spesso acqua, o viene introdotto mediante l’uso di acido aggiunto.
Tra gli agenti fondamentali per la riduzione, vari metalli come ferro, stagno e zinco hanno la precedenza, insieme a fosforo, solfuri, solfiti e anidride solforosa, che vengono anche utilizzati.
È pertinente notare che la potenziale ossidazione dell’agente riducente, che porta alla formazione di un prodotto di scarto potenzialmente inutilizzabile, richiede misure di smaltimento attente e rispettose dell’ambiente.
Di conseguenza, l’importanza della riduzione chimica è diminuita rispetto alla riduzione catalitica, in particolare nella sintesi su larga scala di vari prodotti.
1.1.1. Riduzione con ferro
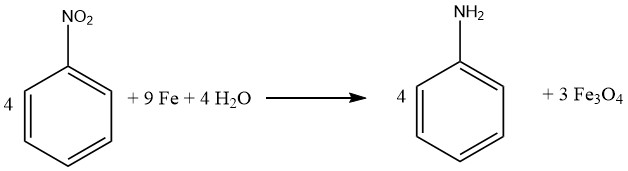
Il processo di riduzione dei composti con ferro, chiamato anche riduzione di BÉCHAMP, è stato inizialmente chiarito nel 1854 e viene spesso eseguito in condizioni acide diluite. Il ferro mantiene il suo ruolo preminente come catalizzatore metallico primario per la conversione dei composti nitro nelle loro corrispondenti ammine aromatiche.
Praticamente tutti i composti nitro possono essere ridotti con successo ad ammine aromatiche usando ferro in acqua e in ambiente acido. In particolare, l’emergere di sottoprodotti indesiderati è principalmente previsto quando la molecola contiene altri sostituenti suscettibili di riduzione, come nitroso, azo, idrazina, solfossido o gruppi nitro aggiuntivi, o se può subire saponificazione.
I legami multipli carbonio-carbonio rimangono inerti all’attacco. In particolare, sia Bayer (Germania) che Mobay (Stati Uniti) implementano l’approccio di riduzione mediata dal ferro per generare ossidi di ferro, ottenendo anilina come sottoprodotto.
Un altro caso di rilevanza industriale è l’impiego esclusivo del ferro in un ambiente neutro per ridurre l’acido 4,4′-dinitro-2,2′-stilbenedisolfonico per produrre acido 4,4′-diammino-2,2′-stilbenedisolfonico. Inoltre, numerosi intermedi di coloranti di volume limitato subiscono una riduzione tramite il metodo mediato dal ferro.
1.1.2. Riduzione con altri metalli
I gruppi nitro aromatici subiscono una riduzione impiegando zinco, stagno e alluminio, o i loro sali corrispondenti, in un ambiente acido, neutro o alcalino.
Questi agenti riducenti sono blandi e quindi non interferiscono con gruppi funzionali come -OH, -OR, -COOH, -CO-Ar, alogeno o -CN. Mentre trovano applicazioni in contesti di laboratorio, il loro utilizzo pratico non ha una sostanziale rilevanza industriale.
Ciò è principalmente attribuito all’impiego prevalente dell’idrogenazione catalitica, che è in linea con le linee guida normative relative alla gestione delle acque reflue e alle pratiche di smaltimento.
1.1.3. Riduzioni con solfuro, idrogenosolfito e anidride solforosa
I composti contenenti più gruppi nitro possono essere ridotti, producendo nitroammine, utilizzando una quantità equimolare di reagente solfuro. Sono preferiti solfuro di sodio o di ammonio. Una resa dell’87% di m-nitroanilina si ottiene riducendo 1,3-dinitrobenzene con solfuro di sodio.
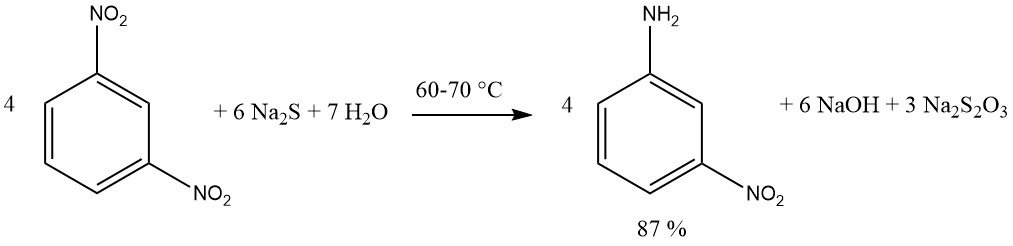
L’aggiunta di zolfo elementare diminuisce la quantità richiesta di solfuro di sodio. Ad esempio, il 4-nitrotoluene viene ridotto con elevata efficienza per produrre 4-amminobenzaldeide utilizzando solfuro di sodio e zolfo.
I gruppi azoici rimangono inalterati quando la riduzione mediante solfuro di sodio avviene nell’intervallo di temperatura di 40-70 °C, con brevi durate di reazione e in assenza di eccesso di solfuro.
Tuttavia, i sostituenti alogeni vengono prontamente sostituiti da gruppi -SH. Nei casi in cui un eccesso di agente riducente non è un problema, può essere utilizzato idrogenosolfuro di ammonio in presenza di ammoniaca.
La riduzione di composti nitro, nitroso o azoici aromatici alle loro corrispondenti ammine aromatiche utilizzando solfito o idrogenosolfito è riconosciuta come reazione di Piria (PIRIA, 1851).
In condizioni acquose o alcoliche, vengono generati prevalentemente acidi N- e C-solfonici. Per trattamento con acido minerale, si forma una miscela di ammine aromatiche e acidi amminobenzensolfonico.
La presenza di un intermedio chinone ossima facilita l’introduzione di idrogenosolfito sull’anello aromatico durante la riduzione di orto- e para-nitroso-fenoli o naftoli.
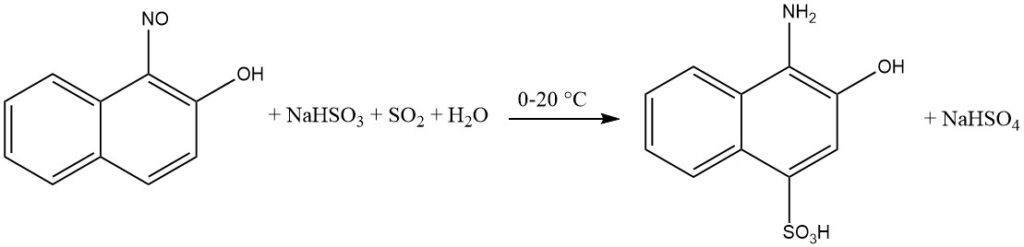
Nello specifico, quando il gruppo idrossile è in posizione para, il gruppo solfo sarà incorporato in posizione 2. I sostituenti posizionati in posizione 3, come Cl o COOH, vengono sostituiti da idrogeno.
L’uso industriale della riduzione con anidride solforosa è diventato rilevante solo quando la reazione laterale di C-solfonazione è stata ridotta.
Questa procedura è condotta in modo ottimale all’interno di un sistema sigillato, impiegando condizioni fortemente acide (ad esempio, acido solforico acquoso al 15-40%) e temperature comprese tra 80 e 180 °C. Catalizzatori come iodio, acido iodidrico o sali di iodio sono integrali e i reattori fabbricati con materiali rivestiti in vetro sono ottimali.
Il ditionito di sodio produce una riduzione quasi quantitativa dei gruppi nitro e nitroso aromatici.
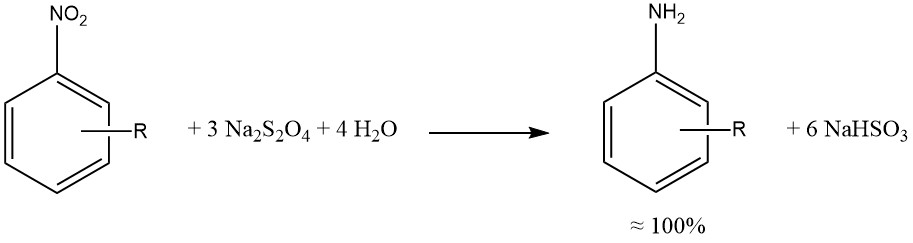
Quando possibile, le riduzioni mediante solfuro, solfito e altri composti di zolfo sono state sostituite da idrogenazioni catalitiche, producendo miscele di reazione più pulite, corrosione ridotta (associata all’uso di SO2) e minori preoccupazioni ambientali.
1.1.4. Riduzione elettrochimica di composti nitro
La riduzione elettrochimica è in genere considerata una variante specializzata della riduzione chimica. In questo approccio, un composto inorganico funge da agente riducente e la forma ossidata viene successivamente ridotta al catodo, consentendole di reagire di nuovo.
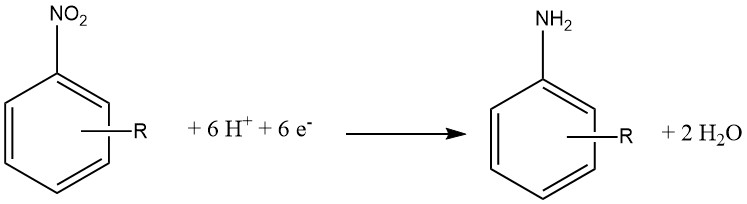
Il materiale del catodo può essere costituito da Pb, Sn, Ni o Cu e sul lato del catodo di una membrana semipermeabile viene utilizzato il 15-20% di acido cloridrico. Sul lato dell’anodo viene utilizzato il 30% di acido solforico.
Nonostante le riduzioni elettrochimiche siano note da oltre un secolo, non sono state ampiamente utilizzate nelle applicazioni commerciali fino a poco tempo fa. Tuttavia, l’interesse per questo metodo sta crescendo man mano che i progressi nella tecnologia delle celle e nelle membrane continuano a migliorare.
Alcuni prodotti sono stati prodotti con successo tramite riduzione elettrochimica, in particolare in India, come l’acido p-amminobenzoico, il p-amminofenolo e molti altri, che hanno raggiunto la scala di un impianto pilota o oltre.
1.2. Nitrocomposti di idrogenazione catalitica
1.2.1. Riduzione con idrazina
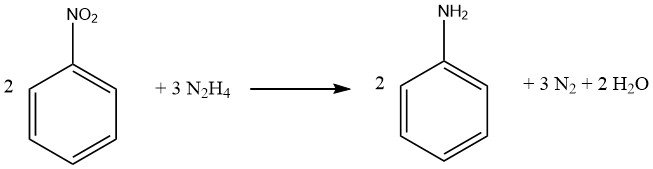
Il processo di riduzione dei composti nitro aromatici mediante idrazina è una forma specializzata di idrogenazione catalitica, in cui l’idrazina funge da fonte di idrogeno.
Il meccanismo di decomposizione dell’idrazina sui catalizzatori di metalli preziosi varia in base al valore del pH, determinando una maggiore resa di idrogeno per mole di idrazina a livelli di pH più elevati.
In condizioni debolmente alcaline o neutre, viene prodotta 1 mole di idrogeno.
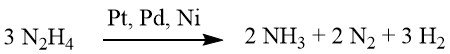
Tuttavia, se integrato con idrossido di bario o carbonato di calcio, questa resa aumenta fino a 2 moli di H2.
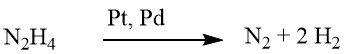
Sebbene la riduzione mediante idrazina possa talvolta procedere senza un catalizzatore, viene in genere condotta in presenza di un catalizzatore di idrogenazione, come nichel Raney, palladio su carbonio o palladio su carbonato di calcio.
Idealmente 1 mole di idrazina fornisce quattro equivalenti di riduzione, a seconda del pH e del catalizzatore, sebbene vengano praticamente generati meno equivalenti, rendendo necessario un eccesso di idrazina. È importante notare che i doppi legami carbonio-carbonio e i gruppi carbonilici rimangono inalterati. L’isolamento degli intermedi durante il processo di riduzione dipende dalle condizioni di reazione.
Nei casi di riduzione non catalitica con idrazina, i composti contenenti gruppi carbonilici vengono ridotti ai loro corrispondenti composti idrossilici tramite la formazione di intermedi idrazone.
La riduzione dei composti nitro aromatici mediante idrazina, rispetto alla riduzione catalitica mediante idrogeno, presenta vantaggi limitati. Trova la sua utilità principalmente negli esperimenti di laboratorio e per piccoli volumi di prodotto, dove possono essere impiegate normali condizioni di pressione.
Su scala di laboratorio, il cicloesene è stato anche esplorato come fonte di idrogeno per l’idrogenazione catalitica di composti polinitro.
1.2.2. Riduzione di gruppi nitro con idrogeno
La generazione di mono- o poliammine aromatiche primarie comporta generalmente l’idrogenazione catalitica del composto nitro corrispondente, condotta in fase di vapore o in fase liquida, e può essere eseguita con o senza la presenza di un solvente. Numerosi prodotti di spicco, tra cui anilina, o- e p-toluidina, 2,4- e 2,6-diaminotoluene e 1-naftilammina, vengono fabbricati utilizzando questo metodo.
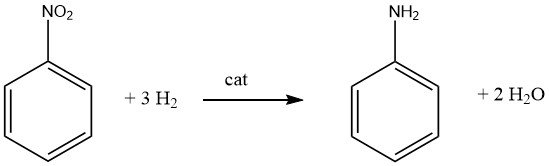
È importante riconoscere che la riduzione catalitica dei composti nitro è esotermica. Durante l’idrogenazione in fase liquida del nitrobenzene, si verifica un rilascio di 553,5 kJ/mol di energia, mentre l’idrogenazione in fase vapore a 200 °C libera 493,2 kJ/mol.
Se non adeguatamente dissipato, questo calore può portare a esplosioni potenzialmente pericolose, in particolare se si verifica la decomposizione termica del composto nitro o se vengono innescate reazioni di condensazione, come nel caso dei composti cloro-nitro.
Per mitigare questi rischi, la concentrazione del composto nitro, la quantità e la pressione parziale dell’idrogeno, la temperatura e l’attività del catalizzatore sono meticolosamente regolate.
Idrogenazione in fase vapore
L’applicazione industriale dell’idrogenazione in fase vapore è limitata dal punto di ebollizione e dalla stabilità termica dei composti nitro.
Negli Stati Uniti, una parte sostanziale di anilina viene prodotta tramite idrogenazione in fase vapore del nitrobenzene utilizzando un catalizzatore rame-silice, ottenendo un impressionante tasso di conversione del 99%. Bayer impiega Pd-allumina per questo scopo in Europa e Brasile.
Idrogenazione in fase liquida
L’idrogenazione in fase liquida della maggior parte dei composti nitro aromatici è generalmente preferita. In questo scenario, pressione e temperatura possono essere manipolate indipendentemente. È importante notare che temperature superiori a 170-200 °C possono promuovere reazioni di idrogenazione che coinvolgono l’anello aromatico.
Pertanto, il processo di riduzione viene in genere eseguito nell’intervallo 100-170 °C. Alcuni composti, come l’1-bromo-4-nitrobenzene, necessitano di temperature ancora più basse (20-70 °C) per prevenire la scissione sensibile del gruppo.
A livello industriale, vengono impiegate pressioni che vanno da 1 a 15 MPa (da 10 a 150 bar). Per l’idrogenazione di composti nitroaromatici con maggiore sensibilità, si raccomandano pressioni più basse (da 0,1 a 5 MPa, da 1 a 50 bar).
La pressione influenza principalmente la velocità di reazione influenzando il trasferimento di fase e la saturazione del catalizzatore con idrogeno. Il tempo di reazione dipende da vari parametri, tra cui pressione dell’idrogeno, concentrazione, temperatura, attività e concentrazione del catalizzatore e miscelazione.
Spesso, si osserva un periodo di induzione iniziale, che non è influenzato dall’attività del catalizzatore. I tempi di reazione in genere vanno da pochi minuti a diverse ore. Sono necessarie durate più lunghe se questi parametri non sono opportunamente ottimizzati.
A causa della natura intrinsecamente esotermica della reazione, è necessario rispettare rigorose precauzioni di sicurezza, in particolare nell’idrogenazione industriale di composti polinitro aromatici in assenza di solventi.
La natura esotermica è gestita dall’aggiunta continua di piccole quantità di nitro composto, mantenendo la sua concentrazione al di sotto del 2%. È possibile introdurre acqua deionizzata per assorbire il calore di reazione tramite evaporazione continua.
Ciò non solo attenua i problemi correlati al calore, ma influisce anche sull’attività del catalizzatore; un contenuto d’acqua più elevato nell’idrogenazione in batch del dinitrotoluene senza solvente porta a una riduzione dell’attività del catalizzatore Pd su carbonio.
Se l’ammina è solubile in acqua, può essere utilizzata come solvente. Questo approccio è adatto anche quando il nitro composto forma sali solubili in acqua con alcali, come si vede con gli acidi nitrocarbonico o solfonico.
In alcuni casi, soluzioni dell’ammina in acqua (30-40%) possono essere generate direttamente all’interno del reattore di idrogenazione, eliminando la necessità di ulteriori fasi di concentrazione.
Solventi come metanolo e 2-propanolo sono solitamente preferiti. Diossano, tetraidrofurano e N-metilpirrolidone sono stati utilizzati anche. Ad esempio, l’o-nitrofenolo raggiunge buone rese di idrogenazione nel metanolo utilizzando Pt su carbonio.
Quando si utilizza un solvente immiscibile in acqua, come il toluene, il contenuto di acqua deve essere ridotto al minimo per preservare l’attività del catalizzatore, in modo simile all’idrogenazione senza solventi. In alcuni casi, i composti nitro altamente polari, come il bis(4-ammino-3-nitrofenil)solfone, vengono idrogenati utilizzando ammoniaca liquida.
Catalizzatori di idrogenazione
L’idrogenazione in fase vapore si basa su metalli o derivati metallici su supporti all’interno di letti fissi o fluidizzati. L’idrogenazione in fase liquida impiega prevalentemente metalli con ampie aree superficiali, come nichel Raney, nichel-ferro Raney, cobalto Raney e rame Raney, a causa del loro costo relativamente inferiore.
I catalizzatori di metalli preziosi, come Pt e Pd, sono generalmente utilizzati a concentrazioni dello 0,5-5% in peso su materiali di supporto ad alta area superficiale come carbone, silice, ossido di alluminio o carbonati alcalino-terrosi.
La forma di catalizzatore in polvere è adatta per le sospensioni, mentre le forme in pellet sono utilizzate in letti fissi. È fondamentale ottimizzare le condizioni che consentono il riutilizzo e la rigenerazione del catalizzatore, oltre a essere economiche per la produzione su larga scala (>500 t/a).
I sottoprodotti di decomposizione e ossidazione spesso portano alla disattivazione del catalizzatore tramite ostruzione superficiale. Anche piccole quantità di composti di zolfo, arsenico o antimonio possono avvelenare i catalizzatori. Tuttavia, questi veleni del catalizzatore mostrano un impatto minore all’aumentare degli stati di ossidazione (ad esempio, As3- → As5+ o S2- → S4+).
Con catalizzatori di metalli nobili, gli ioni alogenuro, sodio, magnesio, cobalto e CO2 possono ridurre l’attività. I composti nitroaromatici contenenti zolfo dimostrano una migliore riduzione utilizzando solfuro di molibdeno o di tungsteno, o con catalizzatori di nichel contenenti zinco o carbonato di calcio.
I catalizzatori Pd su carbonio possono essere influenzati dai sali di rame, mentre sia il nitrofenolo che il nitrocresolo agiscono come forti veleni per catalizzatori e attivatori di decomposizione durante l’idrogenazione del dinitrotoluene.
Idrogenazione di composti nitro sostituiti con alogenuri
L’idrogenazione di composti nitro con sostituzioni di alogenuri spesso richiede temperature più basse per impedire lo scambio alogenuro-idrogeno. I catalizzatori, in particolare i catalizzatori metallici avvelenati da solfuri, mostrano un’attività ridotta in tali condizioni.
L’1-cloro-2-nitrobenzene può essere ridotto efficacemente a 80 °C e 1,0-5,0 MPa (10-50 bar) utilizzando un catalizzatore al 5% in peso di Pt su carbonio trattato con acido solforico diluito, seguito da H2 e H2S. Questo catalizzatore può essere riciclato fino a 30 volte senza ulteriore purificazione.
Metodologie simili sono state impiegate per l’idrogenazione del 3-cloronitrobenzene utilizzando catalizzatori trattati con tiocianato. L’uso di catalizzatori modificati migliora la selettività e l’efficacia della reazione, con conseguenti rese elevate e un’eccellente purezza del prodotto.
Attrezzature e materiali da costruzione
L’idrogenazione in fase vapore è in genere condotta in modalità continua, mentre l’idrogenazione in fase liquida può essere ottenuta mediante processi batch o continui, a seconda della scala. L’idrogenazione continua in fase liquida è impiegata principalmente per pochi prodotti selezionati su larga scala, come dinitrotoluene, nitrotoluene e 1-nitronaftalene.
Tuttavia, la maggior parte della produzione di ammine aromatiche prevede l’idrogenazione in batch utilizzando sospensioni di catalizzatore. Questo approccio consente transizioni rapide tra prodotti, un lusso non concesso quando si utilizzano catalizzatori a letto fisso.
È importante una miscelazione efficace delle tre fasi (gas idrogeno, soluzione di composto nitro e catalizzatore solido). Il rapido trasporto dei reagenti ai centri catalizzatori attivi e la successiva rimozione del prodotto sono essenziali per reazioni ottimali.
Mentre le idrogenazioni catalitiche in batch tradizionali utilizzano autoclavi in acciaio agitato o in acciaio inossidabile, la crescente adozione della tecnologia dei reattori a loop ha portato a prestazioni migliori. I reattori a loop sono stati impiegati con successo per l’idrogenazione catalitica di composti nitro aromatici da Buss (Basilea, Svizzera).
I vantaggi rispetto alle autoclavi agitate includono un migliore trasferimento di calore e massa, nonché una migliore selettività della reazione. L’idrogenazione continua generalmente si traduce in tempi di ciclo batch più brevi e rese di prodotto aumentate. Inoltre, il consumo di catalizzatore è spesso ridotto.
I reattori a circuito offrono un metodo semplice e affidabile per la transizione dall’impianto pilota alla produzione, poiché l’aumento di scala è determinato principalmente dalla configurazione dell’ugello e dalla velocità di pompaggio.
Al contrario, l’aumento di scala per le autoclavi agitate è più complesso a causa della notevole discrepanza tra piccoli recipienti pilota e grandi recipienti di produzione (ad esempio, rapporti da 1:1500 a 1:12500).
I gradienti di temperatura e concentrazione, insieme a tempi di reazione più lunghi in recipienti di produzione più grandi, spesso portano a reazioni collaterali indesiderate e rese di prodotto ridotte.
I reattori a circuito attenuano queste sfide limitando le reazioni a una zona altamente agitata e ben definita con tempi di ciclo sostanzialmente più brevi.
2. Produzione di ammine aromatiche mediante sostituzione nucleofila
In genere tutti i sostituenti non carboniosi presenti sull’anello aromatico possono essere sostituiti da gruppi amminici, ma solo alcune di queste reazioni di sostituzione hanno un significato industriale significativo. Questi includono:
- Sostituzione di gruppi alogenuri
- Sostituzione di gruppi idrossilici ed eterei
- Sostituzione di gruppi solfo
2.1. Scambio di alogenuri
La sostituzione di alogenuri è utile per generare ammine contenenti sostituenti mono-, poli- o eterociclici, insieme alle diarilammine. Inoltre, questo processo si estende alle arilpoliammine, producendo numerosi prodotti di rilevanza, in particolare come intermedi per coloranti e pigmenti.
2.1.1. Alogenuri attivati
Gli alogenuri aromatici che contengono gruppi elettron-attrattori orto e/o para, come -NO2 o -CN, possono subire reazioni di sostituzione aromatica nucleofila. Sia l’o-cloronitrobenzene che il p-cloronitrobenzene subiscono reazioni con ammoniaca a 170 °C, mentre il 2,4-dinitroclorobenzene reagisce a una temperatura inferiore di 70 °C senza richiedere un catalizzatore.
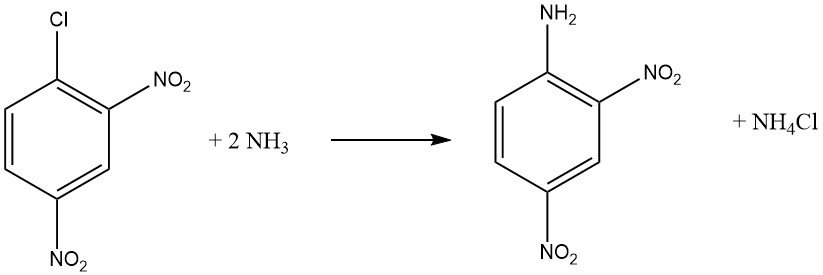
La velocità di reazione tra il composto aloaromatico e l’ammina è influenzata dalla basicità dell’ammina, tranne quando l’impedimento sterico è un fattore.
Quando si fa reagire la metilammina o l’ammoniaca con una soluzione o sospensione di 2,4-dinitroclorobenzene a temperature più elevate, si ottiene N-metil-2,4-dinitronilina con buone rese, invece della 2,4-dinitroanilina.
Condizioni di reazione:
La sintesi della 4-nitroanilina comporta la reazione del 4-cloronitrobenzene con un eccesso di ammoniaca acquosa in un reattore di titanio agitato a 175 °C e 4,2 MPa (42 bar) per una durata di 10 ore, ottenendo una resa del 99,3%.
Un altro esempio è la preparazione di 4-(4-metilanilino)-3-nitrobenzenesolfonammide, ottenuta riscaldando 4-cloro-3-nitrobenzenesolfonammide con p-toluidina a 130 °C per 5 ore, con una resa del 90,1%.
Nella sintesi di 4-nitrodifenilammina, un precursore per gli antiozonanti della gomma, il 4-nitroclorobenzene viene condensato con anilina in clorobenzene. Tuttavia, i derivati di p-fenilendiammina N-alchilati non possono essere prodotti in un mezzo acquoso.
2.1.2. Alogenuri non attivati
Gli alogenuri non attivati presentano reazioni di eliminazione-addizione tramite un intermedio benzinico, un processo che richiede temperature più elevate rispetto alla sostituzione aromatica nucleofila. Tali reazioni producono miscele isomeriche se sono presenti sostituenti aggiuntivi, limitandone l’applicazione industriale.
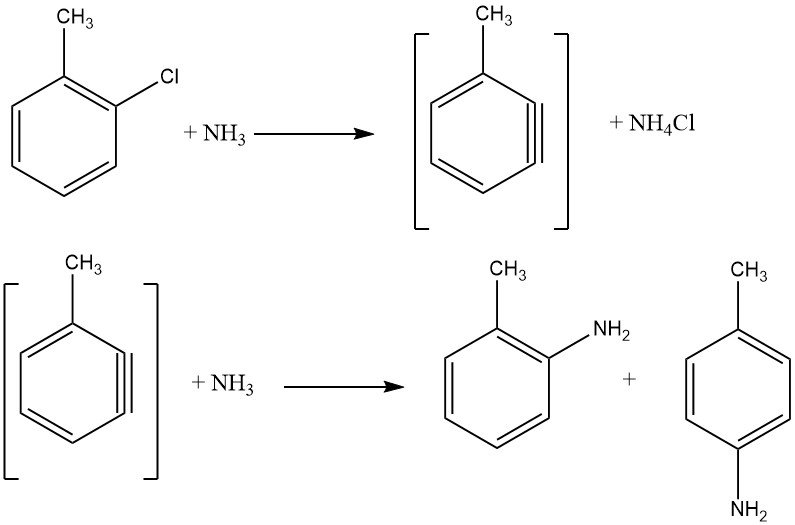
La reazione tra clorobenzene e ammoniaca avviene a velocità ragionevoli solo sopra i 200 °C, spesso richiedendo la presenza di un catalizzatore come sali di rame (I) e rame (II) o i loro complessi amminici. Vengono impiegate anche ammidi metalliche, come NaNH2 e LiNEt2. L’energia richiesta per facilitare lo scambio di alogenuri è inversamente proporzionale all’ordine degli alogenuri attivati: F < Cl < Br < I.
Condizioni di reazione:
Tipicamente condotta in una sospensione o soluzione acquosa a temperature e pressioni elevate, un attento monitoraggio della temperatura è fondamentale durante la fase di riscaldamento nei processi batch a causa della natura esotermica delle reazioni arilalogenuro-ammina.
I processi continui generalmente mitigano questa preoccupazione. L’alogenuro di idrogeno rilasciato viene neutralizzato utilizzando ammoniaca in eccesso o aggiungendo basi come carbonato di sodio o ossido di calcio. Con un eccesso sostanziale di ammina, la reazione di solito procede con una resa quasi completa.
In caso di eccesso insufficiente di ammine fortemente basiche in soluzioni acquose, possono verificarsi reazioni collaterali come idrolisi o formazione di diarilammina.
L’idrolisi dei cianogruppi in ammidi in soluzioni acquose può essere evitata utilizzando solventi inerti. Gli acidi carbossilici possono essere facilmente trasformati nelle corrispondenti ammidi conducendo la reazione in mezzi non acquosi.
Materiali di costruzione:
A temperature e pressioni elevate, la presenza di alogenuri e ammine può indurre una grave corrosione, rendendo difficile la selezione di materiali e attrezzature. Mentre le normali autoclavi in acciaio possono essere sufficienti per scopi di laboratorio, è prevedibile una sostanziale riduzione dello spessore delle pareti (alcuni millimetri all’anno).
Inoltre, la corrosione sotto sforzo può accelerare il deterioramento del reattore. Gli acciai bassolegati sono inadatti per le unità di produzione, in particolare quelle che impiegano reattori continui. Sono state ottenute reazioni di successo in mezzi acquosi utilizzando acciai inossidabili, in particolare acciai austenitici contenenti cromo e nichel del tipo 316.
Tuttavia, anche questi materiali sono inclini alla corrosione, il che porta all’utilizzo di leghe più resistenti alla corrosione come Hastelloy e Inconel. Anche materiali per reattori come zirconio, titanio e tantaclad (acciaio rivestito con tantalio per esplosione) hanno trovato applicazioni.
2.2. Scambio di gruppi idrossilici ed eterei
Lo spostamento di un gruppo idrossilico aromatico da parte di un’ammina non è limitato a fenoli e cresoli; si estende anche ai derivati di chinolina e isochinolina. L’ammoniaca può sostituire i gruppi alcossilici attivati in posizioni orto o para, dove l’attivazione è indotta da gruppi nitro, alogeno o ciano.
Ad esempio, il 2,4-dinitroanisolo reagisce con l’ammoniaca a temperature comprese tra 50 e 200 °C, producendo 2,4-dinitroanilina con una resa dal 50 al 90%.
L’interesse per le reazioni fenolo-ammina spesso dipende dal costo della materia prima fenolica. I principali processi di scambio sono:
1. Reazione in mezzo acquoso senza catalizzatore:
A temperatura e pressione elevate, l’acido 3-nitrosalicilico reagisce con l’ammoniaca acquosa per produrre acido 2-ammino-3-nitrobenzoico.
2. Reazione in presenza di un catalizzatore acido:
Gli m-amminofenoli si formano dalla reazione di resorcinolo e idrossido di ammonio acquoso o alchilammine, con acido borico come catalizzatore.
Utilizzando lo stesso catalizzatore in condizioni anidre, il resorcinolo reagisce con etanolammina o 3-ammino-1-propanolo per produrre 3-(β- e γ-idrossialchilammino)fenoli. Un processo analogo utilizza un catalizzatore di allumina-silice attivato con acido.
3. Le reazioni di sistema multifase producono nitroaniline da nitrofenoli e ammoniaca, preferibilmente utilizzando un solvente in cui il prodotto di reazione ha una buona solubilità. In queste reazioni vengono impiegati numerosi catalizzatori a trasferimento di fase.
4. La p-nitrosoanilina e la p-nitroso-N-fenilammina vengono sintetizzate in ammoniaca liquida utilizzando un sale di ammonio o un’ammina terziaria in un solvente organico.
5. I p-nitrosofenoli subiscono reazioni con alchilammine attraverso p-nitrosofenil eteri, producendo le corrispondenti p-nitrosoaniline N-sostituite. L’acqua prodotta nel processo viene rimossa per portare a termine la reazione.
6. Il processo Halcon è un’importante amminazione in fase vapore del fenolo che prevede la reazione di fenoli o naftoli con ammoniaca in fase gassosa a 250 °C utilizzando ossidi metallici o non metallici, quali MgO, B2O3, Al2O3, SiO2, TiO2 o miscele.

U.S. Steel Chemicals impiega il processo Halcon dal 1982 presso il suo stabilimento di Haverhill, Ohio, producendo anilina dal fenolo (capacità di anilina: 100.000 t/a).
7. La reazione di Bucherer è la reazione di 1- o 2-naftoli con soluzioni acquose di ammina o ammonio utilizzando acido solfidrico come catalizzatore. Questa reazione è utilizzata principalmente per la serie naftalene. L’uso di acido solfidrico riduce la temperatura di reazione di 50-150 °C e produce elevata purezza e resa (85-95%).
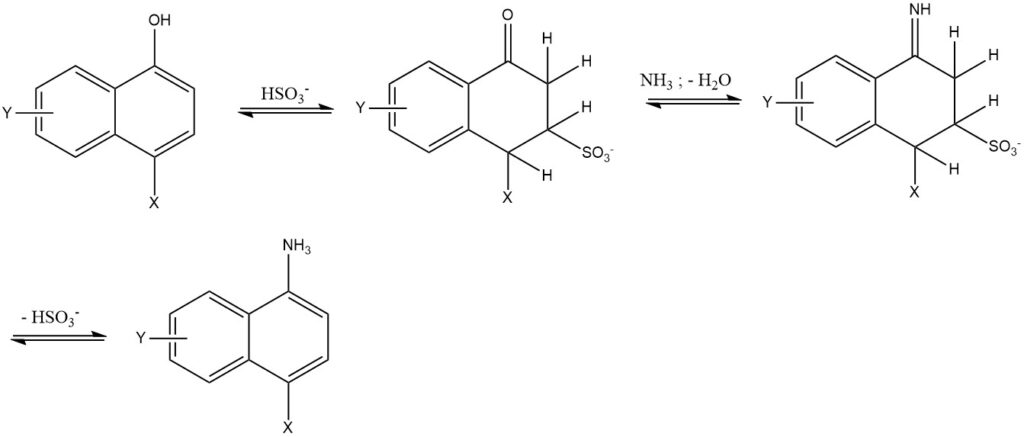
2.3. Scambio di gruppi solfo
L’ammoniaca ha la capacità di sostituire i gruppi solfo nei derivati di benzene, naftalene e antrachinone. Tuttavia, questo processo di scambio ha una significativa importanza industriale solo all’interno della serie degli antrachinoni.
In passato, la produzione di 1-amminoantrachinoni comportava la reazione di 1-solfoantrachinoni con ammine. Per contrastare il rilascio di idrogeno solforato, sono state introdotte quantità stechiometriche di un agente ossidante, come il sodio 3-nitrobenzensolfonato.
Un approccio più recente per la sintesi di 1-amminoantrachinone comporta la riduzione del corrispondente nitroantrachinone. Questa metodologia elimina la necessità della solfonazione catalizzata dal mercurio che porta a 1-solfoantrachinone.
Con un processo condotto in un mezzo acquoso sotto pressione a temperature comprese tra 100 e 200 °C, l’acido 1-cicloesilamminoantrachinone-5-solfonico viene generato dall’acido antrachinone-1,5-disolfonico e dalla cicloesilammina. L’ossidazione dell’idrogeno solforato viene ottenuta utilizzando sostanze come il perclorato di sodio o l’acido 3-nitrobenzensolfonico.
3. Altri processi
In questa discussione saranno evidenziati vari metodi descritti in letteratura per la sintesi di ammine aromatiche. È importante notare che qui verrà trattata solo una selezione di questi metodi.
La produzione su larga scala di 4,4′-metilenedianilina comporta la condensazione dell’anilina con formaldeide in soluzioni acquose o acquose-metanoliche.
La difenilammina viene sintetizzata tramite condensazione in fase vapore di anilina su catalizzatore di allumina o titanio a temperature comprese tra 450 e 500 °C. In alternativa, può essere prodotta in fase liquida a temperature comprese tra 175 e 450 °C.
Le arilidrossilammine possono essere riarrangiate in acido solforico diluito per formare o- e p-amminofenoli.
Un importante intermedio di pigmento, la 3,3′-diclorobenzidina, è prodotto da Bofors (situata a Muskegan, MI). Il processo prevede il riarrangiamento della benzidina avviato dall’o-cloronitrobenzene.
Riferimenti
- Amines, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a02_037
- Process for the production of aromatic amines. – https://patents.google.com/patent/US5877350A/en
