Processi di produzione del biossido di titanio: una panoramica completa
Il biossido di titanio commerciale viene prodotto attraverso due distinti metodi industriali: il processo al solfato e il processo al cloruro.
Il processo al solfato, una tecnica più datata, inizia con la digestione di materie prime contenenti titanio, come ilmenite o scorie di titanio (→ articolo dettagliato sulle materie prime), in acido solforico concentrato. Questa reazione avviene a 150-220 °C, producendo un liquido nero contenente titanio, ferro e varie impurità disciolte.
La successiva idrolisi della soluzione di solfato di titanile precipita un ossido di titanio idrato relativamente puro (TiO(OH)2 o TiO2 diidrato) e ulteriori fasi di purificazione eliminano le impurità rimanenti. L’ossidrato di titanio viene quindi sottoposto a calcinazione, macinazione e, solitamente, rivestimento con composti inorganici.
Il processo al cloruro prevede la clorurazione di materie prime contenenti titanio, tra cui ilmenite, leucoxene, rutilo, scorie di titanio o anatasio, a temperature comprese tra 700 e 1200 °C. Il tetracloruro di titanio (TiCl4) risultante viene quindi ossidato a 900-1400 °C per formare biossido di titanio, che viene successivamente macinato e rivestito con composti inorganici.
Questi due processi sono impiegati esclusivamente per la produzione di pigmenti di biossido di titanio. Esistono altri metodi di produzione per il TiO2 senza proprietà pigmentarie, principalmente per la sintesi di nanoparticelle di biossido di titanio. Alcuni esempi includono l’idrolisi di alcolati di titanio o la reazione pirolitica di TiCl4 con acqua (processo aerosil).
Sommario
1. Produzione di biossido di titanio mediante processo al solfato
La produzione di biossido di titanio mediante processo al solfato prevede diverse fasi sequenziali, come illustrato nella Figura 1.
1.1. Macinazione
Le materie prime contenenti titanio vengono essiccate fino a un contenuto di umidità inferiore allo 0,1% per prevenire reazioni premature e il riscaldamento in caso di miscelazione con acido solforico. I materiali vengono quindi macinati in mulini a sfere o a tamburo per ottenere una granulometria media inferiore a 40 μm.
1.2. Digestione
La digestione a lotti è la procedura standard in cui le materie prime macinate (ilmenite, scorie di titanio o miscele) vengono miscelate con H2SO4 all’80-98%.
La reazione può essere avviata aggiungendo oleum ad acido solforico all’80% oppure aggiungendo acqua e/o vapore alla sospensione di materie prime in acido solforico concentrato. In entrambi i casi, l’entalpia di miscelazione innesca una digestione chimica esotermica che raggiunge una temperatura massima di circa 200 °C o superiore.
Il rapporto tra H2SO4 e materia prima viene regolato per ottenere un rapporto tra acido solforico e biossido di titanio nel liquido nero risultante (numero di acidità) compreso tra 1,8 e 2,2 in peso.
La reazione nel recipiente di digestione (f) inizia con l’aggiunta di acqua, acido solforico diluito, oleum o vapore. Un aumento iniziale della temperatura a 50-70 °C è causato dal calore di idratazione dell’acido. La successiva formazione esotermica di solfato porta la temperatura a 170-220 °C.
L’acqua aggiunta e generata dalla reazione evapora completamente formando un residuo di digestione solido. Potrebbe essere necessario un riscaldamento esterno per l’acido diluito o per materie prime scarsamente solubili.
Dopo aver raggiunto la temperatura massima, la miscela di reazione solida richiede da 1 a 12 ore di maturazione, la cui durata dipende dalla materia prima. La maturazione massimizza la solubilità dei componenti contenenti titanio. L’agitazione dell’aria durante l’aumento di temperatura influenza positivamente la resa della digestione.
Esistono processi di digestione continua. Un metodo consolidato prevede l’alimentazione continua di una miscela di ilmenite e acqua con acido solforico in un trasportatore a coclea a doppia pale. Dopo un breve tempo di residenza (meno di 1 ora), si forma una massa friabile. Questo processo è adatto a materie prime altamente reattive.
1.3. Ridigestione
A causa degli elevati costi delle materie prime titaniferi, sono stati fatti tentativi di riutilizzare i residui di digestione solida (contenenti il 40-65% di biossido di titanio). Storicamente, questi sviluppi non hanno trovato implementazione su larga scala a causa della complessità e del costo delle attrezzature o delle condizioni di processo.
Nel 2001 è stato proposto un processo di ridigestione che utilizza attrezzature e tecnologie standard.
1.4. Dissoluzione e riduzione
Il residuo di digestione viene sciolta in acqua fredda o acido diluito riciclato a una temperatura inferiore a 85 °C per prevenire un’idrolisi prematura, in particolare con i prodotti a base di ilmenite. Durante la dissoluzione viene introdotta aria per l’agitazione. Con l’ilmenite, la concentrazione della soluzione di biossido di titanio è dell’8-12% in peso, mentre con le scorie varia dal 13 al 18%.
Il ferro trivalente (Fe3+) viene idrolizzato insieme ai composti di titanio e aderisce all’idrato di ossido di titanio. Pertanto, tutto il Fe3+ deve essere ridotto a Fe2+ utilizzando rottami di ferro durante la dissoluzione del prodotto a base di ilmenite o in una fase successiva.
Per prevenire la riossidazione del ferro durante la lavorazione successiva, una piccola quantità di Ti3+ viene mantenuta fino al completamento dell’idrolisi. Il Ti3+ si forma utilizzando rottami di ferro in eccesso durante la riduzione del Fe3+. Anche il Ti4+ può essere parzialmente ridotto a Ti3+ in condizioni ottimizzate. Questa soluzione concentrata di Ti3+ viene quindi aggiunta alla soluzione di reazione principale.
Le soluzioni ottenute dalle scorie di titanio contengono già quantità maggiori di Ti3+, che deve essere ridotto mediante ossidazione con ossigeno atmosferico per evitare perdite di resa durante l’idrolisi. Il Ti3+ presente nella digestione delle scorie riduce parzialmente l’acido solforico a SO2 o H2S, che richiedono un’accurata depurazione dei gas di scarico, soprattutto se le scorie contengono metalli pesanti.
È possibile la digestione mista di scorie di ilmenite e titanio, in cui il Ti3+ presente nelle scorie riduce tutto il Fe3+ a Fe2+. Questo può essere ottenuto anche miscelando i prodotti disciolti provenienti da digestioni separate di scorie di ilmenite e titanio.
1.5. Chiarificazione
Tutti i solidi non disciolti devono essere accuratamente rimossi dalla soluzione per evitare la contaminazione da idrolizzato. Il metodo più economico prevede la sedimentazione preliminare in un addensatore (g) seguita dalla filtrazione del sedimento utilizzando un filtro rotativo a tamburo sotto vuoto (h) o una filtropressa.
Il surnatante dell’addensante viene anche fatto passare attraverso filtropresse (i) per rimuovere le particelle fini residue. A causa delle scarse proprietà filtranti, il filtro rotativo funziona tipicamente come filtro a prestrato. L’aggiunta di sostanze chimiche può favorire la flocculazione e la sedimentazione delle particelle fini nell’addensante.
È stata proposta anche la chiarificazione a singolo stadio mediante filtropresse automatizzate.
1.6. Cristallizzazione
Dopo la riduzione di Fe3+, le soluzioni provenienti dalla digestione delle scorie contengono il 5-6% in peso di FeSO4 e quelle provenienti dalla digestione dell’ilmenite contengono il 16-20% in peso di FeSO4. Le soluzioni di ilmenite vengono raffreddate sotto vuoto per cristallizzare e separare FeSO4·7 H2O (rame) (j) per ridurre FeSO4 scaricato con l’acido di scarto dopo l’idrolisi. Questo aumenta la concentrazione di biossido di titanio nella soluzione di circa il 25%.
Il sale di rame viene separato per filtrazione o centrifugazione (k).
Il solfato di ferro viene utilizzato principalmente nella depurazione delle acque, come agente riducente del cromato per il cemento e come materia prima per i pigmenti di ossido di ferro. Può anche essere disidratato per formare FeSO4·H2O o decomposto termicamente in ossido di ferro(III) e anidride solforosa.
1.7. Idrolisi
L’idrato di ossido di titanio viene precipitato per idrolisi a 94-110 °C. Altri componenti della materia prima solubili in acido solforico, principalmente il niobio come idrato di ossido, precipitano simultaneamente. L’idrolisi viene condotta in vasche agitate rivestite in mattoni (n) con iniezione di vapore. L’idrolizzato risultante è privo di proprietà pigmentarie.
Le proprietà dell’idrolizzato sono significativamente influenzate dal grado di flocculazione delle particelle primarie. La dimensione delle particelle primarie dell’idrolizzato è di circa 5 nm, mentre la dimensione delle particelle del pigmento TiO2 è di 200-300 nm. Diversi fattori influenzano le proprietà dell’idrolizzato:
1. L’idrolisi delle soluzioni concentrate di solfato di titanio (170-230 g TiO2/L) è lenta e incompleta in assenza di nuclei adatti, che ne accelerano l’idrolisi. I nuclei vengono prodotti principalmente con il metodo Mecklenburg o Blumenfeld.
Nel metodo Mecklenburg, l’idrato colloidale di ossido di titanio viene precipitato con idrossido di sodio a 100 °C. L’1% di questo idrato viene utilizzato come materiale di partenza.
Nel metodo Blumenfeld, una piccola porzione della soluzione di solfato viene idrolizzata in acqua bollente, quindi aggiunta alla soluzione in massa. Il numero di nuclei influenza la granulometria dell’idrolizzato e le caratteristiche di flocculazione.
2. La granulometria dell’idrolizzato e il grado di flocculazione dipendono anche dall’intensità di agitazione durante la formazione dei nuclei Blumenfeld e la fase iniziale di idrolisi.
3. La concentrazione di solfato di titanio influenza notevolmente la flocculazione dell’idrolizzato e viene regolata mediante evaporazione sotto vuoto, se necessario, a 170-230 g/L di biossido di titanio durante l’idrolisi. Concentrazioni inferiori producono flocculati più grossolani.
4. Il numero di acidità dovrebbe essere compreso tra 1,8 e 2,2. Influisce significativamente sulla resa di TiO2, sulla granulometria dell’idrolizzato e sulla dimensione dei flocculati. Numeri di acidità elevati comportano una resa inferiore e un idrolizzato più grossolano. Un normale periodo di idrolisi (3-6 ore) produce il 93-96% di biossido di titanio.
Altre concentrazioni saline, in particolare FeSO4, influenzano le proprietà dell’idrolizzato. Concentrazioni elevate in genere danno origine a flocculati più fini.
5. La temperatura influenza principalmente la resa volume-tempo e la purezza dell’idrolizzato.
La struttura dell’idrolizzato è complessa. Le particelle primarie nanocristalline di anatasio presentano una dimensione di circa 5-6 nm (micrografie elettroniche, dati di superficie BET). Le determinazioni convenzionali delle dimensioni delle particelle (ad esempio, scattering laser) mostrano valori da centinaia a migliaia di nanometri, a seconda dell’intensità di dispersione.
Le particelle primarie si aggregano in particelle secondarie di circa 30 nm (Figura 3). Queste particelle secondarie formano strutture terziarie di circa 1 μm. Le strutture terziarie formano poi strutture quaternarie di pochi micrometri.
La macinazione o la dispersione ultrasonica ad alta intensità possono scomporre le strutture quaternarie. Un’energia di dispersione sufficiente può scomporre parzialmente le strutture terziarie.
Durante la calcinazione, si verificano trasformazioni morfologiche:
- A 300-600 °C, le particelle primarie sinterizzano. Le particelle secondarie originali formano nuove particelle primarie di anatasio cristallino, di circa 20 nm di dimensione. Questa è una dimensione tipica per il biossido di titanio catalitico.
- A 800-1000 °C, le particelle di 20 nm sinterizzano. Le particelle terziarie originali formano nuove particelle primarie di rutilo cristallino o anatasio, di circa 200 nm di dimensione. Questa è una dimensione tipica per il biossido di titanio pigmentato. Le strutture quaternarie originali formano agglomerati di particelle di pigmento, che vengono separati mediante una fase di macinazione.
1.8. Purificazione dell’idrolizzato
Dopo l’idrolisi, la fase liquida contiene il 20-28% di acido solforico e quantità variabili di solfati disciolti a seconda della materia prima. L’idrato di ossido di titanio viene separato dalla soluzione mediante filtrazione e quindi lavato con acqua o acido diluito. Anche con il lavaggio acido, troppi ioni di metalli pesanti rimangono adsorbiti sull’idrato di ossido di titanio per la produzione di pigmento bianco.
La maggior parte delle impurità può essere rimossa mediante riduzione (sbiancamento). Il panello di filtrazione viene diluito con acido diluito al 3-10% a 50-90 °C e quindi miscelato con polvere di zinco o alluminio (q). Anche agenti riducenti non metallici (ad esempio, HOCH2–SO2Na) possono essere utilizzati per lo sbiancamento.
Dopo una seconda filtrazione e lavaggio, l’idrato di ossido di titanio presenta basse concentrazioni di impurità colorate. Tuttavia, contiene ancora il 5-10% di acido solforico chemisorbito, che non può essere completamente rimosso mediante lavaggio. Viene eliminato mediante riscaldamento ad alta temperatura.
1.9. Drogaggio dell’idrato
Per produrre biossido di titanio ad elevata purezza, l’idrato di ossido di titanio viene calcinato senza aggiunte per ottenere un grado di TiO2 relativamente grossolano, con un contenuto di rutilo dipendente dalla temperatura di riscaldamento. Per produrre gradi specifici di pigmento, l’idrato di ossido di titanio deve essere trattato con composti di metalli alcalini e acido fosforico prima della calcinazione (r).
I pigmenti di anatasio contengono più acido fosforico rispetto ai pigmenti di rutilo. Per i pigmenti di rutilo, vengono aggiunti nuclei di rutilo (meno del 10%, in genere 1-5%). ZnO, Al2O3 e/o Sb2O3 (meno del 3%) vengono aggiunti per stabilizzare la struttura cristallina.
I nuclei (o semi di rutilo) vengono prodotti convertendo l’idrato di ossido di titanio purificato in titanato di sodio, che viene lavato per eliminare il solfato e quindi trattato con acido cloridrico. I nuclei di rutilo possono anche essere preparati per precipitazione da soluzioni di tetracloruro di titanio con una soluzione di idrossido di sodio.
1.10. Calcinazione
L’idrato di ossido di titanio drogato viene filtrato utilizzando filtri rotativi a vuoto o filtropresse per rimuovere l’acqua. I filtri rotativi a vuoto raggiungono un contenuto di solidi di TiO2 di circa il 30-40%. I filtri rotativi a pressione o le filtropresse automatiche raggiungono un contenuto di TiO2 di circa il 50% o superiore.
La calcinazione avviene in forni rotativi (t), riscaldati direttamente con gas o olio in controcorrente. Circa due terzi del tempo di residenza totale (4-20 ore) sono dedicati all’essiccazione del materiale. Oltre i 500 °C circa, l’anidride solforosa viene espulsa e parzialmente decomposta in anidride solforosa e ossigeno a temperature più elevate.
Il prodotto raggiunge una temperatura massima di 800-1100 °C a seconda del tipo di pigmento, della portata e del profilo di temperatura del forno. Il contenuto di rutilo, la granulometria, la distribuzione dimensionale e la formazione di aggregati sono altamente sensibili ai regimi operativi del forno.
Dopo l’uscita dal forno, il clinker può essere raffreddato indirettamente o direttamente ad aria in raffreddatori a tamburo (u). La temperatura dei gas di scarico in uscita dal forno deve superare i 300 °C per evitare la condensazione dell’acido solforico nelle tubazioni.
È possibile risparmiare energia ricircolando una parte del gas nella camera di combustione del forno. Questo gas può essere miscelato con i gas combustibili per una parziale sostituzione dell’aria oppure può essere utilizzato per concentrare l’acido diluito. Il gas viene quindi convogliato al sistema di depurazione dei gas di scarico.
1.11. Macinazione
Gli agglomerati e gli aggregati presenti nel clinker vengono ridotti alla finezza del pigmento mediante macinazione a umido o a secco. La macinazione grossolana deve essere effettuata in mulini a martelli (mulini Raymond) o a cilindri prima della macinazione a umido in mulini a sfere o a sabbia (con l’aggiunta di un agente disperdente).
La frazione grossolana può essere rimossa dalla sospensione mediante centrifugazione o idrocicloni e riciclata ai mulini. Mulini a martelli, mulini a crociere, mulini a cilindri e, in particolare, mulini pendolari e a getto di vapore sono adatti alla macinazione a secco.
Speciali additivi di macinazione possono essere utilizzati come agenti bagnanti durante il successivo trattamento dei pigmenti o per migliorare la disperdibilità dei pigmenti non trattati.
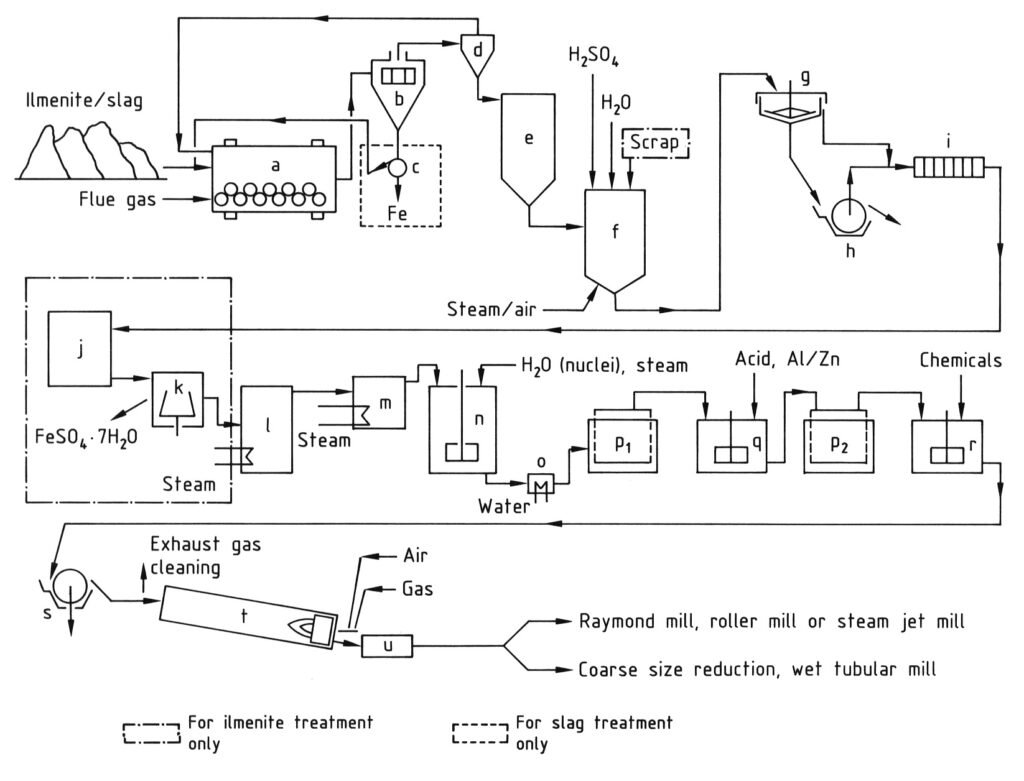
a) Mulino a sfere/essiccatore; b) Vaglio; c) Separatore magnetico; d) Ciclone; e) Silo; f) Recipiente di digestione; g) Addensatore; h) Filtro rotativo; i) Filtropressa; j) Cristallizzatore; k) Centrifuga; l) Evaporatore sotto vuoto; m) Preriscaldatore; n) Vasca agitata per idrolisi; o) Refrigeratore; p) Filtri Moore; q) Vasca agitata per sbiancamento; r) Vasca agitata per drogaggio; s) Filtro rotativo per disidratazione; t) Forno rotativo; u) Refrigeratore
2. Produzione di biossido di titanio mediante il processo al cloruro
La produzione del pigmento di biossido di titanio mediante il processo al cloruro è illustrata nella Figura 2.
2.1. Clorazione
Il titanio presente nelle materie prime viene convertito in tetracloruro di titanio in atmosfera riducente. Come agente riducente viene utilizzato coke di petrolio calcinato con un contenuto di ceneri estremamente basso. Grazie al suo basso contenuto di sostanze volatili, la formazione di HCl è minima. Il biossido di titanio reagisce esotermicamente secondo la seguente equazione:
TiO2 + 2Cl2 + C → TiCl4 + CO2
All’aumentare della temperatura, si verifica una reazione endotermica tra anidride carbonica e carbonio per formare monossido di carbonio. L’ossigeno deve essere co-alimentato con cloro per mantenere la temperatura di reazione tra 800 e 1200 °C. Il consumo di coke è di 250-300 kg per tonnellata di biossido di titanio. Se si utilizza cloro contenente CO2 proveniente dalla combustione di TiCl4, il consumo di coke aumenta a 350–450 kg.
La vecchia clorazione a letto fisso è obsoleta. In questo processo, il titanio grezzo macinato viene miscelato con coke di petrolio e un legante. Si formano delle bricchette. La clorazione viene eseguita a 700-900 °C in reattori rivestiti in mattoni.
La clorazione a letto fluido è iniziata nel 1950. Il titanio grezzo (granulometria simile alla sabbia) e il coke di petrolio (granulometria media circa cinque volte superiore a quella del biossido di titanio) reagiscono con cloro e ossigeno. Questo avviene in un reattore a letto fluido rivestito in mattoni a 800-1200 °C.
Le materie prime devono essere molto secche per impedire la formazione di HCl. La conversione del cloro è del 98-100%. La conversione del titanio nella materia prima è del 95-100%. L’efficienza di questo processo dipende dalla progettazione del reattore e dalla velocità del gas. Le perdite sono dovute principalmente al trascinamento di polvere.
Il cloruro di magnesio e il cloruro di calcio possono accumularsi nel reattore a letto fluido a causa della bassa volatilità. Anche il biossido di silicio e il silicato di zirconio si accumulano perché clorurano molto lentamente alle temperature di processo. Tutti gli altri costituenti della materia prima volatilizzano come cloruri nei gas di reazione.
Il rivestimento ceramico del reattore a letto fluido è soggetto ad abrasione e corrosione. Se la clorurazione viene interrotta, sussiste il rischio che le materie prime possano sinterizzare, impedendo la successiva fluidizzazione.
2.2. Raffreddamento a gas
I gas di reazione vengono raffreddati con TiCl4 liquido e il raffreddamento può essere indiretto o diretto (d).
I cloruri degli altri componenti cristallizzano e tendono ad accumularsi sulle superfici di raffreddamento, in particolare grandi quantità di cloruri di ferro(II) e ferro(III) formati dalla clorurazione dell’ilmenite. In questa fase iniziale, i gas di reazione vengono raffreddati a temperature inferiori a 300 °C per separare i cloruri presenti dal TiCl4 mediante condensazione o sublimazione (e).
Il gas contiene principalmente TiCl4. Viene raffreddato a temperature inferiori a 0 °C per condensare la maggior parte del TiCl4 (f). Le piccole quantità di TiCl4 e cloro rimanenti nei gas di scarico (CO2, CO e N2) vengono rimosse mediante lavaggio alcalino (t).
2.3. Purificazione di TiCl4
I cloruri solidi e le polveri intrappolate vengono separati da TiCl4 per semplice evaporazione (distillazione) (j). Il cloro disciolto viene rimosso per riscaldamento o riduzione con polveri metalliche (Fe, Cu o Sn).
La rimozione del tetracloruro di vanadio e dell’ossicloruro di vanadio da TiCl4 per distillazione è più complessa perché i loro punti di ebollizione sono molto vicini. Pertanto, vengono ridotti a formare cloruri di vanadio solidi a bassa valenza (i).
Sono stati raccomandati numerosi agenti riducenti. Tra gli esempi rientrano rame, tricloruro di titanio, idrogeno solforato, idrocarburi, saponi, acidi grassi e ammine. Dopo la successiva evaporazione (j), il cloruro di titanio dovrebbe contenere meno di 5 ppm di vanadio.
Il fosgene e il SiCl4 possono essere rimossi mediante distillazione frazionata.
2.4. Ossidazione di TiCl4 e recupero di TiO2
Il pigmento di biossido di titanio e il cloro si formano dalla reazione del tetracloruro di titanio con l’ossigeno a 900-1400 °C. Il TiCl4 purificato viene vaporizzato (k) e il vapore viene riscaldato indirettamente a circa 500–1000 °C (l).
TiCl4 + O2 → 2Cl2 + TiO2
Questa reazione è moderatamente esotermica e richiede un’elevata temperatura di reazione. Pertanto, l’ossigeno deve essere riscaldato a oltre 1000 °C (m) utilizzando una fiamma al plasma elettrico, facendo reagire parte dell’ossigeno con monossido di carbonio o un altro combustibile.
TiCl4 caldo e ossigeno caldo (110-150% della quantità stechiometrica) vengono alimentati separatamente in una camera di reazione. Devono essere miscelati rapidamente e completamente per garantire un’elevata velocità di reazione. Sono stati proposti e utilizzati numerosi tipi di reattori.
Considerazioni simili valgono per l’unità di raffreddamento (o). Il pigmento deve essere raffreddato rapidamente a temperature inferiori a 600 °C utilizzando zone di raffreddamento di varie geometrie. L’adesione del materiale alle pareti viene solitamente impedita aggiungendo particelle abrasive come sabbia, particelle grossolane di TiO2, cloruro di sodio o altri materiali.
Nella produzione di biossido di titanio mediante il processo al cloruro, la progettazione del reattore di ossidazione e la scelta dei materiali, insieme ai parametri di processo, sono di fondamentale importanza. Numerosi brevetti dimostrano ampi sforzi di ottimizzazione per questa fase del processo. Solo poche aziende possiedono le conoscenze su scala industriale per questo processo.
La miscela di reazione, composta da gas (Cl2, O2, CO2) e pigmento di biossido di titanio, può essere ulteriormente raffreddata durante la separazione delle particelle solide dal pigmento, indirettamente o direttamente (p). Il TiO2 viene separato dal flusso gassoso mediante separazione per gravità, cicloni, filtri o combinazioni di dispositivi.
Il flusso gassoso viene riciclato nella zona di raffreddamento del reattore di ossidazione (o) e nel processo di clorurazione. Viene riciclato come cloro contenente ossigeno tramite l’unità di liquefazione (u) o direttamente come gas. Il cloro adsorbito sul pigmento di biossido di titanio può essere rimosso mediante riscaldamento, lavaggio con azoto o aria o trattamento chimico a umido.
La separazione a umido mediante raffreddamento della miscela gassosa contenente il pigmento (Cl2, O2 e CO2) in acqua non ha trovato applicazione su larga scala.
La qualità del pigmento di biossido di titanio (dimensione e distribuzione dimensionale delle particelle) dipende dalla temperatura di reazione, dagli additivi, dall’eccesso di ossigeno e dalle condizioni reologiche nel reattore. Per ciascun reattore devono essere stabilite condizioni specifiche.
La presenza di acqua e/o composti alcalini durante la combustione di TiCl4 genera nuclei, che promuovono la formazione controllata di particelle di pigmento finemente suddivise con elevato potere di diffusione. Gli additivi possono essere aggiunti direttamente all’ossigeno o prodotti mediante combustione di materiali contenenti idrogeno.
La presenza di cloruro di alluminio favorisce la formazione di rutilo e una divisione più fine del pigmento. Viene aggiunto in quantità comprese tra lo 0,2 e il 2,0% in peso. L’aggiunta di PCl3 e SiCl4 inibisce la formazione di rutilo, che produce il pigmento anatasio. Tuttavia, questo tipo di pigmento non ha trovato particolare rilevanza nel processo del cloruro.
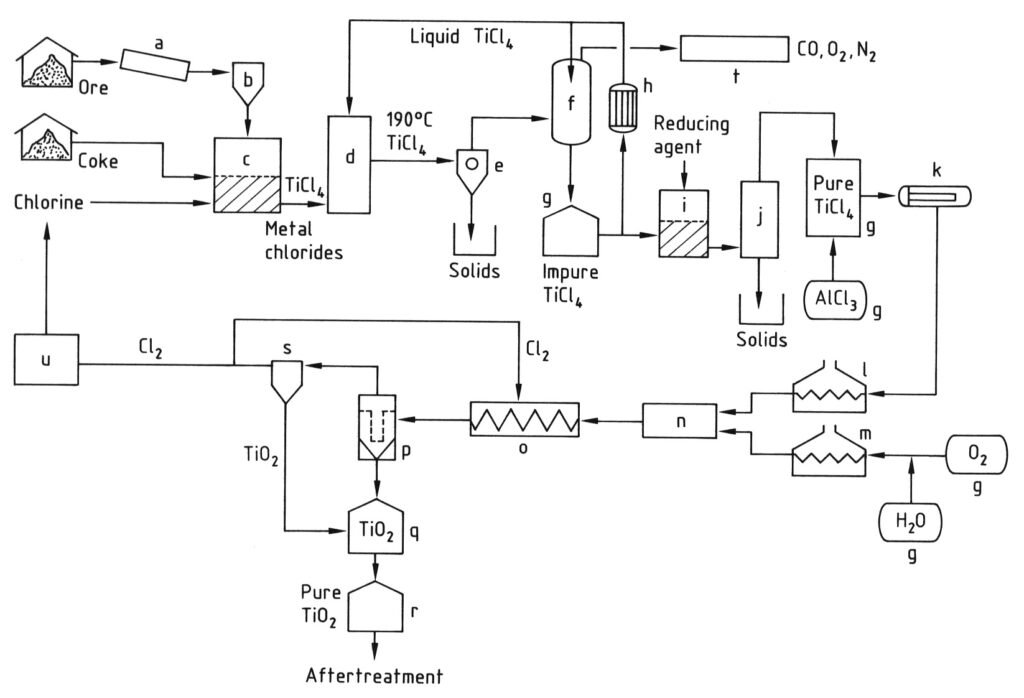
a) Mulino; b) Silo; c) Reattore a letto fluido; d) Torre di raffreddamento; e) Separazione dei cloruri metallici; f) Condensazione di TiCl4; g) Serbatoio; h) Refrigeratore; i) Riduzione del vanadio; j) Distillazione; k) Evaporatore; l) Surriscaldatore di TiCl4; m) Surriscaldatore di O2; n) Bruciatore; o) Serpentina di raffreddamento; p) Filtro; q) Purificazione di TiO2; r) Silo; s) Purificazione del gas; t) Purificazione dei gas di scarico; u) Liquefazione di Cl2
3. Processo al cloruro vs. processo al solfato per la produzione di biossido di titanio
La capacità produttiva globale di biossido di titanio è pressoché suddivisa tra i due processi principali. Attualmente, il processo al solfato rappresenta circa il 47% della capacità, mentre il processo al cloruro circa il 53%.
I dati effettivi di produzione e vendita sono più a favore del processo al cloruro, poiché alcuni impianti al solfato, in particolare in Cina, operano al di sotto della loro piena capacità. La netta tendenza al rialzo per il processo al cloruro, che ha raggiunto il picco intorno al 57% nel 1996, si è recentemente stabilizzata a causa del significativo aumento della nuova capacità produttiva del processo al solfato in Cina.
I pigmenti di TiO2 prodotti con il processo al cloruro presentano generalmente una brillantezza superiore e una tonalità più neutra rispetto al processo al solfato. Spesso presentano un migliore potere di diffusione e una maggiore durata. Tuttavia, per molte applicazioni, questi due tipi di pigmenti sono intercambiabili.
In alcuni utilizzi, come per fibre e inchiostri da stampa, i pigmenti al solfato possono offrire proprietà superiori. Ciò è spesso attribuito alla loro natura meno abrasiva. I pigmenti di biossido di titanio per applicazioni impegnative vengono quasi sempre sottoposti a post-trattamento inorganico.
I pigmenti di anatasio e i biossidi di titanio tecnici, che richiedono la modifica dell’anatasio, compresi quelli per catalizzatori, nanoparticelle cosmetiche, usi fotocatalitici ed elettroceramici, sono prodotti esclusivamente con il processo al solfato.
Il processo al cloruro è spesso considerato a minore impatto ambientale. Questa valutazione si concentra sul volume di rifiuti in loco generati dall’impianto di biossido di titanio, escludendo i rifiuti derivanti dall’upgrading delle materie prime.
Alcuni importanti impianti al solfato hanno raggiunto il completo riciclo con acido debole e la maggior parte o tutti i sottoprodotti contenenti ferro vengono venduti o lavorati. Al contrario, i rifiuti di molti impianti al cloruro vengono ancora smaltiti in discarica o in pozzi profondi.
| Classe di pigmento | TiO2 (min.), % in peso | Sali idrosolubili, % in peso | Sostanze volatili (max.), % in peso |
|---|---|---|---|
| Anatasio A 1 (Tipo A) | 98 | 0,6 | 0,5 |
| Anatasio A 2 | 92 | 0,5 | 0,8 |
| Rutilo R 1 (Tipo R) | 97 | 0,6 | 0,5 |
| Rutilo R 2 | 90 | 0,5 | 1,5 |
| Rutilo R 3 | 80 | * | * |
4. Gestione dei rifiuti nella produzione di biossido di titanio
4.1. Rifiuti acquosi
Il processo di solforazione consuma 2,4-3,5 tonnellate di acido solforico concentrato per tonnellata di biossido di titanio prodotta, a seconda della materia prima. Durante la lavorazione, una parte dell’acido solforico si converte in solfati, principalmente solfato di ferro (II). L’acido solforico rimanente si ottiene come acido solforico libero (acido debole).
La filtrazione frazionata e il lavaggio della sospensione di idrolizzato producono il 70-95% in peso di SO42- in una frazione di acido debole, che contiene circa il 20-25% di acido libero. Il restante 5-30% di solfato è altamente diluito con l’acqua di lavaggio.
Storicamente, lo scarico diretto di acido in acque libere o costiere era una pratica comune. Il problema degli acidi deboli ha generato significative controversie politiche. Di conseguenza, la Comunità Europea ha imposto la cessazione dello scarico di acidi deboli in acque libere entro il 1993.
I produttori europei di biossido di titanio hanno sviluppato diversi processi di trattamento degli effluenti per soddisfare le normative ambientali. I processi chiave includono la precipitazione del gesso da acidi deboli e la concentrazione/recupero dell’acido libero e legato.
Nel processo di produzione del gesso, l’effluente acido viene inizialmente trattato con CaCO3 finemente suddiviso per precipitare il gesso bianco. Il gesso bianco viene filtrato, lavato ed essiccato. Viene quindi utilizzato per la produzione di cartongesso. In una seconda fase, i solfati metallici residui nel filtrato vengono precipitati come idrossidi metallici insieme a ulteriore gesso mediante l’aggiunta di idrossido di calcio. Questa miscela, chiamata gesso rosso, deve essere smaltita in discarica.
È stata anche suggerita la produzione di pigmenti di ossido di ferro da una soluzione di solfato di ferro, ottenuta dopo la neutralizzazione parziale dell’acido debole con CaCO3 o ferro metallico.
Nel processo di riciclo, sia l’acido solforico libero che quello legato (come solfati metallici) possono essere recuperati dall’acido debole mediante concentrazione e cracking termico in un forno a letto fluido (k, Figura 3). Il processo si compone di due fasi:
- Concentrazione e recupero dell’acido libero tramite evaporazione.
- Separazione e decomposizione termica dei solfati metallici e produzione di acido solforico dall’anidride solforosa risultante.
A causa del fabbisogno energetico, solo l’acido contenente oltre il 20% di acido solforico è economicamente recuperabile tramite evaporazione. L’acido debole viene concentrato da circa il 20-25% a circa il 28% con un consumo di calore minimo, utilizzando il calore di scarto derivante dalla produzione di acido solforico del processo di contatto o dai gas di scarico del forno di calcinazione del biossido di titanio.
Dopo l’evaporazione preliminare, si verifica un’ulteriore concentrazione negli evaporatori sotto vuoto. La pressione del vapore acqueo diminuisce notevolmente con l’aumentare della concentrazione di H2SO4. L’evaporazione produce una sospensione di solfati metallici in acido solforico al 60-70% (fase 1 in Figura 3).
La sospensione viene raffreddata a 40-60 °C in una serie di serbatoi agitati (fase 2, d) per ottenere un prodotto con buone proprietà filtranti e un acido adatto al riciclo nel processo di digestione. La filtrazione (fase 3, e) viene solitamente effettuata con filtri a pressione per ottenere un panello di filtrazione con un basso contenuto di liquido residuo.
I requisiti di concentrazione dell’acido riciclo nel processo di digestione dipendono dalla qualità della materia prima contenente titanio. Per le materie prime con un alto contenuto di titanio, l’acido solforico al 65-70% separato dai solfati metallici deve essere ulteriormente concentrato fino a raggiungere l’80-87% di acido (fase 5).
La concentrazione può essere effettuata in evaporatori sotto vuoto riscaldati a vapore. In alternativa, è possibile utilizzare il calore proveniente da forni di calcinazione del biossido di titanio. Raffreddando l’acido dopo questo processo di concentrazione si ottiene una sospensione di solfato metallico in acido solforico. Questo acido può essere utilizzato direttamente per la digestione delle materie prime.
I solfati metallici recuperati e separati dall’acido solforico nella fase 3 (solitamente tramite filtrazione, chiamata quindi “sale di filtrazione”) contengono circa il 15-30% di acido solforico con una concentrazione dal 60 al 70%. Possono essere convertiti in un materiale monouso per reazione con composti del calcio.
La decomposizione termica dei solfati metallici per formare ossidi metallici, anidride solforosa, acqua e ossigeno è ad alto consumo energetico. Tuttavia, è ecologicamente vantaggiosa. Il fabbisogno energetico è di circa 4 × 109 J per tonnellata di panello. La decomposizione termica avviene a 850-1100 °C in un forno a letto fluido (fase 6).
L’energia è fornita da carbone, pirite o zolfo. L’anidride solforosa formata durante la decomposizione termica viene purificata con metodi standard, essiccata e convertita in acido solforico o oleum. Questo acido o oleum puro viene miscelato con l’acido solforico recuperato e utilizzato nel processo di digestione.
Gli ossidi metallici prodotti dalla decomposizione termica contengono tutti gli elementi inizialmente presenti nella materia prima, ad eccezione del titanio convertito in pigmento. Questa miscela di ossidi metallici, principalmente ossido di ferro, può essere utilizzata come additivo nei materiali da costruzione o nell’industria del cemento.
La crescente domanda di processi industriali ecocompatibili ha spinto lo sviluppo di tecniche in grado di riciclare il 5-30% di solfato residuo nelle acque di lavaggio acide. I processi moderni possono recuperare e riutilizzare fino al 99% dell’acido solforico in produzione.
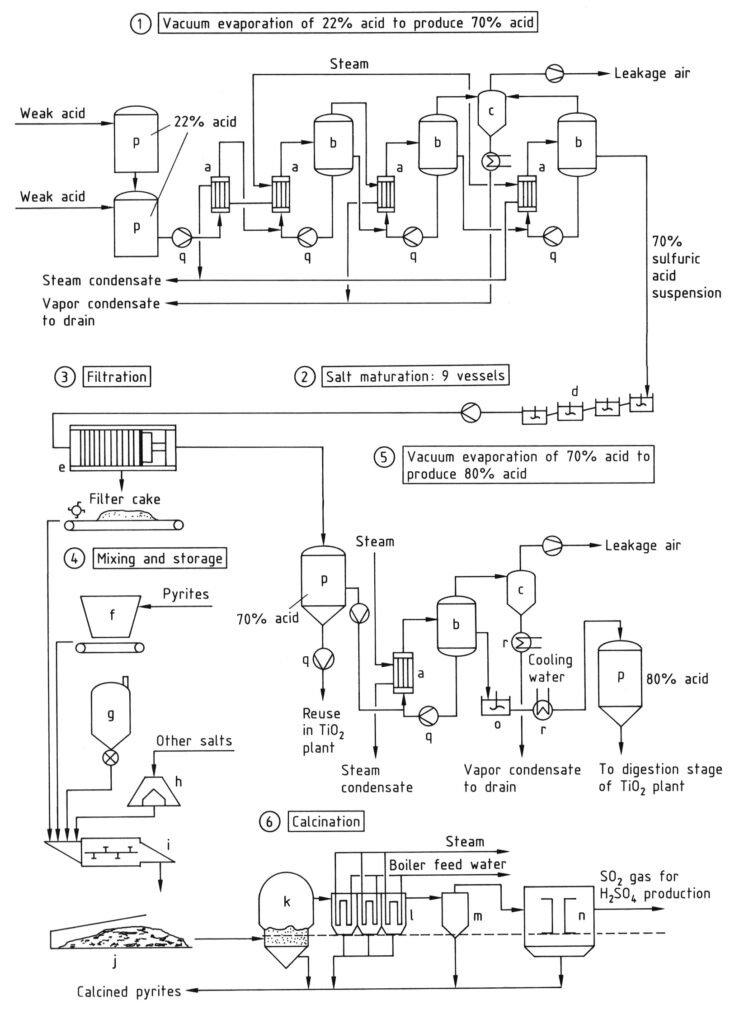
a) Scambiatore di calore; b) Evaporatore; c) Condensatore a iniezione; d) Serbatoi di maturazione del sale agitati; e) Filtropressa; f) Bunker per piriti; g) Silo per carbone; h) Bunker; i) Unità a coclea di miscelazione; j) Deposito coperto per panello di filtrazione misto; k) Forno di calcinazione; l) Caldaia a recupero di calore; m) Ciclone; n) Precipitatore elettrostatico; o) Serbatoio agitato; p) Serbatoio di stoccaggio; q) Pompa; r) Refrigeratore
4.2. Rifiuti solidi
I residui solidi derivanti dalla reazione di digestione vengono spesso smaltiti dopo la neutralizzazione. Negli anni ’90, questo residuo ha iniziato a essere utilizzato come fonte di titanio negli altiforni per stabilizzare il rivestimento interno e prolungarne la durata. Altri potenziali utilizzi includono il riempimento di asfalto (in sostituzione del calcare), la copertura di discariche o il materiale da costruzione. Sono state suggerite anche alcune applicazioni come abrasivo.
Il solfato di ferro eptaidrato (FeSO4·7·H2O, cupreo), ottenuto dalla cristallizzazione e separazione del liquor nero o di un acido debole, viene utilizzato principalmente per la depurazione delle acque, il trattamento delle acque reflue e come materia prima per i pigmenti di ossido di ferro.
Dal 1980 in Scandinavia, FeSO4·7·H2O è stato utilizzato come agente riducente del cromato nel cemento. Il monoidrato di FeSO4·H2O (da essiccazione termica dell’eptaidrato) non ha trovato un impiego significativo a causa delle prestazioni e dei costi sfavorevoli.
I solfati metallici (sale da filtro) recuperati per filtrazione da acido debole dopo concentrazione (costituente principale: solfato di ferro(II) in forma monoidrata pura) sono stati utilizzati per molti anni nella produzione di fertilizzanti, nel cracking termico per la produzione di acido solforico o sono stati smaltiti in discarica.
Il sale da filtro è stato proposto per la prima volta come agente riducente del cromato nel 2003. Successivamente, i principali produttori europei di biossido di titanio hanno studiato e depositato numerosi brevetti su vari aspetti dell’utilizzo dei derivati del sale da filtro come agenti riducenti del cromato.
Il sale da filtro ha mostrato proprietà superiori, tra cui reologia, resistenza al calore e stabilità a lungo termine, e può essere applicato direttamente nei cementifici. Pertanto, quantità crescenti di sale da filtro trattato (ad esempio, neutralizzato con calcare) vengono utilizzate nell’industria del cemento come agente riducente del Cr6+.
Questi sviluppi, insieme alla crescente domanda di agenti riducenti il cromato per il cemento dovuta alle modifiche legislative dell’UE del 2005, hanno trasformato i rifiuti di solfato di ferro da materiale indesiderato a prodotto commerciale.
Nel processo del cloruro, possono sorgere problemi con le acque reflue, soprattutto se la materia prima contiene meno del 90% di biossido di titanio. I sottoprodotti del cloruro metallico vengono talvolta smaltiti in soluzione mediante iniezione in pozzi profondi.
Le soluzioni di cloruro metallico vengono pompate attraverso fori di trivellazione profondi in strati geologici porosi. Sono necessarie formazioni geologiche speciali per prevenire la contaminazione delle falde acquifere da impurità.
Restrizioni crescenti si applicano anche al processo del cloruro. Sono stati compiuti sforzi per utilizzare il sottoprodotto del cloruro di ferro, ad esempio, nel trattamento delle acque e come agente flocculante. È stato proposto un processo in cui i cloruri metallici vengono trattati con cemento e composti alcalini per produrre aggregati rocciosi per la costruzione di strade.
Un altro metodo consiste nel convertire il cloruro di ferro in ossido di ferro tramite il processo Ruthner, con recupero dell’acido cloridrico. Fino a poco tempo fa, molti impianti di lavorazione dei cloruri dovevano neutralizzare i cloruri metallici di scarto, per poi smaltire l’idrossido di ferro risultante.
4.3. Gas di scarico
I gas provenienti dal forno di calcinazione vengono raffreddati in uno scambiatore di calore. Il pigmento di biossido di titanio intrappolato viene rimosso, lavato e riciclato nel processo. SO2 e SO3 che si formano durante la calcinazione possono quindi essere depurati dai gas per formare acido solforico diluito, che viene riciclato.
Riferimenti
- Pigments, Inorganic, 2. White Pigments. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.n20_n01.pub2
- Production of titanium dioxide. – https://ena-norm.eu/wp-content/uploads/2024/04/V.pl_.3.pdf
- A new method for production of titanium dioxide pigment. – https://www.sciencedirect.com/science/article/abs/pii/S0304386X12002423
- A Review of the Production Cycle of Titanium Dioxide Pigment. – https://www.scirp.org/journal/paperinformation?paperid=46456
- Titanium Dioxide. – https://www.ncbi.nlm.nih.gov/books/NBK524874/
- Process for manufacturing titanium dioxide pigments using ultrasonication. – https://patents.google.com/patent/US9353266B2/en
- Process for manufacturing titanium dioxide. – https://patents.google.com/patent/US4288418A/en
- An updated review of industrially relevant titanium dioxide and its environmental health effects. – https://www.sciencedirect.com/science/article/pii/S2666911023000114
