Nitrazione dei composti aromatici
1. La storia delle reazioni di nitrazione aromatica
All’inizio del XIX secolo, furono fatti progressi significativi nella sintesi di composti nitro aromatici. Nel 1834 Mitscherlich ottenne con successo tali composti sottoponendo idrocarburi derivati dal catrame di carbone ad acido nitrico fumante.
Laurent continuò questo lavoro nel 1835, concentrandosi sulla nitrazione del naftalene, l’idrocarburo aromatico puro più facilmente disponibile a quel tempo. Nel 1838, Dale presentò i risultati sui composti nitro misti derivati dal benzene grezzo durante la riunione annuale della British Association for the Advancement of Science.
Tuttavia, solo nel 1845 Hofmann e Muspratt riferirono la loro ricerca sistematica sulla nitrazione del benzene, che portò a mono- e dinitrobenzeni utilizzando una miscela di acido nitrico e solforico.
Sommario
La produzione iniziale di nitrobenzene è stata effettuata su piccola scala e attentamente distillata per ottenere un liquido giallo con un aroma simile alla mandorla amara. Questo prodotto, noto come “essenza di mirbane”, è stato venduto ai produttori di saponi e profumi.
Il processo di riduzione del ferro di Bechamp, che aumentò la disponibilità di anilina, fu pubblicato nel 1854. Successivamente, la scoperta di Perkin dell’anilina malva nel 1856 segnò l’inizio dell’industria europea dei coloranti all’anilina, fungendo da fondamento per l’industria mondiale dei coloranti sintetici, con vendite stimate di $ 6 x 109 nel 1988.
Lo sviluppo e l’aumento di scala dei processi di nitrazione e riduzione, avviati da Perkin e continuati da molti altri, ridussero significativamente il prezzo commerciale dell’anilina da 50 Fr/kg nel 1858 a 10 Fr/kg nel 1863.
Nel 1871, la produzione europea di anilina aveva raggiunto le 3500 t/a. Nel 1985, la produzione europea di anilina è salita a 500.000 t/a, con il suo utilizzo nei coloranti che rappresentava solo il 4% della produzione complessiva di anilina.
La maggior parte della crescita è stata attribuita ai prodotti chimici della gomma e agli isocianati, che consumavano oltre il 50% della produzione di nitrobenzene per la produzione di metilene difenildiisocianato.
I composti nitroaromatici naturali sono limitati in numero, con il cloramfenicolo come primo riconosciuto nel 1949, estratto da colture di Streptomyces venezuelae, una muffa del suolo.
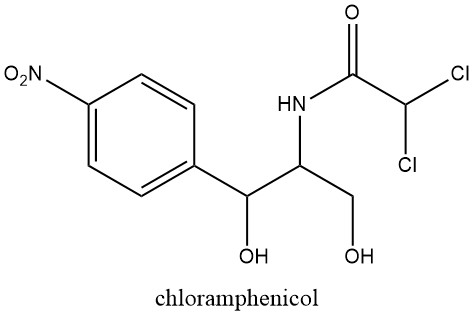
Questa scoperta ha spinto ulteriori indagini sull’attività farmacologica del gruppo nitro, in seguito alla precedente scoperta delle proprietà antibatteriche dei derivati nitrofuranici nel 1943.
Molti prodotti farmaceutici e agrochimici sintetici contengono anche gruppi nitroaromatici, sebbene il ruolo preciso del gruppo nitro in questi composti spesso rimanga poco chiaro.
Il metodo principale per introdurre gruppi nitro nei sistemi aromatici è la nitrazione.
Sebbene siano disponibili alcuni metodi indiretti, come l’ossidazione di composti nitroso o amminici, la sostituzione di gruppi diazonici (reazione di Sandmeyer), il riarrangiamento di nitrammine e reazioni di spostamento nucleofilo, hanno un significato industriale limitato.
Processi unitari, come solfonazione, alogenazione o amminazione, sono comunemente applicati a materiali di partenza nitro primari, derivati principalmente da nitrobenzene, nitrotolueni e nitroclorobenzeni, per produrre vari importanti composti nitro.
Lo spostamento nucleofilo dei gruppi nitro attivati ha un certo potenziale sintetico e la sua nucleofugicità può essere paragonabile a quella dei sostituenti fluorurati. Alcuni composti nitro facilmente reperibili, come l’1,3-dinitrobenzene, reagiscono con reagenti specifici per formare derivati utili.
I composti nitro o i loro derivati servono come intermedi per coloranti, prodotti agrochimici, prodotti farmaceutici, prodotti chimici fini, materiali sintetici ed esplosivi, con pochi sbocchi principali per la produzione su larga scala.
2. Reazione di nitrazione
Il processo di nitrazione può essere descritto come l’introduzione irreversibile di uno o più gruppi nitro (NO2) in un nucleo aromatico, in sostituzione di un atomo di idrogeno.
La nitrazione è una reazione di sostituzione elettrofila, rappresentata dall’equazione:
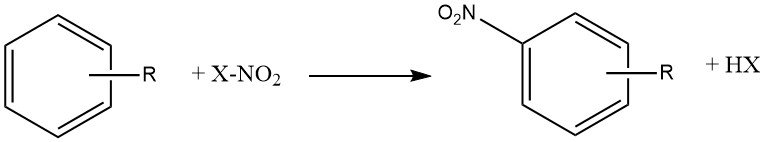
L’introduzione del gruppo nitro disattiva l’anello verso un’ulteriore sostituzione elettrofila, rendendo la dinitrazione un evento raro nelle condizioni utilizzate per la mononitrazione.
Di solito sono richieste condizioni più vigorose per la dinitrazione, che richiedono eccesso, acido più forte e temperatura più elevata. Queste condizioni sono spesso applicate a composti mononitro isolati, piuttosto che eseguire reazioni graduali in situ.
La reazione di nitrazione è altamente esotermica, come dimostrato dalla mononitrazione di benzene (ΔH = -117 kJ/mol) e naftalene (ΔH = -209 kJ/mol). Di conseguenza, è uno dei processi unitari più potenzialmente pericolosi gestiti a livello industriale.
Il calore generato durante la nitrazione può causare la degradazione esotermicamente dell’acido nitrico in prodotti gassosi con violenza esplosiva.
I composti nitroarilici, in particolare quelli con più gruppi nitro, rappresentano potenziali pericoli a causa del loro elevato contenuto di ossigeno.
Alcuni composti polinitro, come il trinitrotoluene e l’acido picrico, sono detonabili e hanno una lunga storia di utilizzo come esplosivi. Inoltre, i composti nitroaromatici possono subire violente reazioni di decomposizione se riscaldati con alcali.
Il processo di nitrazione può essere condotto utilizzando una base discontinua o continua. Le reazioni discontinue sono adatte per requisiti di tonnellaggio inferiori e vengono eseguite in nitratori progettati per gestire vari prodotti.
Per motivi di sicurezza, questi reattori sono in genere limitati a una capacità di circa 6000 L e dotati di agitatori e sistemi di raffreddamento efficienti.
D’altro canto, la reazione continua, adatta per intermedi di grande tonnellaggio come nitrobenzene e nitrotolueni, offre vantaggi in termini di sicurezza ed efficienza dei costi.
La produzione di nitroaromatici si basa principalmente su processi ad alta resa, con oltre l’80% del costo totale attribuito alle materie prime. Pertanto, i risparmi operativi sono limitati.
Tuttavia, sono stati apportati miglioramenti in aree quali il riciclaggio dell’acido solforico, un requisito fondamentale nei processi di nitrazione efficienti, e il controllo e la separazione degli isomeri, contribuendo a migliorare l’efficienza del processo.
3. Agenti nitranti
Per ragioni pratiche ed economiche, la nitrazione su scala industriale viene comunemente eseguita utilizzando un acido misto, che è una combinazione di acido nitrico e solforico. Occasionalmente, vengono utilizzate altre combinazioni, come acido nitrico acquoso, acido nitrico in acido acetico o acido nitrico in anidride acetica.
In alcuni importanti studi di supporto, possono essere utilizzati acidi componenti alternativi come acido perclorico, acido fluoridrico o trifluoruro di boro, ma la loro applicazione è limitata. Queste reazioni alternative possono avvenire in solventi organici inerti come cloroidrocarburi o solfolano per creare miscele di reazione omogenee.
La forza dell’agente nitrante (X-NO2) diminuisce con la diminuzione dell’elettronegatività di X. La specie più attiva in questi sistemi è lo ione nitronio (NO2+). Nel sistema comune, l’equazione complessiva è un composto di vari equilibri presenti nelle miscele HNO3 – H2SO4 – H2O, che dovrebbero essere considerati quando si valuta la reattività del substrato e l’entità della nitrazione richiesta.
Per la mononitrazione aromatica su larga scala, un tipico agente nitrante è costituito da acido nitrico al 20%, acido solforico al 60% e acqua al 20%, spesso indicato come “acido misto 20/60/20”. In alternativa, in alcune situazioni, può essere descritto come 15 moli % di acido nitrico, 30 moli % di acido solforico e 55 moli % di acqua.
Il substrato aromatico liquido e il prodotto nitrato formano in genere una fase separata dall’acido misto acquoso. Pertanto, un’agitazione efficiente è fondamentale per massimizzare il contatto con la fase organica e ridurre al minimo la resistenza al trasferimento di massa.
I substrati solidi si sciolgono meglio nella fase di acido solforico. È essenziale ottimizzare varie variabili, come la concentrazione di acido nitrico, la temperatura e altri parametri per ogni nitrazione specifica per ottenere la formazione di isomeri desiderata e ridurre al minimo le reazioni collaterali.
Le reazioni di radicali liberi, in genere impiegate nella fase di vapore con acido nitrico o biossido di azoto come agente nitrante, non sono comunemente utilizzate nella nitrazione aromatica. Sono più adatte per la nitrazione alifatica.
4. Meccanismi di reazione della nitrazione
Sono stati condotti esperimenti approfonditi sulla nitrazione aromatica sin dalla conferma dello ione nitronio (NO2+) come specie attiva da parte della scuola Ingold-Hughes nel 1950, utilizzando l’analisi degli spettri Raman.
Mentre la temperatura e il grado di miscelazione svolgono ruoli cruciali in tutti gli agenti nitranti, altre variabili spesso portano a risultati incoerenti. Nella nitrazione commerciale utilizzando HNO3-H2SO4, le costanti di velocità relative presentano un’ampia gamma, con conseguenti tempi di reazione che variano da diversi secondi per i substrati attivi a diverse ore per i substrati inattivi.
È stato sostenuto che nelle condizioni non ideali della produzione su larga scala, il trasferimento di massa può avere un maggiore controllo sulla nitrazione rispetto alla cinetica, sfidando l’ipotesi di molti studi di laboratorio secondo cui la resistenza al trasferimento di massa è trascurabile.
Inoltre, un’ipotesi precedente secondo cui la velocità di nitrazione si allinea con la formazione di equilibrio dello ione nitronio è stata messa in discussione a causa della consapevolezza che meccanismi diversi possono essere applicati a diverse concentrazioni di acido.
La Figura 1 illustra il meccanismo che può spiegare tutti i dati disponibili sulla nitrazione di substrati semplici come benzene e toluene (esclusi fenoli o polialchilbenzeni). Questo meccanismo coinvolge quattro costanti di velocità e tre significative reazioni reversibili, rendendo la cinetica altamente complessa, anche se la reazione è interamente controllata cineticamente.
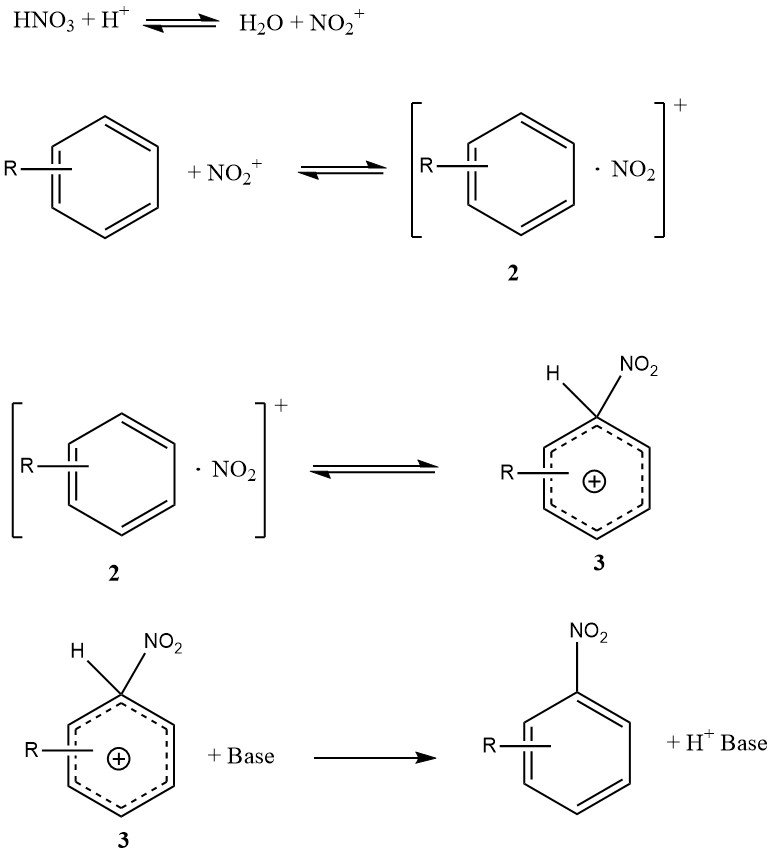
Il complesso di incontro o la coppia di incontro (2) è una caratteristica innovativa di questo meccanismo. È un complesso molecolare di natura meno specifica rispetto al precedente concetto di complesso p intermedio. È importante notare che il complesso di incontro (2) svolge un ruolo cinetico e può effettivamente essere determinante per la velocità.
La conversione del complesso s (3), a volte indicato come intermedio di Wheland, nel prodotto non è limitante per la velocità perché la reazione di nitrazione non presenta un effetto isotopico cinetico primario.
In condizioni specifiche, la formazione dello ione nitronio potrebbe essere determinante per la velocità, ma per i substrati reattivi in acido solforico acquoso, la formazione del complesso di incontro (2) è prevalentemente la fase determinante per la velocità.
Al contrario, la nitrazione di toluene, benzene e altri composti aromatici meno reattivi segue una legge di velocità complessiva in cui la formazione del complesso s (3) è principalmente la fase determinante per la velocità.
Nel caso del fenolo, quando l’anello è altamente attivato verso l’attacco elettrofilo, lo ione nitrosonio (NO+) diventa significativo e porta alla formazione di un composto nitroso intermedio. Questo intermedio viene ulteriormente ossidato dall’acido nitrico per produrre il nitro derivato durante la rigenerazione dell’acido nitroso.
Un’altra eccezione al meccanismo generale è l’attacco ipso-elettrofilo in una posizione sostituente. Con di- e polialchilbenzeni, lo ione ipso-nitroarenio (4) può formarsi al posto del convenzionale intermedio di Wheland (3).
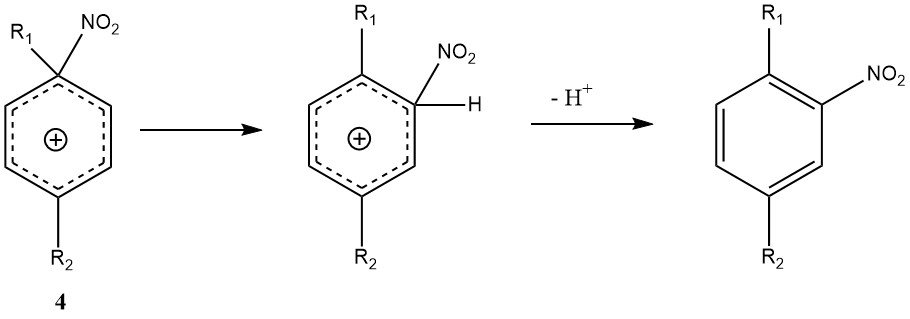
Il riarrangiamento di 4 nell’intermedio di Wheland può verificarsi, ma è accompagnato da reazioni collaterali come la nitro-dealchilazione, rendendo la nitrazione dei polialchilbenzeni potenzialmente in grado di produrre prodotti di miscela più variabili rispetto ad altre nitrazioni.
Una migliore comprensione della formazione di intermedi ipso-Wheland ha portato al loro utilizzo in altre reazioni, in particolare con nucleofili.
Riferimento
- Nitro Compounds, Aromatic; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a17_411
