Isoprene: proprietà, produzione e usi
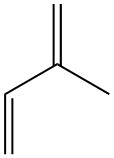
L’isoprene, noto anche come 2-metil-1,3-butadiene, è un idrocarburo a cinque atomi di carbonio che esiste in natura a livelli di traccia. È un liquido incolore e volatile con formula chimica C5H8.
L’isoprene è utilizzato come elemento fondamentale per numerosi prodotti naturali. Tra questi, i terpeni (gomma naturale, canfora), la vitamina A e gli ormoni sessuali steroidei (rispettando la “regola dell’isoprene” di Wallach e Ruzicka). Fu sintetizzato per la prima volta dalla pirolisi della gomma naturale nel 1860 da Williams.
Sommario
1. Proprietà fisiche dell’isoprene
In condizioni normali, l’isoprene è un liquido incolore e volatile, insolubile in acqua a 20 °C. È miscibile con solventi organici come etanolo, etere dietilico, acetone e benzene.
L’isoprene forma miscele azeotropiche binarie con vari composti come metanolo, n-pentano, disolfuro di carbonio, formiato di metile, bromoetano, etanolo, solfuro di dimetile, acetone, ossido di propilene, formiato di etile, nitrito di isopropile, metilale, etere dietilico, perfluorotrietilammina, acetonitrile e isopropilammina.
Le importanti proprietà fisiche dell’isoprene sono descritte in dettaglio nella Tabella 1.
| Proprietà | Valore |
|---|---|
| Peso molecolare | 68,118 g/mol |
| Punto di fusione (101,3 kPa) | -145,95 °C |
| Punto di ebollizione (101,3 kPa) | 34,059 °C |
| Temperatura critica | 483,3 K |
| Pressione critica | 3,74 MPa |
| Volume critico | 266 cm3/mol |
| Densità (293 K) | 0,68095 g/cm3 |
| Viscosità (293 K) | 0,216 mPa.s |
| Tensione superficiale (293 K) | 18,22 mN/m |
| Indice di rifrazione | 1,42194 |
| Pressione di vapore | |
| -20 °C | 9,8 kPa |
| 0 °C | 26,4 kPa |
| 20 °C | 60,7 kPa |
| 34,059 °C | 101,3 kPa |
| 40 °C | 123,8 kPa |
| 60 °C | 229,1 kPa |
| 80 °C | 392,1 kPa |
| 100 °C | 629,5 kPa |
| Calore specifico | |
| Vapore (298 K) | 102,69 J mol-1 K-1 |
| Liquido (298 K) | 151,07 J mol-1 K-1 |
| Limiti di esplosività nell'aria (pressione totale 13 kPa, 25 °C) | |
| Limite superiore | 7 – 9,7 vol% (200 – 275 g/m3) |
| Limite inferiore | 1 – 1,5 vol% (28 – 40 g/m3) |
| Pressione massima di esplosione | 0,66 MPa |
2. Proprietà chimiche dell’isoprene
L’analisi spettroscopica indica che a 50 °C, la maggior parte delle molecole di isoprene esiste nella conformazione s-trans. Solo il 15% adotta la forma s-cis ad alta energia.
Come diene coniugato, l’isoprene mostra un comportamento caratteristico. La presenza di un gruppo metilico aumenta la sua reattività con elettrofili e dienofili di Diels-Alder rispetto al butadiene.
L’isoprene è più reattivo del butadiene a causa dei suoi quattro atomi di idrogeno unici rispetto ai due del butadiene. L’isoprene partecipa a una vasta gamma di reazioni, tra cui sostituzione, addizione, formazione di anelli, complessazione e telomerizzazione.
La reazione con i radicali idrossilici è il percorso dominante per la degradazione dell’isoprene nell’atmosfera. I radicali idrossilici, molecole altamente reattive, avviano una complessa reazione a catena che scompone l’isoprene in vari prodotti. Può anche essere decomposto dall’ozono.
A temperature elevate e in condizioni specifiche, l’isoprene forma perossidi e radicali liberi, portando infine alla scomposizione dell’isoprene in diversi prodotti come dimetossimetano e naftalene.
L’isoprene può subire reazioni di addizione simili agli alcheni, ma non è selettivo e produce una miscela di prodotti.
L’unica reazione chimica importante dell’isoprene è la sua conversione in terpeni. L’isoprene è utilizzato principalmente nella sintesi dei polimeri.
3. Produzione di isoprene
3.1. Produzione di isoprene da olefine
L’isoprene è prodotto principalmente dalla reazione di Prins catalizzata da acido della formaldeide con isobutene, producendo 4,4-dimetil-1,3-diossano, che viene poi scisso in fase gassosa (a 200-300 °C) per produrre isoprene e recuperare metà della formaldeide.
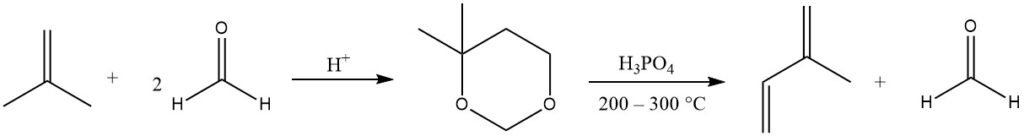
Diverse aziende hanno perfezionato questo processo grazie ai materiali di partenza facilmente reperibili. In Giappone esistono attualmente impianti di produzione di questo tipo.
Gli sforzi si sono concentrati sulla semplificazione e sul miglioramento dell’economicità della sintesi di isoprene da isobutene e formaldeide. Takeda Chemical in Giappone ha proposto un processo in fase gassosa monofase che utilizza catalizzatori di ossido.
I sottoprodotti della formaldeide rappresentano una sfida. Aziende come Idemitsu e Sun Oil utilizzano derivati della formaldeide (metilale, dimetossimetano) per evitare la formazione di resina. Metodi alternativi prevedono l’integrazione della produzione di formaldeide direttamente nel processo utilizzando metanolo e ossigeno o metil terz-butil etere (MTBE) e ossigeno.
I brevetti giapponesi hanno esplorato l’alcol terz-butilico come fonte C4, mentre le ex pubblicazioni sovietiche hanno descritto metodi basati sulla scissione del 1,3-diossano.
Il processo in fase gassosa monofase è limitato dalla bassa resa spazio-temporale del catalizzatore e dalla rapida disattivazione. Non è chiaro se una di queste varianti abbia raggiunto la produzione commerciale.
Il 2-metilbutanale è un’altra materia prima per la produzione di isoprene. Viene prodotto tramite idroformilazione del 2-butene utilizzando un catalizzatore al rodio.
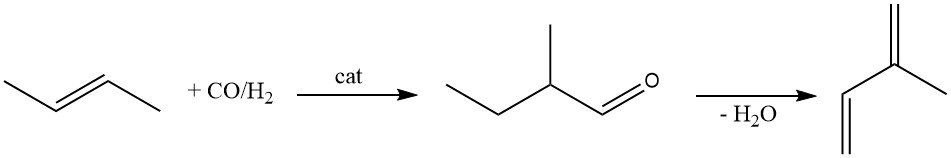
La disidratazione catalitica del 2-metilbutanale in isoprene è stata ampiamente studiata. Sebbene siano stati proposti numerosi catalizzatori (β-fosfato, fosfato di ammonio e magnesio, setacci molecolari e zeoliti), tutti soffrono di una rapida perdita di attività.
Tuttavia, le zeoliti modificate con silano o cesio mostrano durate migliori. La scissione del 3-metilbutanale ha prodotto risultati più scadenti. Attualmente, nessuna struttura industriale utilizza la sintesi di isoprene dal 2-metilbutanale.
La codimerizzazione di etilene e propene porta al 2-metil-1-butene, che può essere deidrogenato a isoprene, ma questo metodo è ancora in fase sperimentale.
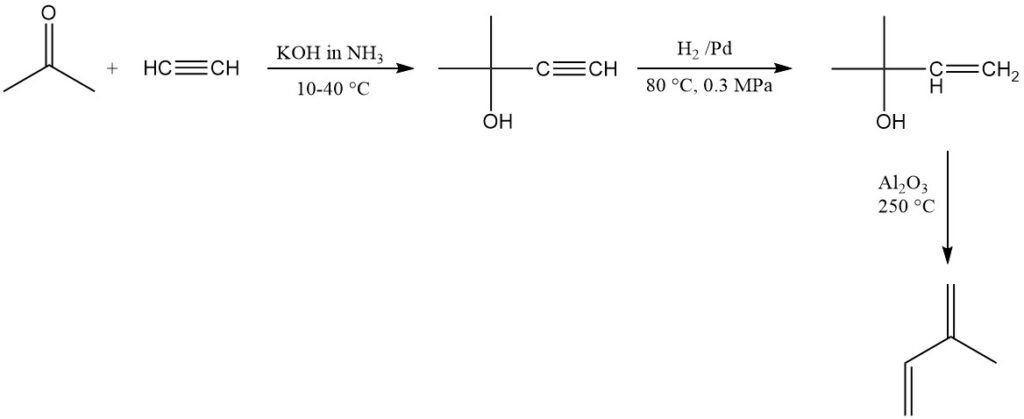
SNAM in Italia produce commercialmente isoprene utilizzando acetilene e acetone, ma l’impianto non è più operativo. Un impianto simile esiste in Sud Africa. Questo metodo produce isoprene ad alta purezza ma è relativamente costoso.
Il processo Goodyear-Scientific Design ha prodotto isoprene tramite dimerizzazione del propene a 2-metil-1-pentene, seguita da isomerizzazione a 2-metil-2-pentene e successiva cracking. La prima sintesi commerciale di isoprene ha utilizzato questo approccio (Beaumont, Texas), ma la produzione è cessata nel 1975 a causa dell’aumento dei costi del propene.
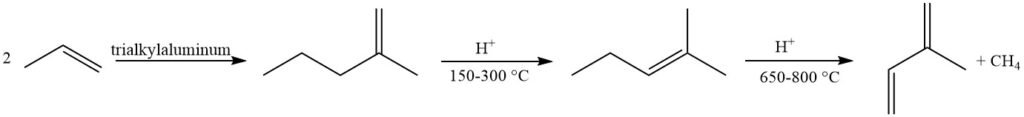
La metatesi delle olefine offre un approccio interessante utilizzando prodotti petrolchimici facilmente reperibili. Una frazione di butene viene convertita in 2-metil-2-butene e propene, con successiva deidrogenazione del 2-metil-2-butene in isoprene. Tuttavia, questo metodo soffre della formazione di sottoprodotti dovuta alle reazioni tra varie olefine nel reattore.
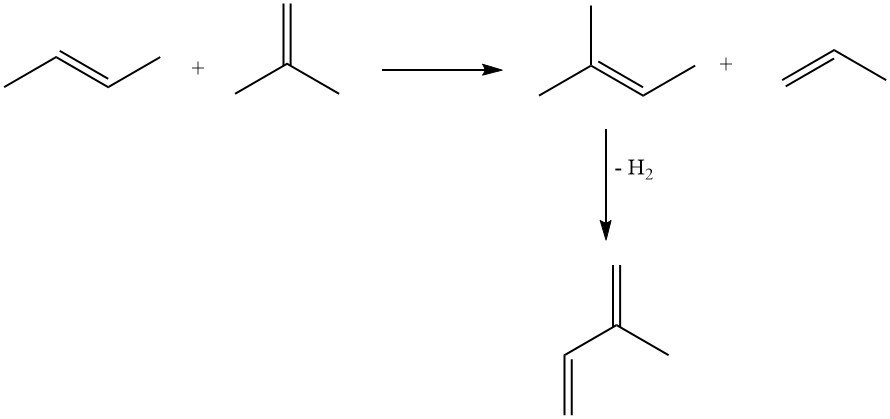
3.2. Produzione di isoprene mediante deidrogenazione di isopentano o metilbuteni
L’isoprene può essere prodotto mediante deidrogenazione di isopentano o metilbuteni (isopenteni). Queste reazioni sono simili alla deidrogenazione di n-butano e n-buteni a butadiene.
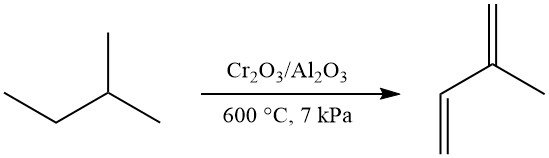
La deidrogenazione in un unico passaggio di isopentano a isoprene può essere ottenuta utilizzando il processo Houdry-Catadiene (catalizzatore Cr2O3/Al2O3, ~600 °C, ~7 kPa), producendo il 52% di isoprene. Questo metodo era utilizzato commercialmente nell’ex Unione Sovietica.
Impianti di produzione di isoprene basati sulla deidrogenazione del metilbutene esistevano negli Stati Uniti e nei Paesi Bassi, ma al momento non sono operativi.
Il materiale di partenza viene in genere estratto dai gas di scarico del cat-cracker utilizzando la procedura Sinclair (estrazione con acido solforico seguita da estrazione di ritorno con paraffine).
La deidrogenazione viene eseguita con un catalizzatore Shell (Fe2O3-K2CO3-Cr2O3) a 600 °C con diluizione a vapore e raggiunge una resa dell’85% di isoprene.
È stata esplorata la deidrogenazione ossidativa sia dell’isopentano che dei metilbuteni. Sono state segnalate rese e selettività del 60% e del 95% per l’isoprene. I catalizzatori silicati drogati con ossidi alcalino-terrosi o ossidi di nichel, ferro o cobalto vengono utilizzati per la deidrogenazione ossidativa dei metilbuteni in isoprene.
3.3. Recupero di isoprene da frazioni di cracking C5
L’isoprene può essere recuperato dai sottoprodotti C5 della pirolisi degli idrocarburi nella produzione di etilene. Il cracking della nafta produce “benzina da cracking” con basso contenuto di isoprene e altri idrocarburi C5, principalmente aromatici C6-C8.
La distillazione separa questa miscela in frazioni C5 e aromatiche. La resa di isoprene è in genere del 2-5% in peso in base all’etilene, aumentando con materie prime più pesanti come il gasolio. La resa di isoprene diminuisce con una maggiore severità di cracking (temperatura/tempo di residenza), ma la sua concentrazione nella frazione C5 aumenta. Il recupero di isoprene dalle frazioni di cracking è più efficiente dal punto di vista energetico rispetto alla sintesi chimica.
Materie prime di cracking più pesanti per la produzione di etilene porteranno a più sottoprodotti di isoprene. Alcuni cracking recuperano solo una frazione aromatica dalla benzina di cracking, mentre il residuo C5 viene spesso riciclato con la frazione C4 nell’alimentazione del cracking.
L’isolamento di isoprene puro dalla frazione C5 non è ottenibile tramite semplice distillazione a causa dei punti di ebollizione simili dei componenti e della formazione di un azeotropo con n-pentano. L’arricchimento per distillazione al 25-50% è utilizzato commercialmente per ridurre i costi di trasporto e separazione.
Le tecniche di separazione per produrre isoprene puro sono la distillazione azeotropica, l’isolamento chimico e la distillazione estrattiva utilizzando solventi quali N-metilpirrolidone, dimetilformammide e acetonitrile.
Un semplice processo di isolamento dell’isoprene è illustrato nella Figura 1.
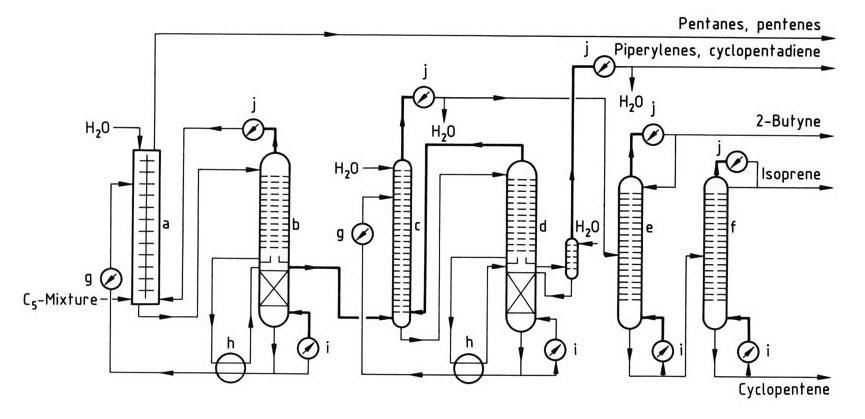
a) Colonna di estrazione liquido-liquido; b) – d) Colonne per distillazione estrattiva; e) Colonna di butino; f) Colonna di isoprene; g) Refrigeratore; h) Scambiatore di calore; i) Ribollitore; j) Condensatore
Il primo passaggio è una combinazione di estrazione liquido-liquido e distillazione estrattiva, particolarmente adatta per frazioni C5 a basso contenuto di isoprene. La preconcentrazione dell’isoprene avviene nell’estrattore, seguita dalla rimozione dell’isoprene grezzo dalla colonna di distillazione estrattiva.
La successiva distillazione estrattiva rimuove piperileni e ciclopentadiene. La purificazione finale per l’isoprene di grado di polimerizzazione viene ottenuta in colonne di distillazione aggiuntive. Questo processo consente l’elaborazione di frazioni C5 contenenti ciclopentadiene, che viene rimosso con piperileni.
Il processo può essere adattato per isolare ciclopentadiene o ciclopentene con apparecchiature aggiuntive e i piperileni puri possono essere recuperati con una colonna supplementare.
4. Utilizzi dell’isoprene
4.1. Utilizzo dell’isoprene nella sintesi dei polimeri
Il poli(cis-1,4-isoprene) (gomma isoprene, IR), in particolare il tipo catalizzato al titanio, è l’applicazione principale dell’isoprene. Questa gomma sintetica assomiglia molto alla gomma naturale per struttura e proprietà. La gomma isoprene è utilizzata principalmente nella produzione di pneumatici per veicoli.
Il poli(trans-1,4-isoprene) ha proprietà simili alla guttaperca o alla balata, limitando le sue applicazioni commerciali principalmente all’isolamento dei cavi e alle palline da golf.
Il secondo mercato più grande per l’isoprene è la produzione di copolimeri a blocchi stirene-isoprene-stirene (SIS), un tipo di elastomero termoplastico. Circa 0,79-0,88 tonnellate di isoprene vengono consumate per tonnellata di polimero SIS. Questi copolimeri sono utilizzati come gomme termoplastiche e adesivi sensibili alla pressione o termoindurenti.
Quantità minori di isoprene vengono utilizzate nella produzione di gomma butilica (gomma isobutene-isoprene, IIR), un copolimero con isobutene. Il contenuto di isoprene nella gomma butilica varia dallo 0,5 al 3,0% in moli. L’IIR è nota per la sua bassa permeabilità ai gas, che la rende adatta per tubi flessibili e rivestimenti in pneumatici senza camera d’aria.
Infine, le resine idrocarburiche (resine petrolifere) possono essere prodotte mediante copolimerizzazione dell’isoprene da frazioni di crack C5 prive di ciclopentadiene con altri composti C5 insaturi.
4.2. Utilizzo dell’isoprene nella sintesi dei terpeni
Mentre l’isoprene subisce varie reazioni chimiche, solo la sintesi dei terpeni ha importanza industriale ed è oggetto di ricerca attiva.
Nel 1972, Rhodia ha iniziato a sviluppare un processo per la sintesi di terpeni C10 e derivati da isoprene, acetone e acetilene. L’isoprene reagisce con l’acido cloridrico per formare cloruro di prenile, che viene poi convertito in deidrolinalolo in due fasi.
Rhodia ha utilizzato il deidrolinalolo per varie sintesi ma ne ha interrotto la produzione. Tuttavia, Kuraray in Giappone continua a produrre questi composti, squalano e altri dall’isoprene.
Rhodia ha precedentemente utilizzato una sintesi di Grignard per produrre l’alcol terpenico C10 lavandulolo da due molecole di isoprene.
L’isoprene reagisce tramite oligomerizzazione o telomerizzazione per formare terpeni. Esempi includono l’oligomerizzazione lineare scientificamente e industrialmente rilevante dell’isoprene in mircene e la telomerizzazione con N,N-dietilnerilammina (entrambi terpeni C10).
I terpeni naturali sono costituiti da unità di isoprene disposte “testa-coda” con posizioni specifiche del doppio legame. La produzione di terpeni dall’isoprene richiede la replica di questa struttura, rendendo la sintesi del terpene C10 dall’isoprene generalmente meno favorevole rispetto a percorsi alternativi. La composizione del catalizzatore può influenzare la struttura dei dimetilottadieni sintetizzati dall’isoprene.
Takabe et al. hanno segnalato la sintesi del mircene mediante oligomerizzazione dell’isoprene utilizzando un catalizzatore sodio/dialchilammina. Nissan Chemical Industries ha sviluppato e annunciato la produzione industriale del mircene utilizzando questo metodo.
La telomerizzazione dell’isoprene avviene con vari composti, tra cui ammoniaca o ammine. La regioselettività può essere manipolata variando la quantità e la concentrazione di acidi di Brønsted e Lewis nel catalizzatore.
L’isoprene reagisce con la dietilammina per formare N,N-dietilnerilammina tramite una reazione di telomerizzazione catalizzata da butil litio. Ulteriori reazioni dalla N,N-dietilnerilammina producono linalolo, geraniolo, nerolo, idrossicitronellale, citronellale e mentolo (Figura 2).
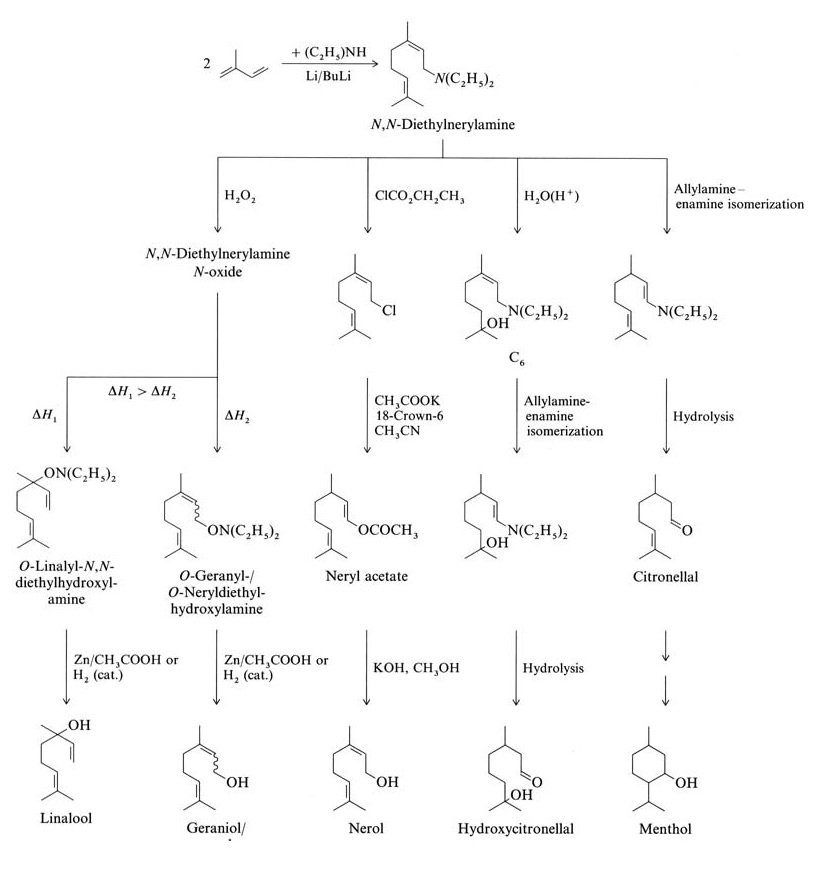
La Takasago Perfumery Company in Giappone utilizza una sintesi industriale per L-mentolo enantiomericamente puro da citronellale otticamente attivo. Questo processo comporta l’isomerizzazione asimmetrica allilammina-enammina di N,N-dietilgeranilammina o N,N-dietilnerilammina con un catalizzatore Rh-BINAP.
5. Tossicologia dell’isoprene
Tossicità acuta
L’esposizione ad alti livelli di isoprene provoca effetti anestetici negli animali, portando a paralisi e morte. Singole esposizioni per inalazione di 2 ore nei topi (56.000 mg/m³) non hanno mostrato effetti avversi. Livelli di 98.000–126.000 mg/m³ hanno indotto una narcosi profonda e l’esposizione a 140.000 mg/m³ per 2 ore ha causato mortalità (LC50 = 180.000 mg/m³ per i ratti).
La concentrazione soglia per l’irritazione nei gatti è riportata come 800 mg/m³. I valori di LD50 orale e intraperitoneale nei ratti maschi sono stati determinati rispettivamente come 2100 mg/kg e 1400 mg/kg per l’isoprene liquido. Una singola esposizione cutanea (1 mL/kg) nei ratti non ha causato mortalità o sintomi avversi.
Tossicità da esposizione ripetuta
Ratti e topi sono stati esposti a 0, 438, 875, 1750, 3500 e 7000 ppm di isoprene per due settimane tramite inalazione. I ratti non hanno mostrato cambiamenti correlati all’esposizione.
I topi esposti a 7000 ppm hanno mostrato un minore aumento di peso corporeo, mentre tutti i gruppi hanno mostrato anemia, atrofia testicolare, degenerazione epiteliale olfattiva e cambiamenti iperplastici epiteliali nello stomaco. Similmente al 1,3-butadiene, i topi sembrano essere più sensibili dei ratti.
L’esposizione cutanea ripetuta (500 mg x 2 applicazioni/giorno per 5 giorni) sulle orecchie dei conigli ha causato solo un’irritazione lieve e reversibile. I dati sull’esposizione per inalazione a lungo termine non sono disponibili.
Mutagenicità
L’isoprene e i suoi monoepossidi non sono mutageni nel test di Ames. Tuttavia, il biossido di isoprene (2-metil-1,2,3,4-diepossibutano) ha mostrato mutagenicità in questo sistema di test.
A causa delle potenziali somiglianze con il 1,3-butadiene nella generazione di metaboliti mutageni, è giustificata un’ulteriore valutazione della cancerogenicità dell’isoprene.
L’esposizione per inalazione di topi a 438-7000 ppm di isoprene per 6 ore al giorno per 12 giorni ha determinato un aumento delle frequenze di scambio dei cromatidi fratelli, indicando effetti citogenetici.
I dati sugli effetti riproduttivi o teratogeni non sono disponibili.
Metabolismo
Le frazioni mitocondriali dei roditori convertono l’isoprene nei suoi monoepossidi (3,4-epossi-3-metil-1-butene e 3,4-epossi-2-metil-1-butene), dando origine ai corrispondenti dioli. È stata segnalata una minore ossidazione del metabolita più stabile (3,4-epossi-2-metil-1-butene) in un diepossido.
L’isoprene subisce un metabolismo significativo nel tratto respiratorio. Un’esposizione atmosferica all’isoprene fino a 300 ppm mostra una proporzionalità diretta tra concentrazione di esposizione e metabolismo. Gli effetti di saturazione si verificano oltre 300–500 ppm. I topi metabolizzano l’isoprene a una velocità maggiore rispetto ai ratti.
È stata osservata una sintesi endogena di isoprene. Si stima che i tassi di sintesi nei topi e nei ratti non esposti siano rispettivamente di 0,4 mmol h⁻¹ kg⁻¹ e 1,9 mmol h⁻¹ kg⁻¹.
Effetti sull’uomo
A livelli di esposizione molto elevati, l’isoprene agisce come un narcotico negli esseri umani. Può anche irritare la pelle, gli occhi, le mucose e le vie respiratorie.
Standard igienici
Non è stato stabilito alcun valore limite di soglia (TLV) o concentrazione massima ammissibile (MAK) per l’isoprene. L’ex Unione Sovietica ha fissato una soglia di 40 mg/m³.
Riferimenti
- Isoprene; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a14_627
- https://www.nature.com/articles/s42004-019-0120-9
- https://bmcchem.biomedcentral.com/articles/10.1186/s13065-023-01016-y
- https://www.sciencedirect.com/science/article/abs/pii/S0045653519319812
