Idrossilammina: proprietà, reazioni, produzione e usi

Cos’è l’idrossilammina?
L’idrossilammina è un composto inorganico con formula chimica NH2OH. È un solido cristallino bianco, ma a causa della sua natura igroscopica, si trova quasi sempre e viene utilizzato in soluzione acquosa.
L’idrossilammina, inizialmente segnalata da LOSSEN nel 1865, fu poi isolata come base libera nel 1891 da LOBRY DE BRUYN. RASCHIG ottenne un brevetto per il primo metodo industriale di produzione di solfato di idrossilammonio in Germania (1908) e negli Stati Uniti (1911).
L’importanza dei sali di idrossilammina e delle loro soluzioni risiede nel loro ruolo sostanziale come intermedi in vari processi industriali, in particolare nella produzione di caprolattame. Si stima che la capacità annuale globale di produzione di idrossilammina raggiunga le 800.000 tonnellate metriche.
Sommario
1. Proprietà fisiche dell’idrossilammina
L’idrossilammina, con formula chimica NH2OH, ha la caratteristica di formare cristalli trasparenti, incolori e inodori.
È altamente solubile in acqua, così come in metanolo ed etanolo. Di seguito sono riportate alcune proprietà fisiche associate all’idrossilammina:
| Proprietà | Valore |
|---|---|
| Massa molare | 33,03 g/mol |
| Punto di fusione | 32,05 °C |
| Punto di ebollizione a 29 kPa | 56 °C |
| Pressione di vapore a 0 °C | 0,36 kPa |
| Vapore Pressione a 32 °C | 7,1 kPa |
| Entalpia di formazione | -114 kJ/mol |
1.1. Solfato di idrossilammonio
Il composto di solfato di idrossilammonio, noto anche come (NH3OH)2SO4 o (NH2OH)2·H2SO4, esiste in una forma cristallina che si dissolve facilmente in acqua ma mostra solo una leggera solubilità in solventi organici.
La forma solida di questo composto ha una densità di 1,883 g/cm³, mentre la densità apparente è di circa 1,10 g/cm³.
È importante notare che il solfato di idrossilammonio subisce una decomposizione se esposto a temperature superiori a 120 °C.
Le soluzioni acquose di solfato di idrossilammonio sono limpide e incolori. In una soluzione acquosa all’1% in peso a 20 °C, il pH misura 3,6.
1.2. Cloruro di idrossilammonio
Il cloruro di idrossilammonio cristallino, noto anche come (NH3OH)Cl o NH2OH·HCl, è un sale igroscopico che forma cristalli. Presenta un’elevata solubilità sia in acqua che in metanolo.
L’aggiunta dello 0,5% in peso di silice pirogenica previene efficacemente l’agglomerazione, dove il gel di silice agisce come un componente insolubile e inerte.
Il cloruro di idrossilammonio ha una densità di 1,676 g/cm³ e una densità apparente di circa 0,780 g/cm³.
La sua decomposizione avviene a temperature superiori a 120 °C. Quando disciolta in acqua, una soluzione acquosa all’1% in peso di cloruro di idrossilammonio a 20 °C ha un valore di pH di 3,2.
2. Reazioni chimiche dell’idrossilammina
Con il riscaldamento, i sali di idrossilammonio subiscono una decomposizione e, se si verifica un riscaldamento locale, può portare a una decomposizione esotermica incontrollata. La presenza di impurità di metalli pesanti, in particolare rame, leghe contenenti rame e sali di rame, favorisce la decomposizione.
La decomposizione del solfato di idrossilammonio produce anidride solforosa, monossido di diazoto (ossido nitroso), acqua e solfato di ammonio. D’altra parte, il cloruro di idrossilammonio si decompone in acido cloridrico, azoto, acqua e cloruro di ammonio.
Quando i sali di idrossilammonio reagiscono con l’alcali, producono idrossilammina, che si decompone facilmente. La reazione con i nitriti determina la decomposizione in monossido di diazoto.
Le soluzioni acquose di sali di idrossilammonio presentano acidità. L’esposizione prolungata a 80 °C porta a una lenta decomposizione. L’idrossilammina e i suoi sali agiscono come trappole per radicali in soluzione, portando alla formazione di ammoniaca e azoto.
L’ossidazione dell’idrossilammina, a seconda dell’ossidante e delle condizioni di reazione, produce composti azotati in vari stati di ossidazione.
Agenti riducenti forti come zinco o polvere di ferro producono ammoniaca. Molti ioni metallici formano complessi con l’idrossilammina.
I sali di idrossilammonio possono essere trasformati in acido idrossilammina-O-solfonico quando reagiti con oleum o acido clorosolfonico. Questo acido funge da reagente adatto per processi come l’amminazione, la deaminazione riduttiva, l’idrossimetilazione e la formazione di eterocicli.
L’idrossilammina può reagire sia con atomi di azoto che di ossigeno. Quando si mira a preparare idrossilammine O-sostituite, è necessaria la protezione dell’atomo di azoto per evitare la N-alchilazione.
I composti di idrossilammonio reagiscono con aldeidi e chetoni per formare ossime. β-dichetoni e β-dialdeidi producono isoxazoli di idrossilammina.
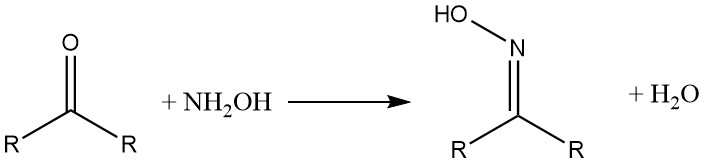
Con gli acidi carbossilici e i loro derivati, l’idrossilammina forma i corrispondenti acidi idrossamici.

La reazione con isocianati e nitrili porta alla formazione rispettivamente di N-idrossiuree e amidossime.

L’idrossilammina reagisce anche con i doppi legami olefinici:
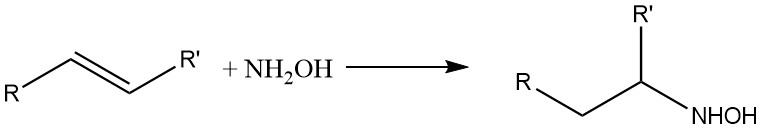
3. Produzione di idrossilammina
La produzione industriale di idrossilammina comporta la riduzione degli stati di ossidazione più elevati dell’azoto. Ad esempio, l’ossido nitrico o l’acido nitrico possono subire un’idrogenazione catalitica per produrre idrossilammina.
La riduzione dell’acido nitroso a idrossilammina comporta l’uso di acido solforoso. In tutti questi processi, il prodotto risultante è una soluzione acquosa di un sale, NH2OH·HX (dove HX rappresenta un acido, come l’acido solforico o fosforico), o (NH3OH)X, piuttosto che idrossilammina libera.
L’idrolisi acida dei nitroalcani primari, che produce contemporaneamente il corrispondente acido carbossilico, svolge un ruolo minore nella produzione complessiva di idrossilammina.
3.1. Idrogenazione catalitica dell’ossido nitrico
Per ottenere ossido nitrico ad elevata purezza, viene impiegato un processo in due fasi. Inizialmente, ammoniaca e ossigeno vengono fatti reagire su un catalizzatore di platino-rodio a temperature superiori a 900 °C.
Per garantire la sicurezza, il gas di reazione viene diluito con sufficiente acqua o vapore acqueo, portando la miscela al di sotto del limite inferiore di esplosione. Questa reazione produce ossido nitrico insieme a biossido di azoto e ossigeno in eccesso come sottoprodotti.
Il secondo passaggio prevede l’idrogenazione del biossido di azoto e dell’ossigeno in eccesso su un catalizzatore d’argento. Il biossido di azoto viene convertito in ossido nitrico, mentre l’ossigeno in eccesso viene trasformato in acqua.
Dopo la condensazione e il recupero simultaneo del vapore acqueo, l’ossido nitrico viene purificato utilizzando una lavatrice.
Viene quindi convertito in idrossilammina facendolo reagire con idrogeno a una temperatura inferiore a 50 °C su una sospensione di catalizzatore al platino parzialmente avvelenata in acido solforico. Come sottoprodotti, vengono prodotte piccole quantità di solfato di ammonio e monossido di diazoto.
Il processo industriale segue un approccio continuo multifase, con un’ampia ricircolazione dei gas di scarico.
Il gas residuo, contenente idrogeno, azoto, ossido nitrico e monossido di diazoto, può essere bruciato per recuperare vapore. Selezionando attentamente la composizione del gas, è possibile evitare miscele di gas esplosive durante la sintesi dell’idrossilammina.
Inoltre, un processo modificato prevede l’idrogenazione catalitica del monossido di azoto, che porta alla produzione sia di cicloesanone ossima che di idrossilammina. Questo metodo è noto come ossimazione acida.
3.2. Idrogenazione catalitica dei nitrati
L’idrossilammina è comunemente prodotta dal processo idrossilammina-fosfato-ossima (HPO). Questo processo comporta l’idrogenazione di una soluzione di nitrato di ammonio in presenza di acido fosforico.
Il processo HPO viene in genere eseguito insieme alla sintesi di cicloesanone ossima, che viene utilizzata nella produzione di caprolattame.
3.3. Il processo Raschig
Il processo Raschig, che viene spesso modificato, rimane un metodo significativo per la produzione industriale di idrossilammina.
Nel processo Raschig, acqua, ammoniaca e anidride carbonica subiscono una reazione all’interno di una colonna di assorbimento. Questa reazione porta alla formazione di una soluzione di carbonato di ammonio, che a basse temperature reagisce con gli ossidi di azoto per produrre una soluzione alcalina di nitrito di ammonio:
NH3 + H2O + CO2 → (NH4)2CO3
(NH4)2CO3 + NO + NO2 → 2 NH4NO2 + CO2
Nella fase successiva, il nitrito di ammonio viene convertito in disolfonato di idrossilammina di ammonio facendolo reagire con anidride solforosa:
NH4NO2 + 2 SO2 + NH3 + H2O → HO–N(SO3NH4)2
In questo processo, qualsiasi eccesso di idrossilammina disolfonato di ammonio viene riciclato. La soluzione contenente idrossilammina disolfonato di ammonio viene estratta e il sale viene idrolizzato e neutralizzato, con conseguente produzione di solfato di idrossilammina e solfato di ammonio come prodotti finali.
HO–N(SO3NH4)2 + H2O → (NH3OH)2SO4 + (NH4)2SO4
3.4. Scissione acida dei nitroalcani
La scissione di miscele contenenti nitropropano e nitrometano può essere ottenuta trattandole con acido solforico a temperature elevate. Questa reazione produce solfato di idrossilammonio e il corrispondente acido carbossilico:
Nitropropano + Nitrometano + Acido solforico → Solfato di idrossilammonio + Acido carbossilico
Tuttavia, questo processo è stato impiegato in misura limitata a causa del suo costo elevato e della limitata disponibilità delle materie prime richieste.
4. Usi dell’idrossilammina
Oltre il 95% della produzione di idrossilammina è dedicata alla produzione di cicloesanone ossima o caprolattame.
Diversi produttori utilizzano l’idrogenazione o il processo Raschig, con variazioni osservate principalmente nella quantità di solfato di ammonio generato durante l’ossimazione.
I sali di idrossilammonio fungono da forma stabile di idrossilammina e trovano applicazioni in vari settori dell’industria chimica. Alcuni usi degni di nota includono:
- Industria chimica: agisce come reagente per la produzione di ossime come intermedi, oltre a funzionare come agente ossidante o riducente a seconda del pH.
- Vernici e rivestimenti: utilizzati nella produzione di ossime specializzate utilizzate come agenti anticrema.
- Prodotti farmaceutici: impiegati nella produzione di antibiotici, steroidi, tranquillanti, spasmolitici e farmaci antitubercolari.
- Fotografia: utilizzato come stabilizzante per sviluppatori e come additivo nelle emulsioni colorate.
- Industria della gomma: agisce come regolatore nella polimerizzazione della gomma sintetica, come antiossidante per la gomma naturale e come acceleratore nella vulcanizzazione della gomma sintetica.
- Sapone: funge da agente ausiliario nella raffinazione dei grassi per la produzione di sapone.
- Materie plastiche: funge da regolatore e inibitore in vari processi di polimerizzazione.
- Metallurgia: utilizzata come additivo per il trattamento superficiale dell’acciaio, come agente ausiliario per l’estrazione di metalli dai liquami di scarto dell’elettrolisi e per il recupero di discariche. Serve anche come agente di flottazione per i minerali di rame.
- Industria nucleare: funge da agente ausiliario per la separazione di uranio e plutonio.
- Tessili: funge da agente ausiliario in specifici processi di tintura, da fissativo per coloranti tessili e da materiale di partenza per coloranti tessili a base di isatina e isoxazolo.
- Protezione delle colture: funge da materiale di partenza per la produzione di insetticidi, erbicidi e regolatori della crescita delle piante.
- Cibo: funge da intermedio nella produzione di dolcificanti.
Queste applicazioni evidenziano la versatilità e l’importanza dei sali di idrossilammonio in un’ampia gamma di settori.
5. Tossicologia e salute sul lavoro
I composti di idrossilammina sono considerati dannosi per la salute e possono causare irritazione. La LD50 (orale, ratto) per i composti di idrossilammina è di circa 600-640 mg/kg. In termini di tossicità acquatica, la LC50 (golden orfe, 48 ore) per il solfato di idrossilammina varia da 1 a 10 mg/L.
A contatto con la pelle, l’idrossilammina può causare irritazione da lieve a moderata ed è possibile una sensibilizzazione. Ha anche un effetto irritante da moderato a forte sulle mucose, come gli occhi.
L’idrossilammina può essere assorbita attraverso la pelle e ha il potenziale per formare metaemoglobina.
Studi che esaminano gli effetti teratogeni dell’idrossilammina (nei ratti) non hanno mostrato effetti dannosi sulla prole. Mentre l’idrossilammina e i suoi sali non sono considerati cancerogeni in base ai dati attuali, si è scoperto che sono mutageni per gli organismi inferiori.
È importante evitare il contatto con i sali di idrossilammonio a causa dei loro effetti irritanti e del potenziale effetto della polvere sulla pelle, sugli occhi e sulla gola. In caso di contatto con la pelle o gli occhi, le aree interessate devono essere accuratamente risciacquate con acqua.
L’ingestione di sali di idrossilammonio deve essere rigorosamente evitata e, se necessario, consultare un medico. I sali di idrossilammonio devono essere etichettati come materiali pericolosi.
Riferimento
- Hydroxylamine; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/abs/10.1002/14356007.a13_527
