Ftalimmide: proprietà, reazioni, produzione e usi
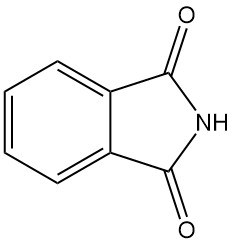
Cos’è la ftalimmide?
La ftalimmide, nota anche come 1,3-diossoisoindolina, è un composto organico con formula chimica C8H5O2N. È un solido bianco leggermente solubile in acqua e solubile in soluzioni basiche.
Sommario
1. Proprietà fisiche della ftalimmide
La ftalimmide è un composto eterociclico che forma aghi o prismi bianchi quando cristallizzato dalla soluzione e piastrine dalla sublimazione.
Ha una solubilità limitata in acqua (0,3 g a 20 °C, 0,9 g a 50 °C e 2,2 g a 100 °C per 100 g di acqua). Tuttavia, si dissolve facilmente in acido acetico, soluzione di idrossido di sodio e soluzione di idrossido di potassio.
La ftalimmide sublima quando riscaldata oltre il suo punto di fusione. Questa proprietà ne semplifica la purificazione.
Alcune delle proprietà fisiche della ftalimmide sono elencate nella seguente tabella:
| Proprietà | Valore |
|---|---|
| Numero CAS | [85-41-6] |
| Formula | C8H5NO2 |
| Peso molecolare | 147,14 g/mol |
| Punto di fusione | 238 °C |
| pKa | 8,30 |
| Calore di combustione | 3560 kJ/mol |
| Calore di fusione | 187,6 J/g |
| Capacità termica specifica (100 °C) | 1,21 J g-1 K-1 |
| Pressione di vapore a 120 °C | 0,10 mbar |
| Pressione di vapore a 150 °C | 0,95 mbar |
| Pressione di vapore a 180 °C | 5,93 mbar |
| Pressione di vapore a 220 °C | 30,7 mbar |
| Pressione di vapore a 254 °C | 187,6 mbar |
| Punto di infiammabilità | 214 °C |
| Temperatura di accensione | 530 °C |
2. Reazioni della ftalimmide
La ftalimmide reagisce con le basi per formare sali solubili in acqua. Questi sali possono quindi subire ulteriori reazioni con alogeni (Cl2, Br2 e I2) per produrre i corrispondenti derivati N-cloro, N-bromo o N-iodo della ftalimmide.
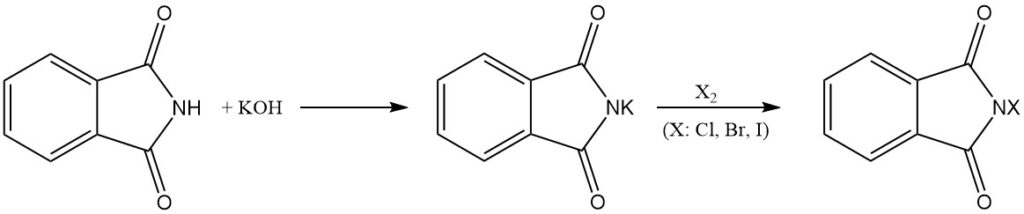
I derivati N-alogeni possono anche essere ottenuti trattando le ftalimmidi di metalli alcalini (ad esempio, ftalimmide di potassio) con acido ipocloroso (HOCl) o ipobromoso (HOBr).
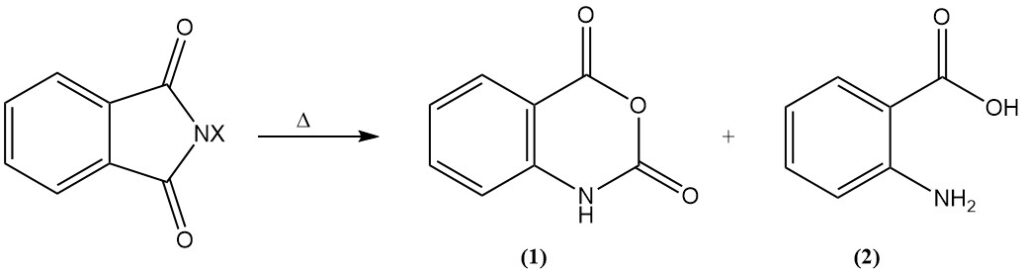
Dopo il riscaldamento, i derivati N-alogeni subiscono la degradazione di Hofmann, con conseguente formazione di anidride isatoica (1) o acido antranilico (acido o-amminobenzoico) (2).
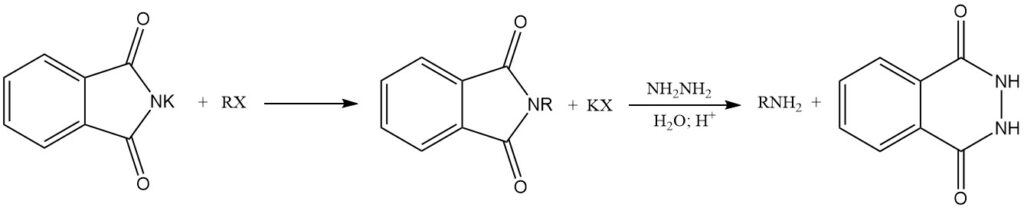
La reazione di ftalimmidi di metalli alcalini con alogenuri alchilici (RX) produce N-alchilftalimidi. La successiva idrolisi o il trattamento con idrazina (idrazinolisi) di queste N-alchilftalimidi forma ammine primarie. Questa sequenza di reazione è nota come sintesi di Gabriel.
3. Produzione industriale di ftalimmide
La ftalimmide è sintetizzata principalmente da anidride ftalica e ammoniaca, sebbene esistano metodi alternativi che utilizzano urea o ammossidazione di o-xilene.
3.1. Produzione di ftalimmide da anidride ftalica e ammoniaca
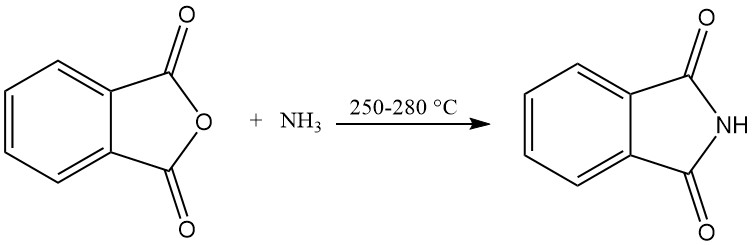
I processi continui sono utilizzati nella produzione di ftalimmide su scala industriale.
Il processo del tubo di reazione verticale utilizza un tubo di reazione verticale riscaldato esternamente riempito con materiale di riempimento. Anidride ftalica fusa e ammoniaca in eccesso vengono immesse continuamente nella parte superiore del tubo e reagiscono a 250-280 °C.
I gas di reazione vengono quindi raffreddati in una camera di sublimazione, dove la ftalimmide solida si deposita e viene scaricata. L’ammoniaca e l’acqua in eccesso vengono rimosse tramite un tubo di scarico dei gas. Questo processo produce ftalimmide con una purezza del 99% e un’elevata resa del 98%.
Nel processo controcorrente, l’anidride ftalica fusa viene immessa continuamente nella parte superiore di un reattore, mentre l’ammoniaca viene immessa continuamente nella parte inferiore. La temperatura aumenta gradualmente da circa 150 °C nella parte superiore a un massimo di 270 °C nella parte inferiore.
La ftalimmide fusa con una purezza del 99% esce dal reattore e viene raffreddata e sfaldata. Può essere sciolta in una soluzione acquosa alcalina per un ulteriore utilizzo.
Il gas di scarico dalla testa del reattore, contenente vapore acqueo, ftalimmide sublimata e componenti non reagiti, viene lavato con ftalimmide fusa dal fondo del reattore in modo controcorrente. Questo processo di lavaggio purifica lo scarico e consente il recupero dei materiali di partenza non reagiti.
3.2. Produzione di ftalimmide da anidride ftalica e urea
La ftalimmide può essere prodotta da anidride ftalica e urea in un processo senza solventi o in un solvente.
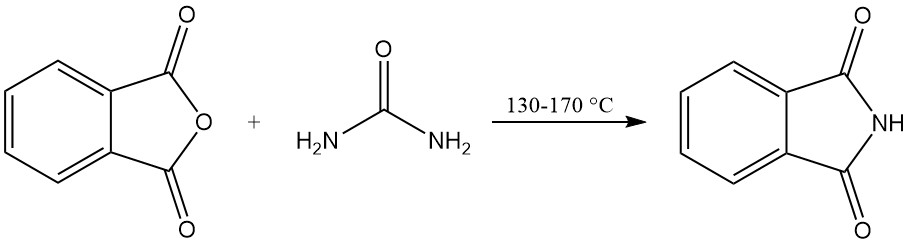
Nel processo senza solventi, una miscela di anidride ftalica e urea viene riscaldata in un recipiente sigillato. La reazione procede a 130–140 °C, con anidride carbonica e vapore acqueo come gas sottoprodotti. La temperatura sale a circa 160 °C a causa della reazione esotermica.
La reazione è completata quando cessa lo sviluppo di gas. La miscela di reazione solidificata viene quindi raffreddata, macinata e utilizzata direttamente senza ulteriore purificazione. Questo metodo offre rese elevate, superiori al 90%.
Nel processo che utilizza un solvente, il solvente è in genere un idrocarburo sostituito o non sostituito, un composto aromatico o un composto eteroaromatico (ad esempio, n-propilbenzene, cumene, 1,2-diclorobenzene, picolina).
Il solvente deve essere scelto in modo che l’urea sia insolubile mentre l’acido ftalico o l’anidride hanno una solubilità limitata. La reazione avviene al di sotto del punto di ebollizione del solvente (tipicamente 160–170 °C). Dopo il completamento, il prodotto di ftalimmide puro viene isolato tramite filtrazione e lavaggio con acqua, ottenendo rese del 95–100%.
3.3. Produzione di ftalimmide da o-xilene
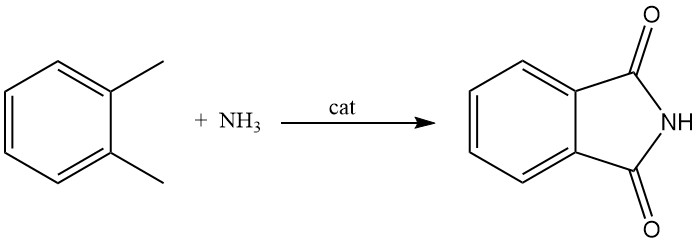
Sebbene meno comune dei metodi che utilizzano l’anidride ftalica, la ftalimmide può anche essere prodotta dall’o-xilene. Questo processo comporta la reazione dell’o-xilene in fase gassosa con ammoniaca in presenza di un catalizzatore di ossido metallico. Questo catalizzatore agisce anche come donatore di ossigeno.
A seconda delle condizioni di reazione e del controllo, questo processo può produrre selettivamente ftalimmide, ftalamide o ftalonitrile.
4. Usi della ftalimmide
La ftalimmide è utilizzata come materia prima in diversi settori. È un precursore per la produzione di acido antranilico mediante degradazione di Hofmann ed è utilizzata nella sintesi di Gabriel per produrre un’ampia gamma di ammine primarie.
La ftalimmide è utilizzata come gruppo protettivo nella chimica organica, in particolare nella sintesi peptidica. Reagendo con il gruppo amminico, previene reazioni indesiderate mentre il resto della molecola può essere trasformato. Può essere rimosso selettivamente per dare l’ammina libera.
Viene anche utilizzato come intermedio nella produzione di pesticidi agricoli, conservanti del legno, alcuni pigmenti e prodotti farmaceutici come Talidomide, Amphotalide, Taltrimide, Talmetoprim e Apremilast.
5. Tossicologia della ftalimmide
Sebbene i dati sulla tossicità della ftalimmide siano limitati, le informazioni disponibili suggeriscono che abbia una bassa tossicità.
La ftalimmide viene scomposta nel corpo in acido ftalico e ammoniaca.
Studi su ratti e topi indicano una bassa tossicità orale acuta (LD50 > 5000 mg/kg). Non è stata osservata alcuna irritazione cutanea o oculare negli studi sui conigli.
Studi di inalazione su ratti a varie concentrazioni non hanno rivelato effetti avversi correlati alla sostanza. Mancano studi a lungo termine.
I test di Ames non hanno mostrato effetti genotossici (dannosi sul DNA).
Non sono disponibili dati affidabili sulla tossicità riproduttiva.
Riferimenti
- Phthalic Acid and Derivatives, Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a20_181.pub2
- PRACTICAL CONSIDERATIONS IN PREPARATION OF AMINES. – https://www.sciencedirect.com/science/article/abs/pii/B9780080119137500136
- https://go.drugbank.com/categories/DBCAT000722
