Crotonaldeide: proprietà, reazioni, produzione e usi
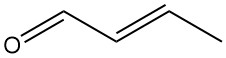
La crotonaldeide [4170-30-3], nota anche come 2-butenale, è un liquido incolore dall’odore pungente e dalle forti proprietà lacrimatorie. Ha una formula chimica CH3CH=CHCHO ed esiste come due stereoisomeri: cis-crotonaldeide [15798-64-8] e trans-crotonaldeide [123-73-9].
La crotonaldeide disponibile in commercio contiene una miscela di entrambi gli isomeri, con l’isomero trans che è la forma dominante (>95%) a causa della sua maggiore stabilità termodinamica.
La crotonaldeide si trova naturalmente in varie piante e prodotti vegetali, tra cui fagiolini, olio di colza e olio di soia.
Sommario
| Proprietà | Valore |
|---|---|
| Massa molecolare | 70,09 g/mol |
| Punto di ebollizione | 102,2 °C |
| Punto di fusione | -76 °C |
| Densità (20 °C) | 0,852 g/cm3 |
| Indice di rifrazione (n20D) | 1,438 |
| Calore di vaporizzazione | 515 J/g |
| Azeotropo crotonaldeide-acqua | 24,8% in peso di H2O |
| Punto di ebollizione dell'azeotropo | 84 °C |
| Solubilità in acqua (20 °C) | 181 g/L |
| Solubilità dell'acqua in crotonaldeide (20 °C) | 9,5 g/100 g |
| Pressione di vapore (a 20 °C) | 4,3 kPa |
| Punto di infiammabilità | 13 °C |
| Temperatura di autoaccensione | 165 °C |
| Limiti di esplosione in aria |
Inferiore: 2,1 vol% Superiore: 15,5 vol% |
2. Reazioni chimiche della crotonaldeide
La crotonaldeide è altamente reattiva a causa della presenza sia di un gruppo carbonilico che di un doppio legame carbonio-carbonio nella sua struttura. La contaminazione con acidi o alcali forti avvia facilmente reazioni di condensazione esotermiche.
L’esposizione ad acidi forti catalizza la dimerizzazione della crotonaldeide in dicrotonaldeide (5,6-diidro-2,6-dimetil-2H-piran-3-carbossaldeide).
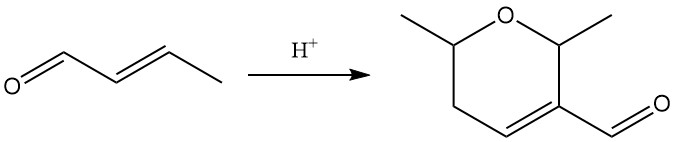
Le reazioni primarie della crotonaldeide includono idrogenazione, riduzione, ossidazione e addizione.
Sia il gruppo carbonilico che il doppio legame C-C possono subire riduzione. L’idrogenazione catalitica, che in genere utilizza catalizzatori al nichel o al rame, offre l’approccio più economico.
L’idrogenazione selettiva della frazione olefinica a temperature e pressioni di reazione inferiori era un processo precedentemente impiegato per la produzione di n-butanale. Attualmente, l’idroformilazione del propene è il metodo preferito per la sintesi della butirraldeide.
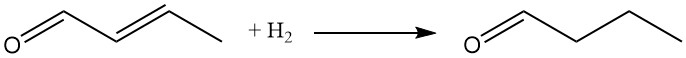
L’idrogenazione di entrambi i gruppi funzionali produce n-butanolo, comunemente prodotto oggi tramite idrogenazione della n-butirraldeide.
L’idrogenazione catalitica selettiva al gruppo carbonilico porta all’alcol crotilico (CH3CH=CHCH2OH).

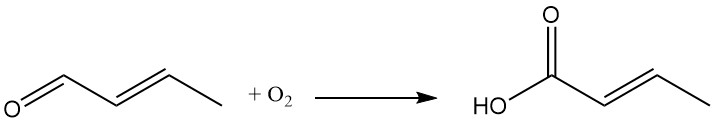
L’ossidazione della crotonaldeide porta alla formazione di acido crotonico.
L’aggiunta di varie molecole attraverso il doppio legame della crotonaldeide la rende un prezioso intermedio chimico. Ad esempio, l’aggiunta di alcoli o tioli al doppio legame olefinico, catalizzata da un catalizzatore basico, è importante per la sintesi di 3-alcossibutirraldeidi.
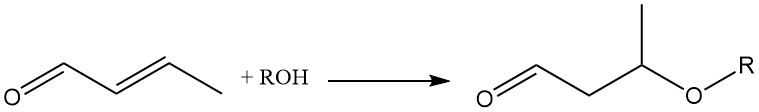
L’aggiunta di metanolo alla crotonaldeide forma l’intermedio 3-metossibutirraldeide, che subisce idrogenazione ed esterificazione consecutive per produrre solventi speciali come il 3-metossibutanolo (1) e l’acetato di 3-metossibutile (2).

La crotonaldeide può anche essere utilizzata come dienofilo nelle reazioni di Diels-Alder.
3. Produzione di crotonaldeide
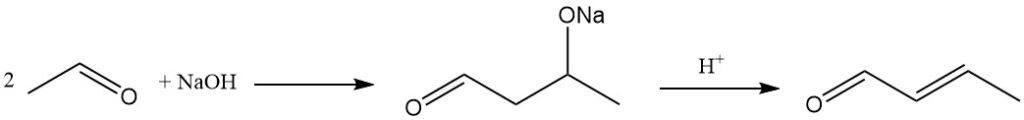
Il metodo industriale dominante per la produzione di crotonaldeide è la condensazione aldolica dell’acetaldeide, seguita dalla disidratazione dell’aldolico risultante e dalla successiva distillazione. Questo processo produce un prodotto con una purezza di circa il 99%.
La reazione di aldolizzazione può essere catalizzata da un’ampia gamma di catalizzatori basici, tra cui catalizzatori di metalli alcalini o alcalino-terrosi, sali di ammonio, zeoliti, setacci molecolari e materiali simili all’argilla.
Acido acetico, acidi minerali o resine a scambio cationico acide vengono utilizzati come catalizzatori per la fase di disidratazione che converte l’aldolo in crotonaldeide.
Celanese Chemicals e Daicel sono i principali produttori commerciali di crotonaldeide. Un’unità di produzione continua semplificata di crotonaldeide è illustrata nella Figura 1.
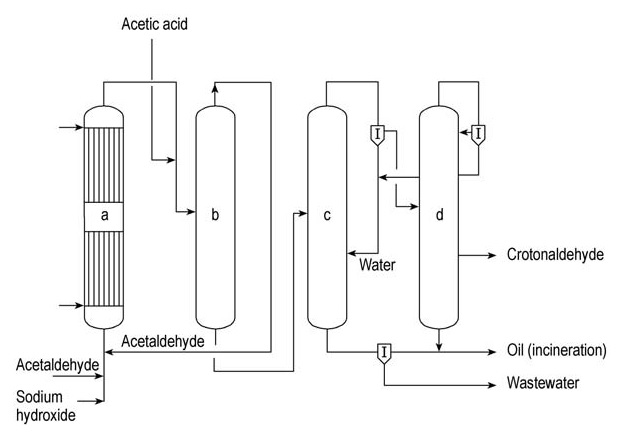
a) Reattore aldolico; b) Colonna di strippaggio dell'acetaldeide; c) Colonna di distillazione azeotropica; d) Colonna di rettifica
In questo processo, l’acetaldeide subisce l’aldolizzazione in un reattore aldolico raffreddato ad acqua (a) utilizzando una soluzione acquosa di idrossido di sodio come catalizzatore. Il prodotto viene quindi neutralizzato con acido acetico prima di essere immesso in una colonna di stripping (b).
L’acetaldeide non reagita viene recuperata nella parte superiore di questa colonna e riciclata nuovamente nel reattore aldolico (a). Il prodotto inferiore della colonna (b), l’aldolico intermedio, viene immesso nella colonna di distillazione dell’azeotropo (c). Qui, l’aldolico subisce disidratazione e l’azeotropo crotonaldeide-acqua viene distillato.
Questo azeotropo viene successivamente separato in acqua e una fase acquosa di crotonaldeide contenente circa il 10% di acqua. L’acqua viene riciclata nella colonna azeotropica (c), uscendo come prodotto di fondo.
Il flusso di crotonaldeide acquosa viene quindi immesso nella colonna di rettifica (d), dove si forma un altro azeotropo crotonaldeide-acqua che esce in alto. Questo azeotropo viene separato in acqua, che viene riciclata nella colonna azeotropica (c), e crotonaldeide acquosa, che viene riciclata nella colonna di rettifica (d).
Da questa colonna si ottiene crotonaldeide pura come flusso laterale.
Le frazioni pesanti vengono rimosse dal fondo della colonna (d) e combinate con residui organici dalla colonna azeotropica (c) prima di essere incenerite. Le acque reflue generate dalla colonna (c) vengono trattate in un impianto di depurazione dedicato.
Metodi di produzione alternativi
Sebbene la condensazione aldolica dell’acetaldeide resti il metodo industriale dominante, sono state esplorate tecnologie alternative. Un metodo è l’ossidazione del butadiene al suo monoepossido, seguita dall’isomerizzazione a crotonaldeide.
Questo processo presenta alcune somiglianze con il processo Wacker-Hoechst per la produzione di acetaldeide dall’etilene. Tuttavia, l’uso del paraldol come alternativa all’aldol per la produzione di 1,3-butilene glicole di grado cosmetico sembra essere più promettente della sua applicazione nella sintesi di crotonaldeide.
Altri metodi, come l’ossidazione catalitica di olefine, la deidrogenazione dell’alcool allilico con ammine, l’idratazione in fase vapore di acetilene e l’ossidazione enzimatica del 2-butene, non hanno raggiunto un’importanza pratica per la produzione di crotonaldeide.
La crotonaldeide può anche essere formata come sottoprodotto durante la sintesi di 1,3-butilene glicole e nella produzione di acido acetico tramite carbonilazione del metanolo. Inoltre, i processi di combustione incompleta, come quelli che si verificano negli scarichi delle automobili, generano crotonaldeide come componente dei gas di scarico.
4. Utilizzi della crotonaldeide
La crotonaldeide è utilizzata come precursore nella sintesi di vari prodotti industriali.
Grandi quantità di crotonaldeide sono utilizzate nella produzione di acido sorbico, un comune conservante alimentare. La sintesi prevede la condensazione della crotonaldeide con chetene in presenza di sali organici di zinco, seguita dalla depolimerizzazione del poliestere risultante, termicamente o utilizzando un acido minerale.
L’α-tocoferolo, uno degli otto componenti naturali con attività di vitamina E, è sintetizzato industrialmente tramite la condensazione del fitolo con 2,3,6-trimetilidrochinone che è formato da crotonaldeide e dietilchetone attraverso un processo in quattro fasi.
Il 3-metossibutanolo è prodotto dall’aggiunta di metanolo alla crotonaldeide seguita da idrogenazione. Questo prodotto e il suo estere acetato sono usati come solventi speciali, particolarmente apprezzati per la loro capacità di controllare la viscosità, il comportamento di essiccazione e la lucentezza in lacche e vernici.
La crotonaldeide è un precursore per un’ampia gamma di intermedi chimici. Un esempio primario è l’acido crotonico, ottenuto dall’ossidazione della crotonaldeide. Questi intermedi derivati dalla crotonaldeide sono utilizzati in vari settori, tra cui:
- Prodotti farmaceutici e biocompatibili/medici
- Prodotti agrochimici
- Resine, addensanti polimerici
- Vernici e rivestimenti
- Coloranti
- Gomme e antiossidanti della gomma
- Indurimento della gelatina
- Adesivi
- Concia e collatura della pelle (pelle e carta)
- Sbiancanti per metalli
- Lubrificanti
- Inibitori di corrosione
5. Tossicologia della crotonaldeide
La crotonaldeide rappresenta un rischio significativo per la salute a causa delle sue potenti proprietà irritanti. Ecco una ripartizione dei suoi effetti:
Effetti sulla salute umana
- La crotonaldeide irrita gli occhi, la pelle e le vie respiratorie. Gli studi suggeriscono soglie variabili per l’irritazione, che vanno da 0,035 ppm a 0,56 ppm per il rilevamento dell’odore e l’irritazione, rispettivamente.
- L’inalazione può causare sensazioni di bruciore al naso e alle vie respiratorie, lacrimazione, tosse, broncocostrizione e potenzialmente edema polmonare o danni polmonari profondi.
- La crotonaldeide è presente nel fumo di tabacco, nei gas di scarico dei motori e nella combustione della legna. Si trova anche naturalmente in alcuni alimenti.
Limiti di esposizione professionale
In assenza di livelli specifici di esposizione professionale, linee guida come AEGL (livelli guida di esposizione acuta) ed ERPG (linee guida per la pianificazione della risposta alle emergenze) possono essere utilizzate per la valutazione del rischio durante incidenti o emergenze.
Dati tossicologici
Tossicità acuta:
- LD50 orale (ratto): 174 mg/kg
- LC50 inalatoria (ratto, maschio, 4 ore): 336 mg/m3
- LD50 cutanea (cavia): 26 mg/kg
Genotossicità: mentre la crotonaldeide forma addotti in vitro (in un ambiente di laboratorio), le prove di mutagenicità in vivo sono meno chiare.
La crotonaldeide è classificata come mutagena secondo il Regolamento CLP (CE) n. 1272/2008.
Effetti su animali e microrganismi
Animali:
- I pesci sono le specie più sensibili alla crotonaldeide, con una LC50 a 96 ore (concentrazione letale per il 50% della popolazione) di 0,65 mg/L per la trota iridea.
- La crotonaldeide irrita le vie respiratorie in vari animali, con i ratti che sono i più sensibili (LC50 per inalazione a 4 ore di 120 ppm).
I microrganismi sono meno sensibili degli animali, con Pseudomonas putida che mostra una EC10 a 18 ore (concentrazione effettiva per il 10% della popolazione) di 10,4 mg/L.
La crotonaldeide è classificata come inquinante marino nonostante la sua elevata biodegradabilità (> 83%).
Riferimenti
- Crotonaldehyde and Crotonic Acid; Ullmann’s Encyclopedia of Industrial Chemistry. – https://onlinelibrary.wiley.com/doi/10.1002/14356007.a08_083.pub2
- CROTONALDEHYDE; IARC MONOGRAPHS VOLUME 63. – https://publications.iarc.fr/81
